关键词:单相动作电位;复极不均一性;心室肌;索他洛尔
【摘要】 目的 观察索他洛尔对兔在体心脏左心室壁各层心肌复极的影响,以证实在体心肌M细胞的存在,探讨其与心律失常的关系。 方法 采用单相动作电位(monophasic action potential,MAP)记录技术,同步记录12只开胸兔左心室外膜心肌(epicardium,Epi)、中层心肌(mid-myocardium,Mid)和心内膜心肌(endocardium,Endo)的MAP,静脉注射索他洛尔后,测量3层心肌MAP的复极时限和跨心室壁心肌复极离散度(transmural dispersion of repolarization,TDR)。 结果 ①用药前Epi、Mid、Endo的MAP100%复极时限(APD100 )分别为(136±16)、(152±19)、(150±20)ms,TDR为(17±8)ms。每间隔30 min静脉注射索他洛尔0.5、1.0、1.5和2.0 mg. kg-1 后发现,索他洛尔剂量依赖性延长3层心肌的APD100 ,其中以延长Mid的APD100 更为明显,对Epi和Endo的APD100 延长程度相近,使TDR增加;至静脉注射2.0 mg. kg-1 后,Epi、Mid、Endo的APD100 分别为(177±30)、(234±32)、(194±30)ms,TDR为(57±15)ms(P<0.05);②索他洛尔剂量依赖性地增加尖端扭转性室性心动过速(torsade de pointes,TDP)的发生率。 结论 在体兔心肌存在M细胞。索他洛尔增加兔在体心脏左心室壁心肌复极不均一性,其致心律失常作用发生机制可能与此有关。
Experimential study on myocardial repolarization heterogeneity across the left ventricular wall in vivo
LI Yuntian,ZHANG Cuntai,LU Zaiying,et al.
(The Cardiology Department,The Tongji Hospital of Tongji Medical University,Wuhan 430030,China)
【Abstract】 Objective To observe the effect of sotalol on repolarization heterogeneity across the left ventricular wall,and confirm the existence of M cells in rabbit in vivo. Methods With the monophasic action potential (MAP) recording technique,MAPs of epicardium(Epi),mid-myocardium(Mid) and endocardium(Endo) were recorded by specially designed plunge-needle electrodes at the left ventricular myocardium in 12 open-chest rabbits.Action potential duration at 100% repolarization(APD100 )and transmural dispersion of repolarization(TDR) were measured. Results ①Before intravenous injection of sotalol,APD100 in Epi、Mid and Endo were (136±16)、(152±19)、(150±20)ms,TDR was (17±8)ms.After intravenous injection of sotalol with different doses,APD100 were prolonged dose-dependently in all three myocardial layers,but more markedly in Mid,and as a result,TDR was increased obviously.When the dose of 2.0mg. kg-1 sotalol was used,APD100 were (177±30)、(234±32)、(194±30) ms in Epi、Mid and Endo,TDR(57±15) ms(P<0.05);②Sotalol increased the incidence of torasde de pointes with dose-dependence. Conclusion The M cells do exist in vivo rabbit myocardium.Sotalol increases repolarization heterogeneity across the left ventricular wall and its proarrhythmic effect might be related to that.
【Key words】 Monophasic action potential; Repolarization heterogeneity; Ventricular myocardium; Sotalol
离体实验研究表明,跨室壁心外膜心肌(epicardium,Epi)、中层心肌(mid-myocardium,Mid)和心内膜心肌(endocardium,Endo)的复极存在差异,其与心律失常的发生有十分密切的关系[1] 。在体心肌各层之间是否存在复极差异,目前报道结果不一致[2,3] 。索他洛尔属Ⅲ类抗心律失常药物,离体实验已证实其致尖端扭转性室性心动过速(torsade de pointes,TDP)的发生与其增加心肌复极不均一性有关[4] 。本实验采用单相动作电位(monophasic action potential,MAP)记录技术,同步记录在体兔Epi、Mid和Endo的MAP,观察应用索他洛尔后各层心室肌复极特性的变化。
资料和方法
健康家兔12只,体重2~3 kg,雌雄不限。常规麻醉、人工呼吸、开胸,充分暴露心脏的左前侧壁。右股静脉插管用于给药和输液,右股动脉插管用于动脉血压监测。
MAP电极的制备与安放 Epi电极用直径0.3 mm外壳包被有聚四氟乙烯的银丝,制成吸附式电极固定于左心室前侧壁心外膜表面。Mid电极用与心外膜电极相同的银丝,插入制成槽状的注射器针头内,使头端稍突出于槽的平面,通过针头引导插入中层心肌内,插入深度为电极头端距心外膜表面2.5 mm。插入点尽量靠近心外膜电极。Endo电极与上述电极相同的银丝,头端制成2 mm的小钩,通过注射器针头插入心腔,退出注射器针头,电极遂留于心腔内,调节电极的位置,使其与心内膜紧密接触,插入电极处尽量靠近Epi电极。参考电极固定于家兔胸壁皮下。
实验参数记录 (1)上述3层心肌的MAP电极均与BL-310生物信号采集与处理系统(泰盟电子有限公司生产,四川成都)相连,同步记录3层心肌的MAP;(2)针形电极置于动物四肢皮下和胸部,记录体表心电图。
实验步骤 MAP稳定10 min后,记录对照图形和体表心电图,首次注射索他洛尔0.5 mg. kg-1 ,然后每间隔30 min静脉注射索他洛尔1.0、1.5和2.0 mg. kg-1 ,每次5 min内注射完,于每次注射30 min后测量实验指标。索他洛尔为消旋体(d,1,Sotalol),由德国海德堡医学院赠送。
分析指标 (1)心电图参数:①测量心率,QT间期;②TDP指发生在QT(u)间期延长基础上连续5个或5个以上的QRS波围绕等电位线改变极性的频率大于200次/min的室性心动过速;(2)MAP参数:①MAP复极100%时限(MAP100 ):MAP0期至复极到等电位线之间的水平距离;②跨室壁复极离散度(transmural dispersion of repolarization,TDR):3层心肌最长的和最短的MAP100 之间的差异。
统计学处理 采用t检验和方差分析比较用药前后各参数差异的显著性(实验数据以均数±标准差表示)。
结 果
1.索他洛尔对心电图参数的影响(表1)
表1 应用索他洛尔前后心电图参数的变化(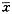
| 用药剂量 | 心率(次/min) | QT间期(ms) | QRS时限(ms) |
| 用药前 | 203±41 | 150±20 | 69±21 |
| 0.5 mg. kg-1 | 192±37 | 157±23 | 72±21 |
| 1.0 mg. kg-1 | 178±33 | 166±25 | 75±23 |
| 1.5 mg. kg-1 | 161±30** | 175±27* | 78±22 |
| 2.0 mg. kg-1 | 140±28*** | 194±30** | 79±24 |
索他洛尔剂量依赖性地降低心率,延长QT间期。静脉注射索他洛尔1.5mg. kg-1 和2.0mg. kg-1 30 min后,心率和QT间期与用药前相比具有统计学差异(P<0.05)。
2.索他洛尔对3层心肌单相动作电位参数的影响
从表2中可以看出,索他洛尔剂量依赖性地延长3层心肌的APD100 ,其中以中层心肌的APD100 延长最明显,对Epi和Endo的APD100 延长程度近似,使TDR增加。至静脉注射索他洛尔1.5mg. kg-1 和2.0mg. kg-1 后,TDR与用药前相比差异有显著性。图1显示,随着索他洛尔剂量的增加,TDR逐渐增大。
表2 不同剂量索他洛尔对3层心肌单相动作电位
时限的影响(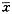
| 用药剂量 | Epi-APD100 | Mid-APD100 | Endo-APD100 | TDR |
| 用药前 | 135±16 | 154±19 | 150±20 | 19±9 |
| 0.5 mg. kg-1 | 142±20 | 165±24 | 157±22 | 23±10 |
| 1.0 mg. kg-1 | 154±23 | 181±27* Δ | 166±24 | 27±14 |
| 1.5 mg. kg-1 | 163±24* | 200±29* * ΔΔ | 175±26* | 37±16* |
| 2.0 mg. kg-1 | 176±26* * | 223±30* * * ΔΔΔ | 198±28* * | 47±20* * |
3.索他洛尔对尖端扭转性室性心动过速的作用
静脉注射索他洛尔0.5mg. kg-1 和1.0mg. kg-1 后,12只兔无1例发生TDP。剂量增至1.5mg. kg-1 和2.0mg. kg-1 后,12只兔分别有1和4只发生了TDP。可诱导TDP的动物的TDR为(66±28)ms,不能被诱导TDP的动物的TDR为(28±25)ms,两组相比具有统计学差异(P<0.05)。图2为静脉注射索他洛尔2.0 mg. kg-1 后诱发的TDP。


图2 索他洛尔诱发尖端扭转性室性心动过速
讨 论
Sicouri等[5] 在离体研究中发现,位于犬心外膜下深层至心内膜下深层的心肌细胞具有独特的电生理特性,并称之为M细胞。进一步研究发现许多动物如猫、兔、豚鼠和人的心肌中均含有M细胞[6] 。人的M细胞约占人心脏左心室壁构成的40%左右[7] 。与心外膜心肌细胞和心内膜心肌细胞相比,M细胞显著的电生理特性是其动作电位时限在慢频率和/或在延长动作电位的药物作用下明显延长。由于离体环境很难反映在体心肌的病理生理情况,在体心肌是否存在M细胞,尚需在体实验中验证。
近年来研究认为MAP可间接反映心肌细胞的动作电位,在一定程度上可代替心肌细胞的跨膜动作电位(TAP)[8] 。Epi和Endo的MAP记录方法已趋于成熟,但Mid的MAP记录报道甚少[9] 。Anyukhovsky等[10] 在离体实验中用刀片分离获得左心室透壁心肌条,记录不同部位的TAP,发现切割损伤并不影响心肌细胞的TAP。本实验采用插入电极置于Mid内,对心肌细胞的损伤小,记录的MAP图形曲线光滑,波形稳定,与Epi和Endo的MAP相似,与文献报道一致[11] 。表明同步记录兔在体心肌Epi、Mid和Endo的MAP是研究心肌复极不均一性的较可靠方法。
以往多采用阻断房室结在减慢心室率的情况下,研究在体心室肌复极不均一性[2,3] 。本实验采用静脉注射索他洛尔的方法,其优点在于索他洛尔不但降低心率,使M细胞的电生理特性得以表现,而且可模拟临床情况更加真实地探讨索他洛尔对在体心肌的致心律失常作用是否与心室肌复极不均一性有关。
本实验结果显示,用药前3层心肌的TDR为(17±8)ms;索他洛尔剂量依赖性地延长Epi、Mid和Endo的复极时限,但Mid的延长较Epi和Endo更加明显,使跨心室壁心肌复极离散增加。至静脉注射索他洛尔2.0 mg. kg-1 后,3层心肌的TDR为(57±15)ms,与离体实验中得到的结果一致,表明在体心肌存在M细胞,索他洛尔呈剂量依赖性的增加在体心肌复极不均一性。
心肌复极不均一性易造成心肌横断面上不应期的离散,导致折返性心律失常[12] 。本实验显示,用药前3层心肌复极也存在差异,并无心律失常的发生,原因是TDR较小,心脏冲动不足以在3层心肌中形成折返。应用索他洛尔后随着剂量增大,TDR也增加,至一定程度便导致折返性心律失常。能被诱发TDP动物的TDR与不能被诱发TDP动物的TDR相比明显延长,提示索他洛尔的致TDP作用与其增加心肌复极的不均一性有关。
基金项目:卫生部科研基金课题98-2-095
参 考 文 献
1,Antzelevitch C,Sicouri S,Litovsky SH,et al.Heterogeneity within the ventricular wall:electrophysiology and pharmacology of epicardial,endocardial and M cells.Circ Res,1991,69∶1427-1449.
2,El-Sherif N,Caref EB,Yin H,et al.The electrophysiological mechanism of ventricular arrhythmias in the long QT syndrome:tridimensional mapping of activation and recovery patterns.Circ Res.1996,79∶474-492.
3,Anyukhovsky EP,Sosunov EA,Feinmark SJ,et al.Effects of quinidine on repolarization in canine epicardium,mid-myocardium,and endocardium Ⅱ.In vivo study.Circulation,1997,96∶4019-4026.
4,Sicouri S,Moro S,Litovsky S,et al.Chronic amiodarone reduces transmural dispersion of repolarization in the canine heart.J Cardiovasc Electrophysiol.1997,11∶1269-1279.
5,Sicouri S,Antzelevitch C.A subpopulatuon of cells with unique electrophysiological properties in the deep subepicardium of the canine ventricle:the M cell.Circ Res,1991,68∶1729-1741.
6,Weirich J,Bernhardt R,Loewen N,et al.Regional-and species-dependent effects of K+ -channel blocking agents on subendocardium and mid-wall slices of human,rabbit,and guinea pig myocardium.Pflugers Arch,1996,431∶R130.
7,Drouin E,Charpentier F,Gauthier C,et al.Electrophysiologic characteristics of cells spanning the left ventricular wall of human heart:evidence for presence of M cells.J Am Coll Cardiol,1995,26∶185-192.
8,Franz MR.Method and theory of monophasic action potential recording.Prog Cardiovasc Dis,1991,33∶347-368.
9,Wang YG,Hariman RJ,Gintant GA,et al.A method for recording of intermyocardium monophasic action potential in intact dogs:in vivo evidence of M cells.PACE,1992,15∶559.
10,Anyukhovsky EP,Sosunov EA,Rosen MR.Regional differences in electrophysiological properties of epicardium,mid-myocardium,and endocardium:in vitro and in vivo correlation.Circulation,1996,94∶1981-1988.
11,Barrett TD,Macleod BA,Walker MJA.A model of myocardial ischemia for the simultaneous assessment of electrophysiological changes and arrhythmias in intact rabbits.J Pharmacol and Toxicolo Methods,1997,37∶27-36.
12,Antzelevitch C,Sicouris S.Clinical relevance of cardiac arrhythmias generated by afterdepolarization:the role of M cells in the generation of U waves,trigged activity and torsade de pointes.J Am Coll Cardiol,1994,23∶259-277.
2000-03-25 , 百拇医药