 |
 |
关键词:胃恶性淋巴瘤;单克隆性;幽门螺杆菌
【摘要】 目的 探讨胃粘膜相关淋巴组织(MALT)淋巴瘤与幽门螺杆菌(Hp)感染的关系和各种不同层次检测方法的诊断价值。方法 对31例MALT淋巴瘤作Giemsa染色查Hp、免疫组化染色、半巢式PCR扩增进行IgH基因重排,检测其单克隆性。以同期胃淋巴细胞性胃炎(LG)、无关疾病胃粘膜作对照。结果 胃MALT淋巴瘤中Hp感染率83.9%,单克隆性重排87.1%,远高于对照组。但免疫组化染色显示的轻链限制性仅55.6%。结论 PCR法检测IgH基因重排优于免疫组化染色检测轻链限制性。在LG中发现26.9%有单克隆性B细胞增生,提示PCR法敏感性高,可能具有早期诊断价值。
Detection of Monoclonality and relationaship between H.pylori infection and malignant gastric lymphoma
OUYANG Qin, GAN Huatian, LI Gandi, et al.
First University Hopsital, West China Unviersity of Medical Sciences, Chengdu, 610041
【 Abstract 】 Objectives To determine the relationship between MALT lymphoma and H. pylori infection and the application value of different methods in detecting their monoclonality.Methods Basing on the reinvestigation of histochemistry, Geimsa staining was used for detecting H.pylori, and immunohisto chemistry (IHC), seminested PCR amplification were used to detcte monoclonality in 31 cases of gastric MALT lymphoma. Lymphocytic gastritis diagnosed at the same period and normal gastric mucosae were selected as control. For immunohistochemistry, KiB5, L26-Anti κ , Anti λ , UCHL-1 were used as the first antibodies. For PCR amplification, primer Fr3A, Fr2A and LTH, VLTH from V and J regions respectively were used for detecing IgH gene rearrangement. Results The results showed 83.9% of MALT lymphoma were associated with H. pylori infection and 87.1% were monoclonal gene rearrangement, which being much higher than those in control group and light Chain limitation measurementby IHC. Conelusion PCR IgH gene rearrangement was better than immunohistochemical staining in the determination of monoclonality either from the viewpoint of specificity or sensitivity. In lymphocytic gastritis group, there are 26.9% monoclonal proliferation by PCR amplification unexpectedly, implying higher sensitivity of the method and possible use in the early diagnosis of the disease.
【 Key words 】 Gastric MALT lymphoma Monoclonality H. pylori
原发性胃恶性淋巴瘤(PGML)虽属少见,但在结外淋巴瘤中最多。世界各地有增多之势。且多来源于胃粘膜相关淋巴组织(MALT)。近年来,有不少报告提示其与幽门螺杆菌(Hp)感染有关。Isaacson等研究发现[1] ,Hp等抗原刺激使胃粘膜淋巴组织从无到有,由良到恶,由淋巴细胞性胃炎(LG)而发生淋巴瘤,对其重新分类并指明了研究的方向。由于MALT淋巴瘤长期局限,进展缓慢,预后良好,部分用抗Hp治疗而消退。但是,该病形态学判断有一定困难,人们寻找不同的研究方法试图作出早期诊断,甚至找出癌前期的标记。因此,本文试图从形态学、免疫组化(IHC)及分子遗传学等角度探讨疾病的病理特征以及各种方法的临床应用价值。
材料和方法
一、搜集我院病理科1976~1996年保存的手术与活检的石蜡标本,筛选符合Dawnson标准[2] 的PGML;搜集同期LG,筛选符合Dixon标准者[3] ,即胃镜诊断的慢性胃炎有糜烂或疣状改变,上皮细胞中有大量淋巴细胞浸润,达25%~40%;并搜集同期无关胃疾病的胃组织(如反流性食管炎、胃息肉及胃平滑肌瘤等)作对照。
二、全部病例重新作石蜡切片,专人作组织形态学鉴定,改良的Geimsa染色,油镜下观察Hp。
三、淋巴瘤按Isaacson方案[4] 重新分类。
四、免疫组化(IHC)染色采用LSAB和PAP法。选用的第一抗体KiB5(德国Kiel大学Lennert教授赠)、L26、Anti-κ、Anti-λ、UCHL-1(Dako公司)。
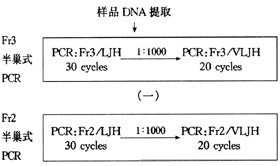
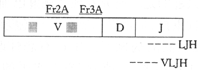
五、MALT瘤及LG的IgH基因重排检测:常规方法提取DNA,4°C保存,采用半巢式PCR扩增,引物选自互补于IgH基因V区及J区保守序列的Fr3A、Fr2A及LTH、VLTH片段(德国Driston大学Thiede博士赠送),图示如下:
参照Diss方法[5] ,PCR扩增流程简示如下:
每次循环包括94°C 1分钟,60°C 1分钟,72°C 2分钟,循环开始前先经94°C预变性10分钟,结束时72°C延伸10分钟。30个循环后,产物以双蒸水稀释1∶1000倍后作第二次扩增。扩增条件同前,但循环数为20次。8%PAGE电泳分析PCR产物。
阳性对照为Raji细胞株,阴性对照无模板DNA。
结果
一、一般资料
39例PGML中,男20例,女19例,年龄为15~76岁,平均40岁,病程1个月~15年,平均29.6个月。术前误诊31例,其中胃癌26例,胃溃疡5例。
二、各组Hp检出情况
如表1所示。淋巴瘤周围组织炎症程度、淋巴滤泡数量与Hp感染密度呈正相关(细节详另文)[6] 。
表1 各组Hp检出率
| PGML瘤(%)* n=39 | LG(%) n=26 | 无关胃疾病(%) n=11 |
| 34(87.2) | 14(53.8) | 5(45.5) |
三、PGML组织学与免疫组化
结果见表2。提示均为B细胞淋巴瘤,低恶性14例(35.9%),高恶性25例(64.1%),高恶性中高低恶性并存者11例(44.0%);MALT来源者占36例(92.3%),但IHC提示明确的轻链限制者仅22例(56.4%),在MALT瘤中占20例(55.6%)。
表2 PGML组织学与IHC及Hp检测结果
| 组织学类型 | 例数 | KiB5 | L26 | κ | λ | UCHL-1 | Hp+ve(%) |
| B细胞低恶性 | |||||||
| MALT瘤 | 13 | 5 | 8 | 2 | 5 | 0 | 11(84.6) |
| 浆细胞 | 1 | - | 1 | 0 | 1 | 0 | 1 |
| B细胞高恶性 | |||||||
| MALT瘤 | 23 | 13 | 10 | 9 | 4 | 0 | 20(87.0) |
| 中心母细胞性 | 1 | 1 | - | 1 | 0 | 0 | 1 |
| 免母细胞性 | 1 | - | 1 | 0 | 0 | 0 | 1 |
| 总计 | 39 | 19 | 20 | 12 | 10 | 0 | 34(87.2) |
Fr3或Fr2扩增产物经8%PAGE电泳、EB染色,可见单一的特异性条带,示单克隆性重排,而浅淡均匀的弥漫带(Smear)示多克隆性重排。重排结果如表3所示。
其中胃镜标本13例,有11例检出,检出率为84.3%;手术标本18例,有16例检出,检出率为88.9%,两者差异有显著性(P<0.05)。
五、MALT淋巴瘤及LG之Hp感染与IgH基因单克隆重排
结果可总结如表4。提示MALT淋巴瘤中Hp检出率较对照组为高,但是Hp阴性病例中亦有4例(80%)出现单克隆重排,表明Hp是否阳性与单克隆性重排关系不大;LG中7例出现单克隆重排,而Hp阳性者明显高于阴性者。
表3 PCR检测IgH基因单克隆重排
| MALT瘤 n=31 | LG n=26 | 对照 n=11 | P值 | |
| Fr3(%) | 23(74.2) | 5(19.2) | 0 | <0.05 |
| Fr3+Fr2(%) | 27(87.1) | 7(26.9) | <0.05 |
| 组别 | 例数 | Hp感染(%)* | 单克隆性重排(%) | P值 |
| MALT瘤 | 31 | +ve 26(83.9) -ve 5 | 23(88.5) 4(80.0) | >0.05△ |
| LG | 26 | +ve 14(53.8) -ve 12 | 6(42.9) 1(8.3) | <0.05 |
| 无关胃疾病 | 11 | +ve 5(45.5) -ve 6 | 0 0 |
讨论
本文结果显示,PGML中MALT瘤占绝大多数,且均为B细胞性,其Hp检出率明显高于对照组。瘤周组织炎症程度、淋巴滤泡与Hp密度的关系已有另文报告,均提示Hp在PGML及淋巴细胞性胃炎发生中有重要的作用[7,8] 。Isaacson等提出Hp感染引起粘膜免疫反应,由Hp抗原驱动的T细胞激活,引起B细胞增殖等导致慢性炎症,可能为自身免疫反应性炎症。在少数含有遗传学改变的个体,其B细胞可能存在某种异常改变(如染色体的3,三体性),可致单克隆增殖,从而形成MALT淋巴瘤,这一假说似乎可以解释细菌感染引致肿瘤的结果。其机制尚需深入研究。本文IgH基因重排分析表明,MALT淋巴瘤组中无论Hp是否存在,其单克隆性重排的检出率差异不大,提示除Hp感染外,可能尚有其他病因影响胃MALT淋巴瘤的发生。
PGML组织学改变较为复杂,良恶性鉴别上存在一定困难。近年来免疫学及IHC技术的应用,特别是多种B细胞特异性标记物的选用对确定细胞的单克隆性增殖颇有帮助,从而提供了辨别良恶性的依据,如通常使用的全B细胞单抗及κ、λ抗体,可以明确细胞的来源及轻链限制性。但是,由于部分B细胞分化较低、选用抗体本身的局限性、组织固定不良或石蜡切片所致抗原丢失等等,使30%~40%的肿瘤不能显示肯定的轻链限制,导致从蛋白水平的单克隆性检测在判断上的困难。本文较低的轻链限制性检出率亦说明结果不尽如意。
PCR IgH基因重排分析可以从DNA水平检测细胞的克隆性,单克隆者扩增产物为单一的分离的条带,而多克隆者为一弥散的条带。联合使用Fr3及Fr2半巢式PCR,提高了检出率及特异性,与Diss等报告相似,较Southern杂交法简便。该技术对手术及活检标本的检出率相似,可用于术前确诊、术后随访及低度恶性病例药物治疗后的动态观察,尤其对IHC诊断困难的病例更有价值。由此,可使该病的研究从形态学、免疫组化的“二维”水平上升到分子遗传学的水平。对病理组织判断有疑问者,亦可进行免疫组化及PCR检测确定B细胞的单克隆性。
饶有兴趣的是本研究发现7例淋巴细胞性胃炎有单克隆性重排,是否提示形态学与免疫组化(蛋白水平)未能检测的病例实际上已有恶性改变(PCR技术提高了检出率)。或者DNA水平的恶性克隆变化,先于转录及表达,可以早期诊断癌前病变[9] ,值得深入研究。对这些患者的追踪观察将有助于明确淋巴瘤恶性克隆的确切位点,并有利于确定这一分子遗传学检测手段对该病早期诊断的价值。
参考文献
[1]. Issacson PG. Recent development in our understanding of gastric lymphoma. Am J Surg Pathol, 1996, 20(suppl.1):1-7.
[2]. Dawnson ZMP. Primary malignant lymphoid tumors of the gastrointestinal tract. Br J Surg, 1961, 49:80-82.
[3]. Dixon ME, Genta RM, Yardley JH, et al. Classification and grading of gastritis. Am J Surg Pathol, 1996, 20:1160-1170.
[4]. Issacson PE, Spencer J, Wright DH. Classifying primary gut lymphoma. Lancet, 1989, 2:1149.
[5]. Diss TC, Peng H, Wotherspoon AC, et al. Detection of monoclonality low grade B-cell lymphomas using the polymerase chain reaction dependent on primer selection and lymphoma tpe. J Pathol, 1993, 169:291-295.
[6]. 易智慧,欧阳饮,李甘地.原发性胃恶性淋巴瘤与幽门螺杆菌感染的相关性初探.中华内科杂志,1997,36:442-445.
[7]. Weber DM, Meletios A, Dimopaulos MA, et al. Regression of gastric lymphoma of mucosa-associated lymphoid tissue with antibiotic therapy for H. pylori. Gastroenterol, 1994, 107:1835-1838.
[8]. Miettinen A, Karttunen TJ, Alavaikko M. Lymphocytic gastritis and H. pylori infection in gastric lymphoma. Gut, 1995, 37:471-476.
[9]. 朱梅刚.恶性淋巴瘤克隆性基因重排检测.朱梅刚,周志韶主编.淋巴组织增生性疾病病理学.广州高等教育出版社,1994,25-39.
(收稿:1997-12-05 修回:1998-04-17) , http://www.100md.com