大容量注射剂的安全隐患及管理对策
 |
 |
 |
 |
 |
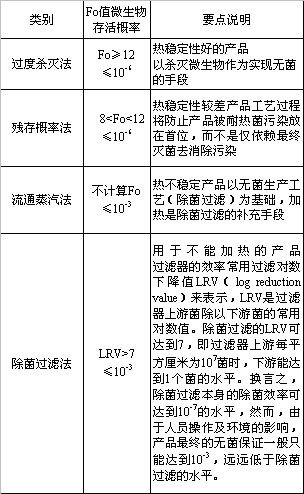
众所周知,“欣弗”不良事件的发生原因就是企业在生产过程中违反规定生产,未按批准的工艺参数灭菌,降低灭菌温度,缩短灭菌时间,增加灭菌柜装载量,影响了灭菌效果,给公众健康和生命安全带来了严重威胁,并造成了恶劣的社会影响。
本耐ü源笕萘孔⑸浼猎谏讨形蘧觳榛方诘姆治觯教执笕萘孔?br>射剂的安全隐患及控制与监管对策,以期提高其安全性。
——编者按
■《无菌检查》方法验证的启示
无菌检查方法验证的目的是验证无菌检查方法的适用性,即检品及操作程序对检品中污染菌的生长无不良影响。简单说来,它需要通过系统的试验,证明培养基促进微生物生长的能力(俗称灵敏度试验)。同时,由于检品可能有抑菌作用,还需要验证无菌检查中所用中和剂的适用性,证明淋洗液的用量足以消除检品可能的抑菌作用且不得使污染菌在淋洗过程中受到伤害而导致假阴性的结果。药典中无菌检查方法验证中对照菌的选择,有它深刻的内涵。
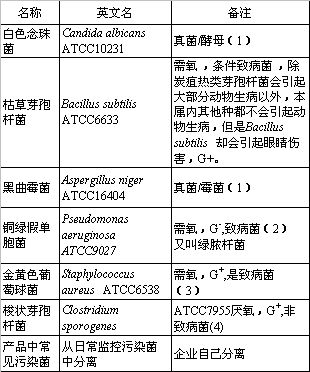
表1:美国药典29版通则第71章《无菌检查》中,规定了无菌检查的方法验证中应使用如下对照菌:
(备注栏是作者对照菌所作的说明)
美国药典选择这些对照菌的基本条件是它们的代表性,因为,无菌检查方法验证的最终目的,是证明该无菌检查方法的普遍适用性,即经验证的方法能检查出污染产品的任何类型的细菌和真菌。对照菌包括了真菌(酵母和霉菌)、需氧菌和厌氧菌,致病菌和非致病菌,产生芽孢和不产生芽孢的细菌,产生内毒素和不产生内毒素的细菌,以及革兰氏阳性菌和革兰氏阴性菌。换言之,它们代表了微生物分类学描述的自然界存在的各种类型的微生物,当然也包含了从洁净区环境监测及产品中分离出来的各种类型的微生物,因为在生产过程中,它们确实有可能污染产品。最后一项为企业从日常监控中的常见分离菌,通常不会超过前6种菌的范围。增加这一项,体现了药品监督管理部门对企业实际生产控制措施的强化。
两家合资企业10多年来对从环境、人员和产品中分离得到的污染菌用微生物生化鉴别系统(Analytical Profile Index)进行的上千个鉴别结果也说明了药典对照菌的选择,符合普遍适用性的要求。因此,人们可以从另一个角度来审视所列的对照菌,得出"对照菌一栏表是无菌药品生产常见污染菌真实写照"的结论。通过这两家企业十多年积累的微生物鉴别、耐热性等数据资料的分析可得出以下认知:
1.人是无菌药品生产中主要的污染源,人员操作所致的污染率超过70%。应当指出,这一数据出自管理比较到位,生产设备自动化程度较好,操作人员素质较高的企业。显然,企业的情况不同 ......
您现在查看是摘要页,全文长 12459 字符。