早期肠道营养对严重烧伤大鼠肝巨噬细胞活化状态的影响
作者:朱 云 于 晟 常 霖 钟晓玲 马丽梅 汪仕良 黎 鳌
单位:朱 云 于 晟 常 霖 钟晓玲 马丽梅 兰州军区兰州总医院(兰州市,730050);汪仕良 黎 鳌 第三军医大学烧伤研究所
关键词:烧伤;肠道营养;肝巨噬细胞;炎性介质
肠外与肠内营养990109 摘要 目的:以30%Ⅲ度烧伤大鼠胃肠喂养模型,分离、培养肝巨噬细胞(Kupffer cell,KC),以了解早期肠道营养(EF)对肝巨噬细胞的调理作用。 方法:105只大鼠随机分为早期喂养组、延迟喂养组及正常对照组。于伤前及伤后1、3、5天观察肝巨噬细胞分泌TNF、PGE2的变化及肝巨噬细胞吞噬胶体颗粒数量的变化。 结果:延迟喂养组较早期喂养组肝巨噬细胞分泌TNF、PGE2及吞噬胶体颗粒量均明显增加。 结论:早期肠道营养可下向调理肝巨噬细胞的过度激活,减少其释放活性介质,对严重烧伤后因炎症反应失控所致的多器官功能障碍综合征的防治可能有重要的理论及实践意义。
, 百拇医药
中图法分类号 R644
The modulation effects of early enteral feeding on Kupffer cell(KC)
activity in severe burn rats
Zhu Yun,Wang Shiliang,Yu Cheng,et al
Department of Burn and Plastic Surgery,Lanzhou General Hospital of PLA(Lanzhou,730050)
Abstract Objectives:To investigate whether there is the modulation effect of early enteral feeding on KC of burned rats. Methods:Rats sustained with 30% Ⅲ° flame burns of TBSA were divided randomly into early feeding(EF) group given gastroenteral feeding beginning from 2 hours postburn(n=45),and delayed feeding(DF) group given the same nutritional solutions but starting on PBD3(n=45).Another 15 rats were served as normal controls(NS) without burning. Results:The results showed that TNF and PGE2 released by KCs increased more markedly in the DF group than in the EF group.The counts and area of KCs phagocytizing colloidal carbon particles was obvious increase in DF group than that of the EF group. Conclusions:We consider that early enteral feeding can modulate the hyperactivity of KCs and reduce its excessive secretion of active mediators.
, 百拇医药
Key words Burns Early enteral feeding Kupffer cell Inflamatory mediators
早期肠道营养在保护肠道屏障功能,预防和减少肠道细菌、内毒素易位以及降低高代谢等方面已被许多实验所证实〔6,7〕。其中位于肝的巨噬细胞(Kupffer cell,KC)在严重烧伤后因肠道细菌、毒素易位的加剧,KC被激活而分泌大量活性介质是其中一个重要环节。因此,设想通过早期肠道营养,减少肠道细菌、毒素的入血量,从而可能减轻对KC的刺激,减少释放活性介质,调理其过度激活状态,但至今尚未见到这类报道。本研究以30%Ⅲ度烧伤大鼠早期肠道喂养模型,分离培养KC,观察早期喂养对KC的调理效应,为探讨其作用原理提供重要线索。
1 材料与方法
1.1 动物致伤与分组 选择健康10~12周龄Wistar大鼠105只,体重220±25 g,均为雌性。凝固汽油燃烧18 s造成背部30%Ⅲ度烧伤。随机将动物分为:①早期喂养组(EF组,n=45):伤后2 h灌喂肠道营养液(Ensure,美国)180 ml/(kg.d)(4.1840 kJ/ml),每6 h灌喂1次;②延迟喂养组(DF组,n=45):伤后第3天开始灌喂,方法同EF组;③非烧伤对照组(n=15):除不致伤外,其它处理同烧伤组,自由进食。
, 百拇医药
1.2 KC分离、纯化培养、鉴定及上清液收集 采用原位灌注胶原酶和链丝蛋白酶消化法〔1〕。先经门静脉插管灌注无Ca2+ Hank液洗净肝内血液,再经门静脉灌注0.05%胶原酶(Sigma公司,Ⅰ型200 U/mg)Hank液,维持37℃ 20 min。取下肝,分离和冲洗肝组织,用50目不锈钢滤网滤过后获全肝细胞悬液,经0.1%Pronase E(Merck公司)Hank液,其中含0.001%脱氧核糖核酸酶(DNase)(Sigma公司,Ⅰ型,60 U/mg),pH 7.4,37℃振荡水浴消化30 min。然后用含1%小牛血清RPMI 1640培养基清洗3次。沉淀细胞团用含10%小牛血清(56℃灭活30 min)和含抗生素的RPMI 1640培养基混悬,并调整细胞浓度为1×109/L,接种于塑料培养瓶,置37℃ 5%CO2培养箱内孵育2 h。培养基清洗细胞层,除去未附壁细胞。附壁细胞经非特异性酯酶(NSE)染色,可见90%以上为KC。最后加入胰蛋白酶——EDTA液,37℃ 5 min,轻轻吹打振荡,使附壁细胞从培养瓶壁游离。经清洗、计数、台盼蓝排除实验测成活率>95%。纯化后的细胞用含10%小牛血清RPMI 1640培养基,调整浓度为1×109/L,接种于24孔培养板,每孔1 ml,37℃ 5%CO2培养箱孵育过夜。更换新鲜培养基,用10 mg/L内毒素(LPS,O111∶B4,Sigma公司)刺激KC。培养12 h后无菌吸取上清,500 g离心10 min,过滤后-20℃保存。用作PGE2测定的样品,经重蒸乙酸乙酯抽取后保存。
, 百拇医药
1.3 观察指标及方法 ①KC培养上清中TNF、PGE2含量测定:用TNF试剂盒,采用酶联免疫吸附双抗体夹心法检测TNF含量;用前列腺素放免试剂盒检测上清PGE2含量。②KC计数及吞噬功能:伤后1、3、5天及正常组动物活杀前,由尾静脉注入印度墨汁(以1%明胶稀释14倍),1 ml/100 g体重。12 h后股动脉放血活杀,留取肝右叶,10%福马林固定。常规石蜡包埋切片,HE染色,Olympus显微镜下观察、照像。在LIKAMD-20型图像分析仪上进行肝切片图像分析,以KC吞噬墨汁颗粒的面积和细胞数为参数。
全部数据以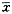 ±s表示,采用医用数理统计程序进行单因素方差分析。
±s表示,采用医用数理统计程序进行单因素方差分析。
2 结果
2.1 KC培养上清TNF及PGE2含量 KC培养上清TNF含量,延迟喂养组各时相点较早期喂养组及正常对照组均显著增加(P<0.05~0.01)。KC培养上清中PGE2含量DF组各时相点较EF组及正常对照组均有非常显著升高(P<0.01)(表1)。
, 百拇医药
表1 KC培养上清中TNF(pg/×106cells)及PGE2(ng/×106cells)含量
Tab. 1 The content of TNF(pg/×106 cells) and PGE2(ng/×106 cells)
in cultured KC supernatants
组 别
伤 前
PBD(伤后天数)
1
3
, 百拇医药
5
TNF
EF组
4.5±0.93
5.56±1.21*##
28.78±3.31**##
14.24±3.74**##
DF组
14.03±4.91**
40.69±5.30**
23.10±3.40**
, 百拇医药
PGE2
EF组
0.261±0.021
0.415±0.036**##
0.670±0.041**##
0.391±0.029**##
DF组
0.590±0.115**
0.861±0.111**
0.531±0.097**
, http://www.100md.com
与伤前比*P<0.05,**P<0.01;与DF组比##P<0.01
2.2 肝病理切片图像分析 伤后两组各时相点,KC较伤前均呈显著增加(P<0.05),而DF组较EF组KC数目增加更明显,两组各时相点也存在显著差异(P<0.05,表2)。KC吞噬墨汁颗粒面积,伤后两组各时相点均明显增加,较伤前差异非常显著(P<0.01),DF组较EF组吞噬量增加更明显,两组之间差异亦非常显著(P<0.01,表3)。
表2 吞噬墨汁颗粒的KC计数(个/100倍视野)
Tab. 2 The counts of KC phagocytizing ink particles
(number/one hundredfold visual field) 组 别
伤 前
, 百拇医药
PBD
1
3
5
EF组
64.80±8.87
102.00±18.85*##
132.40±20.89**##
121.20±16.15**##
DF组
153.20±42.75**
, http://www.100md.com
200.00±62.96**
175.60±54.42**
与伤前比*P<0.05,**P<0.01;与DF组比#P<0.05、##P<0.01
表3 KC吞噬墨汁颗粒面积(μm2/100倍视野)
Tab. 3 The area of KC phagocytizing ink particles
(μm2/one hundredfold visual field) 组 别
伤 前
PBD(伤后天数)
, 百拇医药
1
3
5
EF组
0.852±0.291
1.866±0.242**##
3.402±1.277**##
3.150±0.589**##
DF组
5.276±0.791**
6.832±1.193**
, http://www.100md.com
5.412±0.572**
与伤前比**P<0.01;与DF组比##P<0.01
3 讨论
严重创(烧)伤后,巨噬细胞包括肝巨噬细胞吞噬、分泌功能亢进,这已为大多数学者所共识〔2,3,9〕。表现为早期释放大量的细胞因子及炎性介质,可造成广泛的组织、器官损伤,如果这种过度激活状态不被控制,必将引起炎症反应失控,其结果是KC因过度活化而退变,不能合成适量的免疫物质,以致机体防御功能减弱,导致多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)〔5〕。早期肠道营养为下向调控严重烧伤后KC的过度活化状态,提供了一个实用有效的方法,但其对KC的调理效果如何,目前尚无这类研究报道。我们以往大量的实验研究证实了EF对严重烧伤后肠道屏障功能确能起到保护作用,减轻了肠源性内毒素血症,降低血浆中某些细胞因子及炎性介质的水平,降低高代谢。而这些实验结果的内在联系,其最终焦点是在肝KC等单核吞噬细胞系统。本实验结果表明,烧伤后KC数目明显增加,且DF组较EF组显著增多。KC吞噬胶体墨汁颗粒的量,烧伤后也明显增加,同时EF组与DF组之间存在显著差别。这说明严重烧伤后KC功能处于极度亢进状态,而EF却能调理KC的过度活化,这对预防炎症介质失控、器官功能失调以及脓毒症的发生是有一定作用的。
, 百拇医药
已知肝细胞、内皮细胞和巨噬细胞均可合成和分泌TNF、PGE2〔3〕。采用免疫组化方法发现肝细胞、内皮细胞中的标记物无明显增减,标记物含量的变化主要表现在KC〔4〕。提示KC可能是影响血浆中TNF、PGE2变化的主要因素。我们的实验结果显示,烧伤后大鼠KC培养上清中TNF、PGE2含量均显著增加,伤后第3天达最高值,第5天开始下降。EF组较DF组各时相点均显著降低,所以EF可以下向调控KC过度激活状态,其可能的机制是大鼠严重烧伤后早期,因肠道受损而肠源性内毒素入血量增多,KC接受较正常更多的肠道毒素刺激,使KC功能过度活跃,TNF、PGE2合成增多,并在细胞内积聚,分离培养中,再次受内毒素(LPS)刺激后立即释放出来。
总之,EF通过保护肠道屏障功能,减轻肠源性内毒素血症,使KC吞噬分泌功能亢进较DF组有所下调,从而起到调理KC的过度激活。我们认为,伤后KC活化可能对机体有利,是防御机制的一部分,但过度亢进对机体是有害的。所以,EF对严重烧伤后因炎性介质失控所致MODS的防治可能具有积极的理论与实践意义。
, 百拇医药
参考文献
1 Seglen PO.Preparation of isolated rat liver cells.Meth Cell Biol,1976,13:29
2 Dong YL,Ko F,Yan T,et al.Evidence for Kupffer cells activation by burn injury and pseudomonas exotoxin A.Burns,1993,19(1):12
3 Ogle CK,Mao JX,Wu JZ,et al.The production of tumor necrosis factor,interleukin-1,interleukin-6,and prostaglandin E2 by isolated enterocytes and gut macrophage.J Burn Care Rehabil,1994,15(6):470
, 百拇医药
4 陆江阳,梁延杰,李 玲等.多器官衰竭大鼠枯否细胞中纤维结合蛋白的免疫电镜研究.中华整形烧伤外科杂志,1994;10:444
5 邱海波,杜 斌,刘大为等.全身炎症反应综合征与多器官功能障碍综合征的临床研究.中华外科杂志,1997;35:402
6 Wood RH,Caldweel FT,Wallace BH.Effect of early feeding on the postburn hypermetabolic responses on rats.J Trauma,1990,30(supple):24
7 Gianotti L,Nelson JL,Alexander JW,et al.Post injury hypermetabolic responses and magnitude of translocation:prevention by early enteral nutrition.Nutrition,1994,10:225
8 Alexander JW,Gottschlich MM.Nutrition immunomodulation in burn patients.Crit Care Med,1990,18:149
9 O'Riordain MG,Collins KH,Pilz M,et al.Modulation of macrophage hyperactivity improves survival in a burn sepsis model.Arch Surg,1992,127:152
(1998-09-02收稿), 百拇医药
单位:朱 云 于 晟 常 霖 钟晓玲 马丽梅 兰州军区兰州总医院(兰州市,730050);汪仕良 黎 鳌 第三军医大学烧伤研究所
关键词:烧伤;肠道营养;肝巨噬细胞;炎性介质
肠外与肠内营养990109 摘要 目的:以30%Ⅲ度烧伤大鼠胃肠喂养模型,分离、培养肝巨噬细胞(Kupffer cell,KC),以了解早期肠道营养(EF)对肝巨噬细胞的调理作用。 方法:105只大鼠随机分为早期喂养组、延迟喂养组及正常对照组。于伤前及伤后1、3、5天观察肝巨噬细胞分泌TNF、PGE2的变化及肝巨噬细胞吞噬胶体颗粒数量的变化。 结果:延迟喂养组较早期喂养组肝巨噬细胞分泌TNF、PGE2及吞噬胶体颗粒量均明显增加。 结论:早期肠道营养可下向调理肝巨噬细胞的过度激活,减少其释放活性介质,对严重烧伤后因炎症反应失控所致的多器官功能障碍综合征的防治可能有重要的理论及实践意义。
, 百拇医药
中图法分类号 R644
The modulation effects of early enteral feeding on Kupffer cell(KC)
activity in severe burn rats
Zhu Yun,Wang Shiliang,Yu Cheng,et al
Department of Burn and Plastic Surgery,Lanzhou General Hospital of PLA(Lanzhou,730050)
Abstract Objectives:To investigate whether there is the modulation effect of early enteral feeding on KC of burned rats. Methods:Rats sustained with 30% Ⅲ° flame burns of TBSA were divided randomly into early feeding(EF) group given gastroenteral feeding beginning from 2 hours postburn(n=45),and delayed feeding(DF) group given the same nutritional solutions but starting on PBD3(n=45).Another 15 rats were served as normal controls(NS) without burning. Results:The results showed that TNF and PGE2 released by KCs increased more markedly in the DF group than in the EF group.The counts and area of KCs phagocytizing colloidal carbon particles was obvious increase in DF group than that of the EF group. Conclusions:We consider that early enteral feeding can modulate the hyperactivity of KCs and reduce its excessive secretion of active mediators.
, 百拇医药
Key words Burns Early enteral feeding Kupffer cell Inflamatory mediators
早期肠道营养在保护肠道屏障功能,预防和减少肠道细菌、内毒素易位以及降低高代谢等方面已被许多实验所证实〔6,7〕。其中位于肝的巨噬细胞(Kupffer cell,KC)在严重烧伤后因肠道细菌、毒素易位的加剧,KC被激活而分泌大量活性介质是其中一个重要环节。因此,设想通过早期肠道营养,减少肠道细菌、毒素的入血量,从而可能减轻对KC的刺激,减少释放活性介质,调理其过度激活状态,但至今尚未见到这类报道。本研究以30%Ⅲ度烧伤大鼠早期肠道喂养模型,分离培养KC,观察早期喂养对KC的调理效应,为探讨其作用原理提供重要线索。
1 材料与方法
1.1 动物致伤与分组 选择健康10~12周龄Wistar大鼠105只,体重220±25 g,均为雌性。凝固汽油燃烧18 s造成背部30%Ⅲ度烧伤。随机将动物分为:①早期喂养组(EF组,n=45):伤后2 h灌喂肠道营养液(Ensure,美国)180 ml/(kg.d)(4.1840 kJ/ml),每6 h灌喂1次;②延迟喂养组(DF组,n=45):伤后第3天开始灌喂,方法同EF组;③非烧伤对照组(n=15):除不致伤外,其它处理同烧伤组,自由进食。
, 百拇医药
1.2 KC分离、纯化培养、鉴定及上清液收集 采用原位灌注胶原酶和链丝蛋白酶消化法〔1〕。先经门静脉插管灌注无Ca2+ Hank液洗净肝内血液,再经门静脉灌注0.05%胶原酶(Sigma公司,Ⅰ型200 U/mg)Hank液,维持37℃ 20 min。取下肝,分离和冲洗肝组织,用50目不锈钢滤网滤过后获全肝细胞悬液,经0.1%Pronase E(Merck公司)Hank液,其中含0.001%脱氧核糖核酸酶(DNase)(Sigma公司,Ⅰ型,60 U/mg),pH 7.4,37℃振荡水浴消化30 min。然后用含1%小牛血清RPMI 1640培养基清洗3次。沉淀细胞团用含10%小牛血清(56℃灭活30 min)和含抗生素的RPMI 1640培养基混悬,并调整细胞浓度为1×109/L,接种于塑料培养瓶,置37℃ 5%CO2培养箱内孵育2 h。培养基清洗细胞层,除去未附壁细胞。附壁细胞经非特异性酯酶(NSE)染色,可见90%以上为KC。最后加入胰蛋白酶——EDTA液,37℃ 5 min,轻轻吹打振荡,使附壁细胞从培养瓶壁游离。经清洗、计数、台盼蓝排除实验测成活率>95%。纯化后的细胞用含10%小牛血清RPMI 1640培养基,调整浓度为1×109/L,接种于24孔培养板,每孔1 ml,37℃ 5%CO2培养箱孵育过夜。更换新鲜培养基,用10 mg/L内毒素(LPS,O111∶B4,Sigma公司)刺激KC。培养12 h后无菌吸取上清,500 g离心10 min,过滤后-20℃保存。用作PGE2测定的样品,经重蒸乙酸乙酯抽取后保存。
, 百拇医药
1.3 观察指标及方法 ①KC培养上清中TNF、PGE2含量测定:用TNF试剂盒,采用酶联免疫吸附双抗体夹心法检测TNF含量;用前列腺素放免试剂盒检测上清PGE2含量。②KC计数及吞噬功能:伤后1、3、5天及正常组动物活杀前,由尾静脉注入印度墨汁(以1%明胶稀释14倍),1 ml/100 g体重。12 h后股动脉放血活杀,留取肝右叶,10%福马林固定。常规石蜡包埋切片,HE染色,Olympus显微镜下观察、照像。在LIKAMD-20型图像分析仪上进行肝切片图像分析,以KC吞噬墨汁颗粒的面积和细胞数为参数。
全部数据以
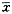 ±s表示,采用医用数理统计程序进行单因素方差分析。
±s表示,采用医用数理统计程序进行单因素方差分析。2 结果
2.1 KC培养上清TNF及PGE2含量 KC培养上清TNF含量,延迟喂养组各时相点较早期喂养组及正常对照组均显著增加(P<0.05~0.01)。KC培养上清中PGE2含量DF组各时相点较EF组及正常对照组均有非常显著升高(P<0.01)(表1)。
, 百拇医药
表1 KC培养上清中TNF(pg/×106cells)及PGE2(ng/×106cells)含量
Tab. 1 The content of TNF(pg/×106 cells) and PGE2(ng/×106 cells)
in cultured KC supernatants
组 别
伤 前
PBD(伤后天数)
1
3
, 百拇医药
5
TNF
EF组
4.5±0.93
5.56±1.21*##
28.78±3.31**##
14.24±3.74**##
DF组
14.03±4.91**
40.69±5.30**
23.10±3.40**
, 百拇医药
PGE2
EF组
0.261±0.021
0.415±0.036**##
0.670±0.041**##
0.391±0.029**##
DF组
0.590±0.115**
0.861±0.111**
0.531±0.097**
, http://www.100md.com
与伤前比*P<0.05,**P<0.01;与DF组比##P<0.01
2.2 肝病理切片图像分析 伤后两组各时相点,KC较伤前均呈显著增加(P<0.05),而DF组较EF组KC数目增加更明显,两组各时相点也存在显著差异(P<0.05,表2)。KC吞噬墨汁颗粒面积,伤后两组各时相点均明显增加,较伤前差异非常显著(P<0.01),DF组较EF组吞噬量增加更明显,两组之间差异亦非常显著(P<0.01,表3)。
表2 吞噬墨汁颗粒的KC计数(个/100倍视野)
Tab. 2 The counts of KC phagocytizing ink particles
(number/one hundredfold visual field) 组 别
伤 前
, 百拇医药
PBD
1
3
5
EF组
64.80±8.87
102.00±18.85*##
132.40±20.89**##
121.20±16.15**##
DF组
153.20±42.75**
, http://www.100md.com
200.00±62.96**
175.60±54.42**
与伤前比*P<0.05,**P<0.01;与DF组比#P<0.05、##P<0.01
表3 KC吞噬墨汁颗粒面积(μm2/100倍视野)
Tab. 3 The area of KC phagocytizing ink particles
(μm2/one hundredfold visual field) 组 别
伤 前
PBD(伤后天数)
, 百拇医药
1
3
5
EF组
0.852±0.291
1.866±0.242**##
3.402±1.277**##
3.150±0.589**##
DF组
5.276±0.791**
6.832±1.193**
, http://www.100md.com
5.412±0.572**
与伤前比**P<0.01;与DF组比##P<0.01
3 讨论
严重创(烧)伤后,巨噬细胞包括肝巨噬细胞吞噬、分泌功能亢进,这已为大多数学者所共识〔2,3,9〕。表现为早期释放大量的细胞因子及炎性介质,可造成广泛的组织、器官损伤,如果这种过度激活状态不被控制,必将引起炎症反应失控,其结果是KC因过度活化而退变,不能合成适量的免疫物质,以致机体防御功能减弱,导致多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)〔5〕。早期肠道营养为下向调控严重烧伤后KC的过度活化状态,提供了一个实用有效的方法,但其对KC的调理效果如何,目前尚无这类研究报道。我们以往大量的实验研究证实了EF对严重烧伤后肠道屏障功能确能起到保护作用,减轻了肠源性内毒素血症,降低血浆中某些细胞因子及炎性介质的水平,降低高代谢。而这些实验结果的内在联系,其最终焦点是在肝KC等单核吞噬细胞系统。本实验结果表明,烧伤后KC数目明显增加,且DF组较EF组显著增多。KC吞噬胶体墨汁颗粒的量,烧伤后也明显增加,同时EF组与DF组之间存在显著差别。这说明严重烧伤后KC功能处于极度亢进状态,而EF却能调理KC的过度活化,这对预防炎症介质失控、器官功能失调以及脓毒症的发生是有一定作用的。
, 百拇医药
已知肝细胞、内皮细胞和巨噬细胞均可合成和分泌TNF、PGE2〔3〕。采用免疫组化方法发现肝细胞、内皮细胞中的标记物无明显增减,标记物含量的变化主要表现在KC〔4〕。提示KC可能是影响血浆中TNF、PGE2变化的主要因素。我们的实验结果显示,烧伤后大鼠KC培养上清中TNF、PGE2含量均显著增加,伤后第3天达最高值,第5天开始下降。EF组较DF组各时相点均显著降低,所以EF可以下向调控KC过度激活状态,其可能的机制是大鼠严重烧伤后早期,因肠道受损而肠源性内毒素入血量增多,KC接受较正常更多的肠道毒素刺激,使KC功能过度活跃,TNF、PGE2合成增多,并在细胞内积聚,分离培养中,再次受内毒素(LPS)刺激后立即释放出来。
总之,EF通过保护肠道屏障功能,减轻肠源性内毒素血症,使KC吞噬分泌功能亢进较DF组有所下调,从而起到调理KC的过度激活。我们认为,伤后KC活化可能对机体有利,是防御机制的一部分,但过度亢进对机体是有害的。所以,EF对严重烧伤后因炎性介质失控所致MODS的防治可能具有积极的理论与实践意义。
, 百拇医药
参考文献
1 Seglen PO.Preparation of isolated rat liver cells.Meth Cell Biol,1976,13:29
2 Dong YL,Ko F,Yan T,et al.Evidence for Kupffer cells activation by burn injury and pseudomonas exotoxin A.Burns,1993,19(1):12
3 Ogle CK,Mao JX,Wu JZ,et al.The production of tumor necrosis factor,interleukin-1,interleukin-6,and prostaglandin E2 by isolated enterocytes and gut macrophage.J Burn Care Rehabil,1994,15(6):470
, 百拇医药
4 陆江阳,梁延杰,李 玲等.多器官衰竭大鼠枯否细胞中纤维结合蛋白的免疫电镜研究.中华整形烧伤外科杂志,1994;10:444
5 邱海波,杜 斌,刘大为等.全身炎症反应综合征与多器官功能障碍综合征的临床研究.中华外科杂志,1997;35:402
6 Wood RH,Caldweel FT,Wallace BH.Effect of early feeding on the postburn hypermetabolic responses on rats.J Trauma,1990,30(supple):24
7 Gianotti L,Nelson JL,Alexander JW,et al.Post injury hypermetabolic responses and magnitude of translocation:prevention by early enteral nutrition.Nutrition,1994,10:225
8 Alexander JW,Gottschlich MM.Nutrition immunomodulation in burn patients.Crit Care Med,1990,18:149
9 O'Riordain MG,Collins KH,Pilz M,et al.Modulation of macrophage hyperactivity improves survival in a burn sepsis model.Arch Surg,1992,127:152
(1998-09-02收稿), 百拇医药