三七总皂甙对颅脑损伤后Ca2+、CaM含量影响的实验研究
作者:韩金安 匡永勤 周虎田 孙增会 李开慧 胡威夷
单位:韩金安、孙增会 441003 湖北,襄樊解放军第四七七医院神经外科;匡永勤、周虎田、李开慧、胡威夷 成都军区总医院神经外科
关键词:三七;钙;钙调蛋白;脑损伤
中华创伤杂志990412 【摘要】 目的 探讨三七总皂甙(PNS)对颅脑损伤后脑组织中Ca2+、CaM含量的影响及其对颅脑损伤后的治疗效应。方法 干湿法测定脑组织含水量,放免法、原子吸收分光光度法测定血及脑组织中 Ca2+、CaM含量;分析PNS对上述指标的影响。 结果 PNS能显著降低颅脑损伤后血与脑组织中Ca2+、CaM含量,减少脑组织含水量及伊文思蓝染范围。结论 PNS 能阻滞脑损伤后神经细胞内钙超载,阻断Ca2+-CaM复合物形成,减轻脑水肿和血脑屏障通透性,对颅脑损伤具有一定的脑保护作用。
, http://www.100md.com
Effect of Panax Notoginseng Saponins on the Change of Ca2+, CaM Contents Following Brain Injury
HAN Jinan*, KUANG Yongqin, ZHOU Hutian, et al.
* Dept. of Neurosurgery, 477th Hospital of PLA, Xiangfan, 441003
【Abstract】 Objective To study the effects of the panax notoginseng saponins (PNS) on the changes of Ca2+, CaM content and the brain protective effects after brain injury. Methods A model of local cerebral injury on rabbits was set up by a drop of 100 g weight at 20 cm height hitting on the left epidura, then 100 mg/kg PNS was intravenously injected at 30 min and 12 h after brain injury. The contents of Ca2+, CaM in blood and brain tissue were measured by atonic absorption spectrometry and radioimmunoassay. Results PNS significant reduced Ca2+, CaM contents both in blood and cerebral tissue (P<0.01). Conclusions PNS can reduce Ca2+, CaM contents in brain tissue, block Ca2+ overload in neurons, consequently inhibit the production of Ca2+-CaM compound that causes neurons damage. PNS has a protective effect on brain injury.
, 百拇医药
【Key words】 Panax notoginseng saponins Calcium Calmodulin Brain injuries
颅脑损伤后神经元和(或)神经胶质细胞膜系统的钙通道开放、细胞内钙超载、钙调蛋白激活(CaM),是导致继发性脑损害、脑水肿发生的关键[1]。三七总皂甙(panax notoginseng saponins, PNS)可减少缺血后脑组织中钙含量达到脑保护作用,现已用于防治脑缺血性损害[2]。笔者旨在通过观察PNS对颅脑损伤后脑组织中Ca2+、CaM含量及脑含水量变化的影响,探明PNS对颅脑损伤后的脑保护作用及可能作用机制。
材料与方法
一、 实验动物及分组
选用体重(2.30±0.40)kg的健康成年日本大耳白兔54只(四川省医药实验动物管理中心提供),雌雄不限。伤前随机分为3组:致伤组、致伤治疗组和对照组各18只。其中,每组10只用于观察Ca2+、CaM含量变化,又分为4个时相即伤前、伤后1,8,24小时,另8只处死前2小时股静脉注射3%伊文思蓝(EB)溶液25 mg/kg,用于观察脑含水量和血脑屏障(BBB)通透性。
, http://www.100md.com
二、 模型制备
参照袁绍纪等[3]的方法,略做改良。动物麻醉后,固定头颅和躯干、切开左额顶头皮,制1 cm×1 cm大小颅骨窗,硬膜保持完整,将撞杆置于硬膜外,用电磁原理吸引与释放100 g重的砝码,下落20 cm撞击撞杆(长3 cm、直径0.8 cm)使之下移0.4 cm致左额顶部脑挫裂伤。受力面积0.64 cm2,致伤冲量以100 g×20 cm为参数,对照组仅作骨窗,不致伤。
三、 给药方法
PNS粉剂(昆明制药厂提供)用注射用水配成质量浓度5%的溶液。治疗组伤后30分钟及12小时分别给予PNS 100 mg/kg与质量浓度50 g/L葡萄糖液25 ml/kg,缓慢静脉滴注。致伤组和对照组以同样的方式给予质量浓度50 g/L葡萄糖液25 ml/kg静脉滴注,观察24小时。
, 百拇医药
四、 检测指标和方法
(1)Ca2+检测:分别于伤前、伤后各时相经股静脉取血2 ml,2000 r/min离心3分钟,取血清低温保存。动物伤后24小时处死,于伤灶边缘取脑(200±10)mg,烘烤(100℃)24小时至恒重,取10 mg烘干组织用3 ml浓硝酸消化48小时,重蒸水稀释10倍,保存待测。用WYX-402型原子吸收光谱仪,波长42.17nm,分别测定血清和脑组织中总Ca2+含量。(2)CaM检测:分别于伤前、伤后各时相取静脉血2 ml,抗凝,2 500 r/min离心3分钟,分离血浆,煮沸5分钟,迅速冷却,-35℃保存。伤后24小时处死,于伤灶边缘取脑200 mg,用Tris-HCI液冰溶下制匀浆,4 500 r/min离心50分钟,取上清液煮沸5分钟,以同样速度离心30分钟,取上清液保存待测。采用放免法,利用磷酸二酯酶(PDE)系统测定 CaM计数。药盒由中科院药理所提供,步骤参照文献[4]及药盒说明书进行。(3)脑组织含水量及EB蓝染范围的测定:伤后24小时部分动物断头取脑,弃去小脑、嗅脑及脑干,纵裂切开两大脑半球,滤纸吸去表面液体,分析天平称左、右半球湿重(室温15~20℃,湿度70%~90%)。伤侧半球显微镜下测量表面蓝染直径。将脑组织置于恒温烤箱中,用100℃、24小时烘干至恒重。按Elliot公式计算脑含水量。
, 百拇医药
五、 数据统计学处理
采用SPRM统计程序包,对数据进行单因素、双因素方差分析及相关系数的显著性检验,数据以 ±s表示。
±s表示。
结 果
一、 伤后不同时相血中Ca2+、CaM含量的变化
致伤组伤后血Ca2+、CaM含量持续性升高。治疗组各时相血CaM与对照组相差不显著,伤后24小时血Ca2+略有升高。见表1。
二、 伤后24小时脑组织Ca2+、CaM含量的变化
, http://www.100md.com
见表2。
三、 伤后24小时含水量与EB蓝染范围的变化
见表3。
表1 3组动物各时相血清 Ca2+、血浆CaM含量变化比较(mmol/L,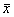 ±s) 组别
±s) 组别
兔数
Ca2+[伤后时间(h)]
CaM[伤后时间(h )]
0
, 百拇医药
1
8
24
0
1
8
24
致伤组
10
3.16±0.25
3.28±0.57
8.96±0.72*△
5.19±0.93(**△)/(△▲▲)
, http://www.100md.com
6.89±1.23
6.88±1.32
14.23±2.35(**△)/(△▲▲)
17.56±2.79(**△)/(△▲▲)
治疗组
10
3.12±0.30
3.23±0.48
3.38±0.51
3.47±0.49*△
7.55±1.57
, 百拇医药
7.67±1.45
8.16±1.76
9.20±1.92
对照组
10
3.12±0.20
3.14±0.60
3.17±0.43
3.06±0.26
6.48±1.10
7.31±1.28
7.49±1.25
, 百拇医药
7.54±1.3
与同组伤前比较:*P<0.05, ** P<0.01 与同时相对照组比较:△P<0.05, △△P<0.01 与同时相治疗组比较:▲▲P<0.01表2 3组动物伤后24小时脑组织CaM、Ca2+含量变化(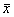 ±s) 组别
±s) 组别
兔数
CaM(μmol/kg湿脑)
Ca2+(mmol/kg干脑)
, 百拇医药
致伤组
10
18.56±2.66*△
22.49±5.34*△
治疗组
10
10.57±1.80
14.93±3.18
对照组
10
9.54±1.76
12.55±2.76
, http://www.100md.com
与对照组比较:*P<0.05 与治疗组比较:△P<0.05表3 3组动物伤后24小时脑含水量与伊文思蓝染变化(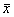 ±s) 组别
±s) 组别
兔数
脑含水量(%)
直径(mm)
左侧
右侧
致伤组
8
, 百拇医药
80.74±0.98(**△)/(△▲▲)
78.59±0.72
12.9±1.9△△
治疗组
8
78.97±0.91
78.24±1.34
9.8±1.8
对照组
8
78.35±0.89
, 百拇医药 78.80±0.64
-
与对照组比,**P<0.01; 与治疗组比, △△P<0.01; 与同组右半球比, ▲▲ P<0.01 四、伤后24小时血Ca2+、CaM与脑组织Ca2+、CaM
CaM含量的相关分析:结果显示,血Ca2+、CaM含量之间交互均呈显著的正相关(P<0.01),以血CaM和脑组织CaM含量相关系数最大,为0.759。
讨 论
颅脑损伤时出现神经细胞钙通道开放,胞浆内游离钙浓度异常增高,产生严重Ca2+超载,诱发一系列病理反应,促发和加重继发性脑损伤[5,6]。徐如祥等[7]采用细胞内Ca2+荧光探针Fura-2检测神经细胞突触体胞浆中游离Ca2+浓度,结果发现脑损伤后神经细胞Ca2+通道早期开放,胞浆中游离钙浓度处于较高水平状态,并存在超微结构损害,BBB通透性增加,认为Ca2+超载是导致继发性脑损害及脑水肿的关键因素。CaM是Ca2+的重要调节蛋白,CaM本身无活性,只有与Ca2+结合形成Ca2+-CaM复合物,方可启动靶酶,引起一系列生理或病理反应。研究表明,活性型CaM含量与细胞内游离钙浓度直接相关,当胞浆内Ca2+浓度过高,CaM活性则异常增高[8]。Ca2+-CaM复合物促使5-HT及NE释放增加,引起脑血管痉挛,加重脑缺血,并使蛋白激酶Ⅱ等活化,加速膜系统自身消化,血脑屏障破坏,脑水肿加重。易声禹等[9]研究表明,应用Ca2+通道阻滞剂,能有效地降低细胞内Ca2+浓度,降低CaM活性,减轻脑水肿,对颅脑损伤具有一定的治疗作用。
, 百拇医药
笔者采用原子吸收分光光度法、PDE法、干湿法分别测定血与脑组织中Ca2+、CaM含量及脑含水量,较全面地反映了脑损伤后Ca2+、CaM的动态变化。结果表明,致伤组伤后脑中Ca2+、CaM显著升高与对照组相差显著;脑含水量显著增多,脑水肿严重,EB蓝染明显增宽,血脑屏障破坏明显。笔者认为,颅脑损伤后Ca2+-CaM复合物大量形成,CaM活性增高可能是介导Ca2+毒性导致脑继发性损害加重而不易逆转的关键因素。相关分析发现,血中Ca2+、CaM与脑中Ca2+、CaM呈同步升高,血中CaM含量与脑组织中CaM含量呈显著正相关。说明血中CaM含量可间接反映脑中 Ca2+超载状态与CaM活性,为临床研究和评价药物治疗提供了特异、可行的客观指标。
PNS作为中药三七的有效成分,近年研究[10,11]表明,它对缺血、缺氧性脑损伤具有较好的脑保护作用,能明显减少脑组织中钙含量,减轻脑水肿,具有钙通道阻滞作用。笔者把PNS应用于颅脑损伤的治疗研究,结果表明,PNS能明显降低颅脑损伤早期血及脑组织中Ca2+、CaM含量,减轻脑水肿和BBB通透性,与损伤组比较相差显著,提示PNS能有效地阻滞神经细胞内钙超载,降低 CaM活性。PNS的Ca2+拮抗作用,在相关领域的研究[12]显示,它既有阻滞外Ca2+内流又有阻滞内Ca2+释放作用,从而降低胞浆游离Ca2+的浓度。对细胞内Ca2+超载导致进一步的损害环节,目前报道甚少。本研究显示,PNS降低血与脑组织中CaM活性又优于降低Ca2+浓度。伤后24小时治疗组血与脑中CaM均无明显升高,而血Ca2+仍略有升高。表明PNS对Ca2+毒性的后续环节有较好的抑制作用,对颅脑损伤继发性脑损害具有较好的脑保护作用,为临床进一步研究和应用提供了一定的理论基础。
, 百拇医药
参考文献
1 费舟,易声禹,章翔,等. 重型颅脑损伤后钙调素与自由基水平变化及尼莫地平和脑活素的作用. 中华创伤杂志,1994,10∶275-280.
2 韩金安,胡威夷. 三七总皂甙对缺血性脑损伤保护作用的研究进展. 中国中西医结合杂志,1996,16∶506-507.
3 袁绍纪, 朱诚, 陈伯林,等.大鼠急性脑水肿模型建立. 上海医学,1982,12∶276-278.
4 刘景生,刘桦,金荫昌. 钙调蛋白的制备和活性测定.中国医学科学院学报,1985,7∶454-457.
5 Degraba TJ, OsHow P, Hanson S, et al. Motor perform aence histologic damage and calcium influx in rats treatment with NBWX after focal ischemial. J Cerebro Blood Flow Metob, 1994,14∶262-268.
, 百拇医药
6 Okjyama K, Smith DH, Thomas MJ, et al. Evaluation of a novel calcium channel blocker, (s)-emopamil, on regional brain injury. J Neurosurg, 1992, 77∶607-611.
7 徐如祥,易声禹,陈长才,等.尼莫地平对脑损伤后神经细胞钙通道和超微结构的改变.中华创伤杂志,1994,8∶159-160.
8 费舟,易声禹.颅脑损伤与钙及钙调素.国外医学神经外科分册,1993,20∶2-4.
9 易声禹,费舟,徐如祥.尼莫地平救治重型颅脑损伤的理论基础与临床研究.中华神经外科杂志,1994,10∶28-30.
10 韩金安,胡威夷.三七总皂甙对缺血性中枢神经损伤氧自由基病理作用的影响.中国药理学通报,1996,12∶487-489.
, 百拇医药
11 Jiang KY, Qian ZN. Effects of panax notoginseng saponins on posthypoxic cell damage of neurons in vitro. Acta Pharmacologica Sinica, 1995, 16∶399-402.
12 Guan YY, Kwan GY, He H, et al. Effect of panax notoginseng saponins on receptor-operated Ca2+ channels in vascular smooth muscle. Acta Pharmocologic Sinica, 1991, 15∶392-398.
收稿日期:1998-04-01
修稿日期:1999-03-05, 百拇医药
单位:韩金安、孙增会 441003 湖北,襄樊解放军第四七七医院神经外科;匡永勤、周虎田、李开慧、胡威夷 成都军区总医院神经外科
关键词:三七;钙;钙调蛋白;脑损伤
中华创伤杂志990412 【摘要】 目的 探讨三七总皂甙(PNS)对颅脑损伤后脑组织中Ca2+、CaM含量的影响及其对颅脑损伤后的治疗效应。方法 干湿法测定脑组织含水量,放免法、原子吸收分光光度法测定血及脑组织中 Ca2+、CaM含量;分析PNS对上述指标的影响。 结果 PNS能显著降低颅脑损伤后血与脑组织中Ca2+、CaM含量,减少脑组织含水量及伊文思蓝染范围。结论 PNS 能阻滞脑损伤后神经细胞内钙超载,阻断Ca2+-CaM复合物形成,减轻脑水肿和血脑屏障通透性,对颅脑损伤具有一定的脑保护作用。
, http://www.100md.com
Effect of Panax Notoginseng Saponins on the Change of Ca2+, CaM Contents Following Brain Injury
HAN Jinan*, KUANG Yongqin, ZHOU Hutian, et al.
* Dept. of Neurosurgery, 477th Hospital of PLA, Xiangfan, 441003
【Abstract】 Objective To study the effects of the panax notoginseng saponins (PNS) on the changes of Ca2+, CaM content and the brain protective effects after brain injury. Methods A model of local cerebral injury on rabbits was set up by a drop of 100 g weight at 20 cm height hitting on the left epidura, then 100 mg/kg PNS was intravenously injected at 30 min and 12 h after brain injury. The contents of Ca2+, CaM in blood and brain tissue were measured by atonic absorption spectrometry and radioimmunoassay. Results PNS significant reduced Ca2+, CaM contents both in blood and cerebral tissue (P<0.01). Conclusions PNS can reduce Ca2+, CaM contents in brain tissue, block Ca2+ overload in neurons, consequently inhibit the production of Ca2+-CaM compound that causes neurons damage. PNS has a protective effect on brain injury.
, 百拇医药
【Key words】 Panax notoginseng saponins Calcium Calmodulin Brain injuries
颅脑损伤后神经元和(或)神经胶质细胞膜系统的钙通道开放、细胞内钙超载、钙调蛋白激活(CaM),是导致继发性脑损害、脑水肿发生的关键[1]。三七总皂甙(panax notoginseng saponins, PNS)可减少缺血后脑组织中钙含量达到脑保护作用,现已用于防治脑缺血性损害[2]。笔者旨在通过观察PNS对颅脑损伤后脑组织中Ca2+、CaM含量及脑含水量变化的影响,探明PNS对颅脑损伤后的脑保护作用及可能作用机制。
材料与方法
一、 实验动物及分组
选用体重(2.30±0.40)kg的健康成年日本大耳白兔54只(四川省医药实验动物管理中心提供),雌雄不限。伤前随机分为3组:致伤组、致伤治疗组和对照组各18只。其中,每组10只用于观察Ca2+、CaM含量变化,又分为4个时相即伤前、伤后1,8,24小时,另8只处死前2小时股静脉注射3%伊文思蓝(EB)溶液25 mg/kg,用于观察脑含水量和血脑屏障(BBB)通透性。
, http://www.100md.com
二、 模型制备
参照袁绍纪等[3]的方法,略做改良。动物麻醉后,固定头颅和躯干、切开左额顶头皮,制1 cm×1 cm大小颅骨窗,硬膜保持完整,将撞杆置于硬膜外,用电磁原理吸引与释放100 g重的砝码,下落20 cm撞击撞杆(长3 cm、直径0.8 cm)使之下移0.4 cm致左额顶部脑挫裂伤。受力面积0.64 cm2,致伤冲量以100 g×20 cm为参数,对照组仅作骨窗,不致伤。
三、 给药方法
PNS粉剂(昆明制药厂提供)用注射用水配成质量浓度5%的溶液。治疗组伤后30分钟及12小时分别给予PNS 100 mg/kg与质量浓度50 g/L葡萄糖液25 ml/kg,缓慢静脉滴注。致伤组和对照组以同样的方式给予质量浓度50 g/L葡萄糖液25 ml/kg静脉滴注,观察24小时。
, 百拇医药
四、 检测指标和方法
(1)Ca2+检测:分别于伤前、伤后各时相经股静脉取血2 ml,2000 r/min离心3分钟,取血清低温保存。动物伤后24小时处死,于伤灶边缘取脑(200±10)mg,烘烤(100℃)24小时至恒重,取10 mg烘干组织用3 ml浓硝酸消化48小时,重蒸水稀释10倍,保存待测。用WYX-402型原子吸收光谱仪,波长42.17nm,分别测定血清和脑组织中总Ca2+含量。(2)CaM检测:分别于伤前、伤后各时相取静脉血2 ml,抗凝,2 500 r/min离心3分钟,分离血浆,煮沸5分钟,迅速冷却,-35℃保存。伤后24小时处死,于伤灶边缘取脑200 mg,用Tris-HCI液冰溶下制匀浆,4 500 r/min离心50分钟,取上清液煮沸5分钟,以同样速度离心30分钟,取上清液保存待测。采用放免法,利用磷酸二酯酶(PDE)系统测定 CaM计数。药盒由中科院药理所提供,步骤参照文献[4]及药盒说明书进行。(3)脑组织含水量及EB蓝染范围的测定:伤后24小时部分动物断头取脑,弃去小脑、嗅脑及脑干,纵裂切开两大脑半球,滤纸吸去表面液体,分析天平称左、右半球湿重(室温15~20℃,湿度70%~90%)。伤侧半球显微镜下测量表面蓝染直径。将脑组织置于恒温烤箱中,用100℃、24小时烘干至恒重。按Elliot公式计算脑含水量。
, 百拇医药
五、 数据统计学处理
采用SPRM统计程序包,对数据进行单因素、双因素方差分析及相关系数的显著性检验,数据以
结 果
一、 伤后不同时相血中Ca2+、CaM含量的变化
致伤组伤后血Ca2+、CaM含量持续性升高。治疗组各时相血CaM与对照组相差不显著,伤后24小时血Ca2+略有升高。见表1。
二、 伤后24小时脑组织Ca2+、CaM含量的变化
, http://www.100md.com
见表2。
三、 伤后24小时含水量与EB蓝染范围的变化
见表3。
表1 3组动物各时相血清 Ca2+、血浆CaM含量变化比较(mmol/L,
兔数
Ca2+[伤后时间(h)]
CaM[伤后时间(h )]
0
, 百拇医药
1
8
24
0
1
8
24
致伤组
10
3.16±0.25
3.28±0.57
8.96±0.72*△
5.19±0.93(**△)/(△▲▲)
, http://www.100md.com
6.89±1.23
6.88±1.32
14.23±2.35(**△)/(△▲▲)
17.56±2.79(**△)/(△▲▲)
治疗组
10
3.12±0.30
3.23±0.48
3.38±0.51
3.47±0.49*△
7.55±1.57
, 百拇医药
7.67±1.45
8.16±1.76
9.20±1.92
对照组
10
3.12±0.20
3.14±0.60
3.17±0.43
3.06±0.26
6.48±1.10
7.31±1.28
7.49±1.25
, 百拇医药
7.54±1.3
与同组伤前比较:*P<0.05, ** P<0.01 与同时相对照组比较:△P<0.05, △△P<0.01 与同时相治疗组比较:▲▲P<0.01表2 3组动物伤后24小时脑组织CaM、Ca2+含量变化(
兔数
CaM(μmol/kg湿脑)
Ca2+(mmol/kg干脑)
, 百拇医药
致伤组
10
18.56±2.66*△
22.49±5.34*△
治疗组
10
10.57±1.80
14.93±3.18
对照组
10
9.54±1.76
12.55±2.76
, http://www.100md.com
与对照组比较:*P<0.05 与治疗组比较:△P<0.05表3 3组动物伤后24小时脑含水量与伊文思蓝染变化(
兔数
脑含水量(%)
直径(mm)
左侧
右侧
致伤组
8
, 百拇医药
80.74±0.98(**△)/(△▲▲)
78.59±0.72
12.9±1.9△△
治疗组
8
78.97±0.91
78.24±1.34
9.8±1.8
对照组
8
78.35±0.89
, 百拇医药 78.80±0.64
-
与对照组比,**P<0.01; 与治疗组比, △△P<0.01; 与同组右半球比, ▲▲ P<0.01 四、伤后24小时血Ca2+、CaM与脑组织Ca2+、CaM
CaM含量的相关分析:结果显示,血Ca2+、CaM含量之间交互均呈显著的正相关(P<0.01),以血CaM和脑组织CaM含量相关系数最大,为0.759。
讨 论
颅脑损伤时出现神经细胞钙通道开放,胞浆内游离钙浓度异常增高,产生严重Ca2+超载,诱发一系列病理反应,促发和加重继发性脑损伤[5,6]。徐如祥等[7]采用细胞内Ca2+荧光探针Fura-2检测神经细胞突触体胞浆中游离Ca2+浓度,结果发现脑损伤后神经细胞Ca2+通道早期开放,胞浆中游离钙浓度处于较高水平状态,并存在超微结构损害,BBB通透性增加,认为Ca2+超载是导致继发性脑损害及脑水肿的关键因素。CaM是Ca2+的重要调节蛋白,CaM本身无活性,只有与Ca2+结合形成Ca2+-CaM复合物,方可启动靶酶,引起一系列生理或病理反应。研究表明,活性型CaM含量与细胞内游离钙浓度直接相关,当胞浆内Ca2+浓度过高,CaM活性则异常增高[8]。Ca2+-CaM复合物促使5-HT及NE释放增加,引起脑血管痉挛,加重脑缺血,并使蛋白激酶Ⅱ等活化,加速膜系统自身消化,血脑屏障破坏,脑水肿加重。易声禹等[9]研究表明,应用Ca2+通道阻滞剂,能有效地降低细胞内Ca2+浓度,降低CaM活性,减轻脑水肿,对颅脑损伤具有一定的治疗作用。
, 百拇医药
笔者采用原子吸收分光光度法、PDE法、干湿法分别测定血与脑组织中Ca2+、CaM含量及脑含水量,较全面地反映了脑损伤后Ca2+、CaM的动态变化。结果表明,致伤组伤后脑中Ca2+、CaM显著升高与对照组相差显著;脑含水量显著增多,脑水肿严重,EB蓝染明显增宽,血脑屏障破坏明显。笔者认为,颅脑损伤后Ca2+-CaM复合物大量形成,CaM活性增高可能是介导Ca2+毒性导致脑继发性损害加重而不易逆转的关键因素。相关分析发现,血中Ca2+、CaM与脑中Ca2+、CaM呈同步升高,血中CaM含量与脑组织中CaM含量呈显著正相关。说明血中CaM含量可间接反映脑中 Ca2+超载状态与CaM活性,为临床研究和评价药物治疗提供了特异、可行的客观指标。
PNS作为中药三七的有效成分,近年研究[10,11]表明,它对缺血、缺氧性脑损伤具有较好的脑保护作用,能明显减少脑组织中钙含量,减轻脑水肿,具有钙通道阻滞作用。笔者把PNS应用于颅脑损伤的治疗研究,结果表明,PNS能明显降低颅脑损伤早期血及脑组织中Ca2+、CaM含量,减轻脑水肿和BBB通透性,与损伤组比较相差显著,提示PNS能有效地阻滞神经细胞内钙超载,降低 CaM活性。PNS的Ca2+拮抗作用,在相关领域的研究[12]显示,它既有阻滞外Ca2+内流又有阻滞内Ca2+释放作用,从而降低胞浆游离Ca2+的浓度。对细胞内Ca2+超载导致进一步的损害环节,目前报道甚少。本研究显示,PNS降低血与脑组织中CaM活性又优于降低Ca2+浓度。伤后24小时治疗组血与脑中CaM均无明显升高,而血Ca2+仍略有升高。表明PNS对Ca2+毒性的后续环节有较好的抑制作用,对颅脑损伤继发性脑损害具有较好的脑保护作用,为临床进一步研究和应用提供了一定的理论基础。
, 百拇医药
参考文献
1 费舟,易声禹,章翔,等. 重型颅脑损伤后钙调素与自由基水平变化及尼莫地平和脑活素的作用. 中华创伤杂志,1994,10∶275-280.
2 韩金安,胡威夷. 三七总皂甙对缺血性脑损伤保护作用的研究进展. 中国中西医结合杂志,1996,16∶506-507.
3 袁绍纪, 朱诚, 陈伯林,等.大鼠急性脑水肿模型建立. 上海医学,1982,12∶276-278.
4 刘景生,刘桦,金荫昌. 钙调蛋白的制备和活性测定.中国医学科学院学报,1985,7∶454-457.
5 Degraba TJ, OsHow P, Hanson S, et al. Motor perform aence histologic damage and calcium influx in rats treatment with NBWX after focal ischemial. J Cerebro Blood Flow Metob, 1994,14∶262-268.
, 百拇医药
6 Okjyama K, Smith DH, Thomas MJ, et al. Evaluation of a novel calcium channel blocker, (s)-emopamil, on regional brain injury. J Neurosurg, 1992, 77∶607-611.
7 徐如祥,易声禹,陈长才,等.尼莫地平对脑损伤后神经细胞钙通道和超微结构的改变.中华创伤杂志,1994,8∶159-160.
8 费舟,易声禹.颅脑损伤与钙及钙调素.国外医学神经外科分册,1993,20∶2-4.
9 易声禹,费舟,徐如祥.尼莫地平救治重型颅脑损伤的理论基础与临床研究.中华神经外科杂志,1994,10∶28-30.
10 韩金安,胡威夷.三七总皂甙对缺血性中枢神经损伤氧自由基病理作用的影响.中国药理学通报,1996,12∶487-489.
, 百拇医药
11 Jiang KY, Qian ZN. Effects of panax notoginseng saponins on posthypoxic cell damage of neurons in vitro. Acta Pharmacologica Sinica, 1995, 16∶399-402.
12 Guan YY, Kwan GY, He H, et al. Effect of panax notoginseng saponins on receptor-operated Ca2+ channels in vascular smooth muscle. Acta Pharmocologic Sinica, 1991, 15∶392-398.
收稿日期:1998-04-01
修稿日期:1999-03-05, 百拇医药