砷对小鼠骨髓细胞DNA的损伤作用
作者:段志刚 李学明
单位:中国预防医学科学院环境卫生与卫生工程研究所,北京 100050
关键词:砷;DNA损伤;单细胞凝胶电泳;DNA-蛋白质交联
卫生毒理学杂志000110 摘要 【目的】 了解砷对体内细胞DNA的损伤作用及其机制。【方法】 在小鼠饮水中加入As2O3,喂养6个月,采用单细胞凝胶电泳技术对骨髓细胞DNA断裂进行了分析。【结果】 高剂量组(12.5 mg/L)小鼠骨髓细胞DNA的迁移度和迁移率显著高于阴性对照组,P<0.05;中、低剂量组(2.5、0.5 mg/L)小鼠骨髓细胞DNA的迁移度和迁移率与阴性对照组无显著差异。各剂量组另选6只小鼠,以不引起明显DNA断裂剂量(20 mg/kg)的环磷酰胺进行腹腔注射,骨髓细胞DNA的迁移度和迁移率显著高于接受20 mg/kg环磷酰胺或As3O3单独作用的小鼠(P<0.05)。用蛋白酶K处理裂解后的细胞高剂量组的迁移度与迁移率显著高于未处理的细胞(P<0.05)。【结论】 高剂量的砷在小鼠体内对骨髓细胞DNA有损伤作用,并可诱发DNA-蛋白质交联,而低剂量的砷可能影响DNA对其他诱变剂的敏感性。
, http://www.100md.com
DNA damage in mice bone marrow cells Induced by arsenic
DUAN Zhi-Gang,LI Xue-Ming.
(Institute of Environmental Health & Engineering,Chinese Academy of Preventive Medicine, Beijing 100050,China)
Abstract:【Objective】 To study the damage effect and its mechanism of Arsenic on DNA of cells in vivo.【Methods】 The DNA break in bone marrow cells from the mice which have drunk the water containing As2O3 for 6 months were analyzed with Single cell gel electrophoresis.【Results】 The length of DNA migration and the rate of DNA migration of the bone marrow cells increased remarkably at high dose(12.5 mg/L)group(P<0.05) and there were no significant difference between medium,low dos(2.5,0.5 mg/L) group and control group.Cyclophosphamide 20 mg/kg which do not induce DNA break was intraperitoneally injected to 6 mice each group,the length of DNA migration and the rate of DNA migration of the bone marrow cells were significantly higher than those of both control group which were injected cyclophosphamide only and same As2O3 dose group which were not injected cyclophosphamide.The lysed cells were also treated with proteinase K, the values were higher than those which were not treated with proteinase K(P<0.05).【Conclusion】 High dose arsenic has damage effects on marrow cell's DNA of mice in vivo and induce DNA-protein crosslink at same time.Lower dose arsenic can affect the sensitivity of DNA to other carcinogen.
, 百拇医药
Key words:Arsenic; DNA damage; Single cell gelelectrophoresis; DNA-protein crosslink
砷是确认的人类致癌物,但目前对砷的致癌机制还了解甚少。Brown等[1]报道砷的致癌作用可能与癌基因的扩增有关。有研究发现砷抑制了免疫系统抗肿瘤的能力[2]。近几年,砷对遗传物质的损伤效应引起许多学者的注意,Gurr等[3]用亚砷酸钠处理G2期中国仓鼠卵巢细胞,引起染色体的凝集和断裂,细胞进入间期后又出现微核。流行病学研究也发现砷在体内可对染色体DNA造成损伤[4]。这为探索砷的致癌机制提供了线索,已成为国内外研究的热点。本实验室参考国内外文献建立了单细胞凝胶电泳(SCGE)方法[5~7],用其检测砷在整体动物体内对骨髓细胞DNA的损伤效应,以期对其机制进行探讨。
1 材料与方法
, 百拇医药
1.1 动物染毒 昆明种小鼠80只,雌雄各半,由医科院实验动物中心提供(合格证号:医动字 01-3001),分为4组,每组20只,在饮水中加入As2O3,浓度分别为0(阴性对照)、0.5、2.5和12.5 mg/L,连续喂养6个月。
为研究砷对其他诱变剂作用的影响,另选未处理过的小鼠24只,平均分为4组,分别腹腔注射剂量为10、20、40和80 mg/kg(阳性对照)的环磷酰胺,注射后18 h处死动物,分离骨髓细胞进行SCGE分析,以确定环磷酰胺不明显引起DNA断裂的最小剂量(阈剂量)。在确定阈剂量后,在饮用含砷水的各组中每组随机选6只小鼠,以此阈剂量腹腔注射环磷酰胺,18 h后处死动物,进行SCGE分析。同时处死各组中剩余的小鼠,进行SCGE分析。
1.2 骨髓细胞的分离与制备 动物处死后,分离股骨,用生理盐水冲洗骨髓腔,收集骨髓细胞,用Hank's液洗两次后,悬浮于PBS液(pH 7.4),制成细胞悬液,调整细胞浓度大约为1×106个/ml。
, 百拇医药
1.3 SCGE电泳 取0.6ml质量分数为5%的普通熔点琼脂糖(CMA)平铺于磨砂载玻片上,盖上盖玻片,4 ℃冷凝10 min后揭去盖玻片。在37 ℃下将细胞悬液与质量分数为0.5%低熔点琼脂点(LMA)1∶9混匀,取80 μl混合液铺于头层胶上,盖上盖玻片,4 ℃冷凝10 min后揭去盖玻片,再在上面覆盖一层质量分数为0.5%LMA,4℃冷凝10 min,完成制片。每只小鼠骨髓细胞制成4张平行胶板。
胶板制好后将其浸没于细胞裂解液(2 mol/L Nacl,100 mmol/L EDTA-Na2,1%十二脘基肌氨酸钠,10 mmol/L Tris pH10.0,用前加入1%Triton X-100),4 ℃裂解1 h。为了解细胞中的DNA-蛋白质交联的情况,裂解后每个样品取2张胶板,浸没于含1 mg/ml蛋白酶K的细胞裂解液(不加1%Triton X-100)中,37 ℃静置2 h。胶板在装有电泳缓冲液(300 mmol/L NaOH,1 mmol/L EDTA-Na2,pH 13.0)的水平电泳槽中,4 ℃静置20 min,电泳(25 V,300 mA)20 min。电泳后将胶板浸没于Tris液(0.4 mol/L,pH 7.4),中和15 min后用20 μg/mlEB染色。
, http://www.100md.com
以上步骤均在暗室中完成,以避免额外的DNA损伤。
1.4 结果观察与测定 在荧光显微镜下观察细胞图像,绿光激发,吸收滤片590 nm,目镜10×,物镜20×,用富士黑白胶卷(ASA200)拍摄相片。以此底片测定试验结果。每张胶板随机观察30个细胞,观察指标为迁移率和迁移度:
迁移率(The rate of DNA migration)=(拖尾细胞数/测定细胞数)×100%;
迁移度(Length of DNA migration)=(∑每个细胞直径/测定细胞数)±s
1.5 统计学分析 实验结果用SPSS统计学软件进行分析,两组间迁移度的比较用t检验,两组迁移率的比较用卡方检验。
2 结果
, http://www.100md.com
2.1 Comet图像 在荧光显微镜下,DNA呈亮橘红色。在阳性对照(环磷酰胺80 mg/kg)样品中,细胞DNA链产生断裂,既而引起高级结构松散,在电场作用下,断裂的DNA片段会离开细胞核向正极泳动,形成拖尾现象,且迁移长度与DNA损伤的程度有关。而未发生DNA断裂的细胞只有一个完整的头部。(见图1)
2.2 砷对DNA的损伤效应 饮用含砷饮水的各组小鼠骨髓细胞的SCGE结果见表1。高剂量组(12.5 mg/L)小鼠骨髓细胞DNA迁移率及迁移度都高于阴性对照组,经卡方检验和t检验,差异有显著性(P<0.05)。
表1 饮用含砷水的各组小鼠骨髓细胞SCGE结果 As2O3浓度
(mg/L)
动物数
, 百拇医药 测定
细胞数
拖尾
细胞数
迁移数
(%)
迁移度(mm)
(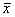 ±s)
±s)
0(阴性对照)
8
480
6
, http://www.100md.com
1.25
3.3±0.7
0.5
6
360
4
1.11
3.7±0.8
2.5
8
480
41
8.54**
, 百拇医药
3.5±0.5
12.5
10
600
141
23.50**
3.5±0.5
阳性对照
8
480
480
100.00**
, http://www.100md.com
13.4±4.9**
与阴性对照组比较,**P<0.05
图1 小鼠骨髓细胞SCGE图像
2.3 砷对环磷酰胺作用的影响 注射不同剂量环磷酰胺的未处理小鼠骨髓细胞SCGE结果见表2。注射40、80 mg/kg环磷酰胺的小鼠骨髓细胞DNA迁移率与迁移度均显著高于阴性对照(P<0.05),而注射20 mg/kg环磷酰胺的小鼠骨髓细胞DNA迁移率、迁移度与阴性对照组差异无显著性(P<0.05),因此20 mg/kg 被认为是不明显引起DNA断裂阈剂量的水平。
表2 注射环磷酰胺的未处理小鼠骨髓细胞SCGE结果 环磷酰胺剂量
, 百拇医药
(mg/kg)
动物数
测定
细胞数
拖尾
细胞数
迁移率
(%)
迁移度(mm)
(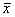 ±s)
±s)
0
8
, 百拇医药
480
6
1.25
3.3±0.7
10
6
360
7
1.94
3.6±0.8
20
6
360
, 百拇医药
14
3.86
4.1±1.0
40
6
360
238
66.11**
7.3±2.5*
80
8
480
480
, 百拇医药
100.00**
13.4±4.9*
与阴性对照相比,**P<0.05 饮用含砷水的各组小鼠在注射20 mg/kg环磷酰胺后骨髓细胞SCGE结果见表3。20 mg/kg环磷酰胺不会引起未处理小鼠细胞的DNA发生损伤,但饮用含砷水的各组小鼠在注射20mg/kg环磷酰胺后,其骨髓细胞DNA的迁移率及迁移度各有不同程度的上升。
表3 注射环磷酰胺的染砷组小鼠骨髓细胞SCGE结果 As2O3
浓度
(mg/L)
环磷酰胺
, 百拇医药
剂量
(mg/kg)
动物
数
测定
细胞
数
拖尾
细胞
数
迁移率
(%)
迁移度(mm)
, 百拇医药 (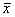 ±s)
±s)
0
0
8
480
6
1.25
3.3±0.7
0
20
6
360
, 百拇医药 14
3.89
4.1±1.0
0.5
20
6
360
45
12.50*Δ
6.4±1.8Δ
2.5
20
6
, 百拇医药
360
39
10.83*
6.7±2.0*Δ
12.5
20
6
360
118
32.78*Δ
6.9±1.8*
与注射20 mg/kg环磷酰胺的健康小鼠比较,*P<0.05;与As2O3剂量相同但未注射环磷酰胺的小鼠比较,ΔP<0.05 2.4 砷对DNA-蛋白质交联的影响 在进行SCGE试验时,用蛋白酶K处理胶板后的试验结果显示。高剂量砷(12.5 mg/L)与环磷酰胺联合作用组小鼠的骨髓细胞经过蛋白酶K处理后,迁移率和迁移度显著高于未经蛋白酶K处理的结果(P<0.05)。
, 百拇医药
3 讨论
Sigh于1988年建立了SCGE方法,这几年成为方法学上的一个热点。我们的实验显示,SCGE可以检测到少数细胞的DNA断裂,能够很好地反映低剂量或损伤效应较轻微的遗传毒性,该方法的结果可以作为检测早期生物学效应的生物标志。
近年来许多研究集中于砷对DNA的损伤效应,其中多以离体细胞为研究对象。由于所采用的剂量和检测方法各不相同,实验结果也存在很多争论。有些实验未发现DNA的损伤[8],有的研究认为砷只是一种促癌剂(promotor),促进其他DNA交联剂的作用。我们对整体动物进行长期慢性染毒,以此方式研究砷在体内对细胞DNA的作用。结果表明,长期摄入高浓度(12.5 mg/L)的As2O3,对小鼠骨髓细胞DNA造成了比较明显的损伤。
长时间低剂量暴露是环境中接触砷最常见的方式,但我们的实验结果显示,较低浓度(0.5、2.5 mg/L)的As2O3对小鼠骨髓细胞DNA的损伤效应并不明显。Zhao等[9]报道砷在体内代谢解毒时消耗了DNA甲基化所需的s-腺苷甲硫氨酸,并使DNA甲基化酶的活力降低,因此导致DNA的低甲基化,而DNA低甲基化可能引起包括促进基因突变等一系列后果。因此,我们选择不明显引起DNA断裂的剂量(20 mg/kg)的环磷酰胺,对长期饮用含砷水的小鼠进行再次染毒,结果中低剂量组也出现了DNA损伤效应,其效应比20 mg/kg 环磷酰胺或同剂量的砷的单独作用都要强。这一现象说明,较低剂量的砷虽然没有直接使细胞DNA出现断裂,但仍会对其结构或功能造成潜在的影响。也就是说可能使细胞DNA的“脆性”增加,当机体受到能引起遗传损伤的其他因素的作用时,即使作用强度很低,也会出现损伤效应。
, http://www.100md.com
砷对DNA修复的研究也是一个重要的研究领域。有研究发现低剂量的砷暴露能抑制DNA连接酶Ⅰ和Ⅱ[10]。我们用蛋白酶K处理已裂解的细胞,可使DNA与蛋白质形成的交联松解,再与未经蛋白酶K处理的SCGE结果进行比较,发现在砷浓度较高、损伤较强的组中,迁移率和迁移度上升,表明高剂量的砷诱导了DNA-蛋白质交联的形成。这种交联可影响了染色体的结构,当DNA受到损伤时会阻碍DNA修复过程。因此,砷在体内对遗传物质的损伤效应是多方面的,低剂量的砷可影响DNA对其他诱变因素的敏感性,高剂量的砷直接引起DNA断裂,DNA-蛋白质交联在其损伤过程中可能起重要作用。加强在这个领域的探索,将会对砷致癌机制的研究产生积极的推动作用。
参考文献
[1] Brown CC,Chu KC.Implication of the multistage theory of carcinogenesis applied to occupational arsenic exposure.J Natl Cancer Inst,1983,70:455-463.
, 百拇医药
[2] Sikorski EE,McCay JA, White KL Jr;et al.Immunotoxicity of the semiconductor gallium arsenide in female B6C3F1 mice.Fundam Appl Toxicol,1989.13:843-858.
[3] Gurr JR.Lin YC HoIC,et al.Induction of chromatid breaks and tstraploidy in chinese hamaster ovary cells by treatment with sodium arsenite during the G2 phase. Mutat Res,1993,319:135-142.
[4] Lerda D.Sister-chromatid exchange(SCE)among individuals chronicall exposed to arsenic in dkink water.Mutat Res,1994,342:111-120.
, 百拇医药
[5] Bjorn H,Harmid V,Bernt B.The concepts of tail moment and tail inertia in the single cell gel electrophoresis assay.Mutat Res,1995,336:123-131.
[6] Singh NP Stephen RE.Microgel electrophoresis:sensitivity,machanism and DNA elctrostenching.Mutat Res,1997,383:167-175.
[7] Fairbairn DW,Olive Peggy,Oneill KL.The comet assay:a comprehensive review.Mutat Res,1995,339:37-59.
[8] 张遵真,衡正昌.用单细胞凝胶电泳技术检测铬和砷的DNA损伤作用.中华预防医学杂志,1997,31:365.
, 百拇医药
[9] Zhao CQ,Yong MR,Diwan BA,et al:Association of arsenic induced malignant reansformation with DNA hypomethylation and abrerrant gene expression.Proc Natl Acad Sci USA,1997.94:10907-10912.
[10] Rudel R,Slayto TM,Beck BD.Implication of arsenic genotoxicity for dose response of carcinogenic effects.Regul Toxicol Parmacol,1996,23:87-105.
(收稿日期:1999-06-14), 百拇医药
单位:中国预防医学科学院环境卫生与卫生工程研究所,北京 100050
关键词:砷;DNA损伤;单细胞凝胶电泳;DNA-蛋白质交联
卫生毒理学杂志000110 摘要 【目的】 了解砷对体内细胞DNA的损伤作用及其机制。【方法】 在小鼠饮水中加入As2O3,喂养6个月,采用单细胞凝胶电泳技术对骨髓细胞DNA断裂进行了分析。【结果】 高剂量组(12.5 mg/L)小鼠骨髓细胞DNA的迁移度和迁移率显著高于阴性对照组,P<0.05;中、低剂量组(2.5、0.5 mg/L)小鼠骨髓细胞DNA的迁移度和迁移率与阴性对照组无显著差异。各剂量组另选6只小鼠,以不引起明显DNA断裂剂量(20 mg/kg)的环磷酰胺进行腹腔注射,骨髓细胞DNA的迁移度和迁移率显著高于接受20 mg/kg环磷酰胺或As3O3单独作用的小鼠(P<0.05)。用蛋白酶K处理裂解后的细胞高剂量组的迁移度与迁移率显著高于未处理的细胞(P<0.05)。【结论】 高剂量的砷在小鼠体内对骨髓细胞DNA有损伤作用,并可诱发DNA-蛋白质交联,而低剂量的砷可能影响DNA对其他诱变剂的敏感性。
, http://www.100md.com
DNA damage in mice bone marrow cells Induced by arsenic
DUAN Zhi-Gang,LI Xue-Ming.
(Institute of Environmental Health & Engineering,Chinese Academy of Preventive Medicine, Beijing 100050,China)
Abstract:【Objective】 To study the damage effect and its mechanism of Arsenic on DNA of cells in vivo.【Methods】 The DNA break in bone marrow cells from the mice which have drunk the water containing As2O3 for 6 months were analyzed with Single cell gel electrophoresis.【Results】 The length of DNA migration and the rate of DNA migration of the bone marrow cells increased remarkably at high dose(12.5 mg/L)group(P<0.05) and there were no significant difference between medium,low dos(2.5,0.5 mg/L) group and control group.Cyclophosphamide 20 mg/kg which do not induce DNA break was intraperitoneally injected to 6 mice each group,the length of DNA migration and the rate of DNA migration of the bone marrow cells were significantly higher than those of both control group which were injected cyclophosphamide only and same As2O3 dose group which were not injected cyclophosphamide.The lysed cells were also treated with proteinase K, the values were higher than those which were not treated with proteinase K(P<0.05).【Conclusion】 High dose arsenic has damage effects on marrow cell's DNA of mice in vivo and induce DNA-protein crosslink at same time.Lower dose arsenic can affect the sensitivity of DNA to other carcinogen.
, 百拇医药
Key words:Arsenic; DNA damage; Single cell gelelectrophoresis; DNA-protein crosslink
砷是确认的人类致癌物,但目前对砷的致癌机制还了解甚少。Brown等[1]报道砷的致癌作用可能与癌基因的扩增有关。有研究发现砷抑制了免疫系统抗肿瘤的能力[2]。近几年,砷对遗传物质的损伤效应引起许多学者的注意,Gurr等[3]用亚砷酸钠处理G2期中国仓鼠卵巢细胞,引起染色体的凝集和断裂,细胞进入间期后又出现微核。流行病学研究也发现砷在体内可对染色体DNA造成损伤[4]。这为探索砷的致癌机制提供了线索,已成为国内外研究的热点。本实验室参考国内外文献建立了单细胞凝胶电泳(SCGE)方法[5~7],用其检测砷在整体动物体内对骨髓细胞DNA的损伤效应,以期对其机制进行探讨。
1 材料与方法
, 百拇医药
1.1 动物染毒 昆明种小鼠80只,雌雄各半,由医科院实验动物中心提供(合格证号:医动字 01-3001),分为4组,每组20只,在饮水中加入As2O3,浓度分别为0(阴性对照)、0.5、2.5和12.5 mg/L,连续喂养6个月。
为研究砷对其他诱变剂作用的影响,另选未处理过的小鼠24只,平均分为4组,分别腹腔注射剂量为10、20、40和80 mg/kg(阳性对照)的环磷酰胺,注射后18 h处死动物,分离骨髓细胞进行SCGE分析,以确定环磷酰胺不明显引起DNA断裂的最小剂量(阈剂量)。在确定阈剂量后,在饮用含砷水的各组中每组随机选6只小鼠,以此阈剂量腹腔注射环磷酰胺,18 h后处死动物,进行SCGE分析。同时处死各组中剩余的小鼠,进行SCGE分析。
1.2 骨髓细胞的分离与制备 动物处死后,分离股骨,用生理盐水冲洗骨髓腔,收集骨髓细胞,用Hank's液洗两次后,悬浮于PBS液(pH 7.4),制成细胞悬液,调整细胞浓度大约为1×106个/ml。
, 百拇医药
1.3 SCGE电泳 取0.6ml质量分数为5%的普通熔点琼脂糖(CMA)平铺于磨砂载玻片上,盖上盖玻片,4 ℃冷凝10 min后揭去盖玻片。在37 ℃下将细胞悬液与质量分数为0.5%低熔点琼脂点(LMA)1∶9混匀,取80 μl混合液铺于头层胶上,盖上盖玻片,4 ℃冷凝10 min后揭去盖玻片,再在上面覆盖一层质量分数为0.5%LMA,4℃冷凝10 min,完成制片。每只小鼠骨髓细胞制成4张平行胶板。
胶板制好后将其浸没于细胞裂解液(2 mol/L Nacl,100 mmol/L EDTA-Na2,1%十二脘基肌氨酸钠,10 mmol/L Tris pH10.0,用前加入1%Triton X-100),4 ℃裂解1 h。为了解细胞中的DNA-蛋白质交联的情况,裂解后每个样品取2张胶板,浸没于含1 mg/ml蛋白酶K的细胞裂解液(不加1%Triton X-100)中,37 ℃静置2 h。胶板在装有电泳缓冲液(300 mmol/L NaOH,1 mmol/L EDTA-Na2,pH 13.0)的水平电泳槽中,4 ℃静置20 min,电泳(25 V,300 mA)20 min。电泳后将胶板浸没于Tris液(0.4 mol/L,pH 7.4),中和15 min后用20 μg/mlEB染色。
, http://www.100md.com
以上步骤均在暗室中完成,以避免额外的DNA损伤。
1.4 结果观察与测定 在荧光显微镜下观察细胞图像,绿光激发,吸收滤片590 nm,目镜10×,物镜20×,用富士黑白胶卷(ASA200)拍摄相片。以此底片测定试验结果。每张胶板随机观察30个细胞,观察指标为迁移率和迁移度:
迁移率(The rate of DNA migration)=(拖尾细胞数/测定细胞数)×100%;
迁移度(Length of DNA migration)=(∑每个细胞直径/测定细胞数)±s
1.5 统计学分析 实验结果用SPSS统计学软件进行分析,两组间迁移度的比较用t检验,两组迁移率的比较用卡方检验。
2 结果
, http://www.100md.com
2.1 Comet图像 在荧光显微镜下,DNA呈亮橘红色。在阳性对照(环磷酰胺80 mg/kg)样品中,细胞DNA链产生断裂,既而引起高级结构松散,在电场作用下,断裂的DNA片段会离开细胞核向正极泳动,形成拖尾现象,且迁移长度与DNA损伤的程度有关。而未发生DNA断裂的细胞只有一个完整的头部。(见图1)
2.2 砷对DNA的损伤效应 饮用含砷饮水的各组小鼠骨髓细胞的SCGE结果见表1。高剂量组(12.5 mg/L)小鼠骨髓细胞DNA迁移率及迁移度都高于阴性对照组,经卡方检验和t检验,差异有显著性(P<0.05)。
表1 饮用含砷水的各组小鼠骨髓细胞SCGE结果 As2O3浓度
(mg/L)
动物数
, 百拇医药 测定
细胞数
拖尾
细胞数
迁移数
(%)
迁移度(mm)
(
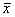 ±s)
±s)0(阴性对照)
8
480
6
, http://www.100md.com
1.25
3.3±0.7
0.5
6
360
4
1.11
3.7±0.8
2.5
8
480
41
8.54**
, 百拇医药
3.5±0.5
12.5
10
600
141
23.50**
3.5±0.5
阳性对照
8
480
480
100.00**
, http://www.100md.com
13.4±4.9**
与阴性对照组比较,**P<0.05

图1 小鼠骨髓细胞SCGE图像
2.3 砷对环磷酰胺作用的影响 注射不同剂量环磷酰胺的未处理小鼠骨髓细胞SCGE结果见表2。注射40、80 mg/kg环磷酰胺的小鼠骨髓细胞DNA迁移率与迁移度均显著高于阴性对照(P<0.05),而注射20 mg/kg环磷酰胺的小鼠骨髓细胞DNA迁移率、迁移度与阴性对照组差异无显著性(P<0.05),因此20 mg/kg 被认为是不明显引起DNA断裂阈剂量的水平。
表2 注射环磷酰胺的未处理小鼠骨髓细胞SCGE结果 环磷酰胺剂量
, 百拇医药
(mg/kg)
动物数
测定
细胞数
拖尾
细胞数
迁移率
(%)
迁移度(mm)
(
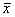 ±s)
±s)0
8
, 百拇医药
480
6
1.25
3.3±0.7
10
6
360
7
1.94
3.6±0.8
20
6
360
, 百拇医药
14
3.86
4.1±1.0
40
6
360
238
66.11**
7.3±2.5*
80
8
480
480
, 百拇医药
100.00**
13.4±4.9*
与阴性对照相比,**P<0.05 饮用含砷水的各组小鼠在注射20 mg/kg环磷酰胺后骨髓细胞SCGE结果见表3。20 mg/kg环磷酰胺不会引起未处理小鼠细胞的DNA发生损伤,但饮用含砷水的各组小鼠在注射20mg/kg环磷酰胺后,其骨髓细胞DNA的迁移率及迁移度各有不同程度的上升。
表3 注射环磷酰胺的染砷组小鼠骨髓细胞SCGE结果 As2O3
浓度
(mg/L)
环磷酰胺
, 百拇医药
剂量
(mg/kg)
动物
数
测定
细胞
数
拖尾
细胞
数
迁移率
(%)
迁移度(mm)
, 百拇医药 (
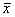 ±s)
±s)0
0
8
480
6
1.25
3.3±0.7
0
20
6
360
, 百拇医药 14
3.89
4.1±1.0
0.5
20
6
360
45
12.50*Δ
6.4±1.8Δ
2.5
20
6
, 百拇医药
360
39
10.83*
6.7±2.0*Δ
12.5
20
6
360
118
32.78*Δ
6.9±1.8*
与注射20 mg/kg环磷酰胺的健康小鼠比较,*P<0.05;与As2O3剂量相同但未注射环磷酰胺的小鼠比较,ΔP<0.05 2.4 砷对DNA-蛋白质交联的影响 在进行SCGE试验时,用蛋白酶K处理胶板后的试验结果显示。高剂量砷(12.5 mg/L)与环磷酰胺联合作用组小鼠的骨髓细胞经过蛋白酶K处理后,迁移率和迁移度显著高于未经蛋白酶K处理的结果(P<0.05)。
, 百拇医药
3 讨论
Sigh于1988年建立了SCGE方法,这几年成为方法学上的一个热点。我们的实验显示,SCGE可以检测到少数细胞的DNA断裂,能够很好地反映低剂量或损伤效应较轻微的遗传毒性,该方法的结果可以作为检测早期生物学效应的生物标志。
近年来许多研究集中于砷对DNA的损伤效应,其中多以离体细胞为研究对象。由于所采用的剂量和检测方法各不相同,实验结果也存在很多争论。有些实验未发现DNA的损伤[8],有的研究认为砷只是一种促癌剂(promotor),促进其他DNA交联剂的作用。我们对整体动物进行长期慢性染毒,以此方式研究砷在体内对细胞DNA的作用。结果表明,长期摄入高浓度(12.5 mg/L)的As2O3,对小鼠骨髓细胞DNA造成了比较明显的损伤。
长时间低剂量暴露是环境中接触砷最常见的方式,但我们的实验结果显示,较低浓度(0.5、2.5 mg/L)的As2O3对小鼠骨髓细胞DNA的损伤效应并不明显。Zhao等[9]报道砷在体内代谢解毒时消耗了DNA甲基化所需的s-腺苷甲硫氨酸,并使DNA甲基化酶的活力降低,因此导致DNA的低甲基化,而DNA低甲基化可能引起包括促进基因突变等一系列后果。因此,我们选择不明显引起DNA断裂的剂量(20 mg/kg)的环磷酰胺,对长期饮用含砷水的小鼠进行再次染毒,结果中低剂量组也出现了DNA损伤效应,其效应比20 mg/kg 环磷酰胺或同剂量的砷的单独作用都要强。这一现象说明,较低剂量的砷虽然没有直接使细胞DNA出现断裂,但仍会对其结构或功能造成潜在的影响。也就是说可能使细胞DNA的“脆性”增加,当机体受到能引起遗传损伤的其他因素的作用时,即使作用强度很低,也会出现损伤效应。
, http://www.100md.com
砷对DNA修复的研究也是一个重要的研究领域。有研究发现低剂量的砷暴露能抑制DNA连接酶Ⅰ和Ⅱ[10]。我们用蛋白酶K处理已裂解的细胞,可使DNA与蛋白质形成的交联松解,再与未经蛋白酶K处理的SCGE结果进行比较,发现在砷浓度较高、损伤较强的组中,迁移率和迁移度上升,表明高剂量的砷诱导了DNA-蛋白质交联的形成。这种交联可影响了染色体的结构,当DNA受到损伤时会阻碍DNA修复过程。因此,砷在体内对遗传物质的损伤效应是多方面的,低剂量的砷可影响DNA对其他诱变因素的敏感性,高剂量的砷直接引起DNA断裂,DNA-蛋白质交联在其损伤过程中可能起重要作用。加强在这个领域的探索,将会对砷致癌机制的研究产生积极的推动作用。
参考文献
[1] Brown CC,Chu KC.Implication of the multistage theory of carcinogenesis applied to occupational arsenic exposure.J Natl Cancer Inst,1983,70:455-463.
, 百拇医药
[2] Sikorski EE,McCay JA, White KL Jr;et al.Immunotoxicity of the semiconductor gallium arsenide in female B6C3F1 mice.Fundam Appl Toxicol,1989.13:843-858.
[3] Gurr JR.Lin YC HoIC,et al.Induction of chromatid breaks and tstraploidy in chinese hamaster ovary cells by treatment with sodium arsenite during the G2 phase. Mutat Res,1993,319:135-142.
[4] Lerda D.Sister-chromatid exchange(SCE)among individuals chronicall exposed to arsenic in dkink water.Mutat Res,1994,342:111-120.
, 百拇医药
[5] Bjorn H,Harmid V,Bernt B.The concepts of tail moment and tail inertia in the single cell gel electrophoresis assay.Mutat Res,1995,336:123-131.
[6] Singh NP Stephen RE.Microgel electrophoresis:sensitivity,machanism and DNA elctrostenching.Mutat Res,1997,383:167-175.
[7] Fairbairn DW,Olive Peggy,Oneill KL.The comet assay:a comprehensive review.Mutat Res,1995,339:37-59.
[8] 张遵真,衡正昌.用单细胞凝胶电泳技术检测铬和砷的DNA损伤作用.中华预防医学杂志,1997,31:365.
, 百拇医药
[9] Zhao CQ,Yong MR,Diwan BA,et al:Association of arsenic induced malignant reansformation with DNA hypomethylation and abrerrant gene expression.Proc Natl Acad Sci USA,1997.94:10907-10912.
[10] Rudel R,Slayto TM,Beck BD.Implication of arsenic genotoxicity for dose response of carcinogenic effects.Regul Toxicol Parmacol,1996,23:87-105.
(收稿日期:1999-06-14), 百拇医药