极低频弱磁场对PC-12瘤细胞胞内游离钙离子浓度的影响
作者:黄春明 叶晖 徐建华 林家瑞 瞿安连
单位:黄春明(华中理工大学 生物工程系,武汉 430074);叶晖(华中理工大学 生物工程系,武汉 430074);林家瑞(华中理工大学 生物工程系,武汉 430074);徐建华(华中理工大学 生物物理与生物化学研究所,武汉 430074);瞿安连(华中理工大学 生物物理与生物化学研究所,武汉 430074)
关键词:极低频弱磁场;显微荧光测量;胞内游离钙离子浓度
生物医学工程学杂志000118 摘 要:采用极低频弱磁场对鼠嗜铬细胞瘤PC-12株系细胞进行照射,利用显微荧光技术动态监测胞内游离钙离子浓度([(Ca2+]i)的变化,实验结果表明:50 Hz,100 μT的正弦磁场照射引起[Ca2+]i明显升高;而在同等强度的静磁场和2000 Hz正弦磁场照射下,[Ca2+]i基本维持不变。进一步的实验说明[Ca2+]i的升高部分源于细胞外Ca2+的跨膜内流,部分源于胞内钙库的释放。证实了一定强度下特定频率的极低频弱磁场能够影响钙离子的跨膜运输和胞内钙库的释放,从而在细胞和分子水平产生生物效应。
, 百拇医药
Effects of Extremely Low Frequency Weak Magnetic Fields
on the Intracellular Free Calcium Concentration
in PC-12 Tumor Cells
Huang Chunming Ye Hui Liu Jiarui
(Dept. of Bioengineering, Huazhong Univ of Sci & Tech, Wuhan 430074)
Xu Jianhua Qu Anlian
(Inst. of Biophysics & Biochemistry, Huazhong Univ of Sci & Tech, Wuhan 430074)
, 百拇医药
Abstract:In this study the effects of the extremely low frequency (ELF) magnetic fields on intracellular Ca2+ concentration ([Ca2+]i) of rat chromaffinoma PC-12 cells were examined by using a digital fluorescence image microscopy system. A 50 Hz, 100 μT sinusoidal ELF magnetic field increased [Ca2+]i to a marked level, whereas a static field or a field of higher frequency (2000 Hz) did not cause a [Ca2+]i increase. The magnetic field-induced [Ca2+]i rise was partly due to an influx of extracellular Ca2+ and partly due to the release of intracellular Ca2+ pool. It seemed likely that the Ca2+ transport ability of the cell membranes was increased by the 50 Hz magnetic field.
, http://www.100md.com
Key words:Extremely low frequency magnetic field Microfluorimetry Intracellular free calcium concentration▲
1 引 言
近年来,有关交流时变磁场的生物效应研究广泛展开。随着用电量的增大,人们越来越关心低能量的极低频磁场对生物体的影响。由于缺乏严谨完善且为大家所普遍接受的生物物理机制,极低频弱磁场是否能对活的有机体产生影响仍大有争议。许多研究者以实验证明极低频弱磁场的确会引起显著的生物效应,而另外一些科学家却从势噪声限制条件出发推出了否定的结论。已报道的极低频弱磁场的生物效应包括刺激神经再生、改变基因转录和细胞繁殖等,Ca2+在这些效应的传导中所起的作用已有论述,也有Ca2+参与的证据。细胞溶质Ca2+稳定是调节各种生物效应的关键,具有重要的生理意义。本文以Fura-2为荧光指针,研究了同等强度(100μT)而频率不同的正弦磁场对PC-12瘤细胞胞内游离钙离子浓度的影响。实验结果表明PC-12细胞确实能对极低频弱磁场做出反应且具有频率特异性,胞内增加的Ca2+部分源于胞外Ca2+的跨膜内流,部分源于胞内钙库的释放。
, 百拇医药
2 材 料
(1)Fura-2/AM,胰蛋白酶,Hepes等,SIGMA公司产品;DMEM培养基,胎牛血清等,GIBCO产品;磁场发生装置与线圈自制;大鼠嗜铬细胞瘤PC-12株系细胞来自同济医科大学;
(2)细胞外液成分(mmol/L) NaCl 140,CaCl2 1.0;MgSO4 0.4,MgCl2 0.5,KCl 5.0,NaHCO3 3.0,KH2PO4 0.4,Na2HPO4 0.6, Hepes 20,D-Glucose 10(pH=7.3);
(3)无钙液(D-Hanks)成分(mmol/L) NaCl 140,KCl 5.0, Na2HPO4 H2O 0.4, KH2PO4 0.4, NaHCO3 4(pH=7.4);
, 百拇医药
(4)钙溶液成分(mmol/L) CaCl2 100。
3 方 法
3.1 细胞的荧光负载
在细胞外液中加入适量的Fura-2/AM荧光探针至终浓度4 μmol/L,37 ℃下温育30 min[6],然后用细胞外液冲洗三次,以除去未负载的Fura-2/AM,将贴附着细胞的盖玻片置于测定槽中,滴加500 μl细胞外液或D-Hanks液。
3.2 磁场照射
采用自制正弦电流发生装置与圆形线圈产生磁场。正弦电流大小、频率可调。线圈直径D=9.8 cm,以直径0.7 mm的漆包铜线紧密绕制而成,总匝数N=25。线圈中心处磁感应强 度的大小根据B=μ0IN/D计算[7]。其中μ0=1.257×10-6H.m-1是真空磁导率,I是线圈中的电流强度(A)。实验选择磁感应强度B=100 μT,磁场频率f=0、50、2000 Hz。静磁场由外接稳压电源产生的直流电流流过线圈产生。实验时线圈置于工作台上,测定槽置于线圈中央。
, http://www.100md.com
3.3 单细胞的[Ca2+]i测量
我们用75 W的氙光源作为荧光激发光源,该光源通过一可程控转角的光栅反射后成为单色光源(T.I.L.L.Photonics,Genmany),通过计算机选择不同波长的单色光,其响应时间为2 ms,单色光通过一段光纤导入屏蔽罩,通过倒置荧光显微镜(Zeiss Axiovert 100,Germany)的激发荧光通路,由分光镜反射后经40X,NA 0.75的plan Neofluar紫外物镜聚光后照射在贴附于盖玻片底的细胞上。细胞受激发产生的荧光通过物镜,500 nm带通滤光片的光阑进入光电倍增管。记录范围由光阑限制在直径为18 μm的圆圈内。光电倍增管的输出信号经10 KHz的频率采样送计算机(Apple Macintosh Quadra 650,USA)处理。
3.4 Fura-2荧光微量测量法原理
, http://www.100md.com Fura-2[8]是疏酯分子,不能自由进入细胞,它是以乙酰羟甲基酯即Fura-2/AM的形式负载入目标细胞的。进入细胞后,胞浆内的非特异性酯酶可将Fura-2/AM水解为Fura-2,与胞浆内游离Ca2+结合形成Fura-2-Ca2+化合物。当激发波长大于370 nm时,该化合物的荧光强度随Ca2+浓度的升高而降低;而当激发波长小于370 nm时,该化合物的荧光强度随Ca2+浓度升高而升高。实验中记录激发波长分别为345 nm和380 nm时的发射荧光强度F345和F380以及它们的比值:quot=F345/F380,该值反映[Ca2+]i的变化情况。
4 结 果
(1)在标准细胞外液下,采用50 Hz,100 μT正弦磁场对细胞照射一段时间后,一般引起[Ca2+]i升高,升高曲线平缓。开始出现升高的时间以及升高的幅值随细胞不同而不同,但一般在照射20 min后都有明显的变化。随着照射时间的增加,[Ca2+]i上升速度逐渐加快,出现另一个时间常数。在磁场加入前后各记录30例细胞的瞬时quot值作统计分析。结果表明经过60 min的照射,细胞的平均quot值由740.0±104.4上升至863.0±181.4,[Ca2+]i明显上升。图1是50 Hz,100 μT磁场照射下的[Ca2+]i动态曲线图谱,对该曲线进行指数拟合,其时间常数τ分别是6.8×10-4(ab)和1.6×10-3(cd)。说明在照射期的前15 min内是一个相对缓慢的上升过程,而在15 min后是一个相对快速的上升过程。
, http://www.100md.com
图1 50Hz, 100 μT正弦磁场引起PC-12细胞[Ca2+]i上升
Fig 1 The increase of [Ca2+]i of PC-12 cells results from 50Hz, 100 μT sine magnetic field
(2)同等强度的较高频率正弦磁场(2000 Hz,100 μT)在约1 h的照射期内不能引起[Ca2+]i的变化(n=4)(图略)。照射前后的平均quot值分别为548.2±47.4和541.8±46.6(n=30)。
在2000 Hz磁场照射一般时间后,[Ca2+]i并无变 化,此时再换用50 Hz磁场照射,[Ca2+]i都有不同程度的升高(n=4),这表明细胞对50 Hz磁场的敏感性强。图2是一例经2000 Hz,100 μT磁场照射55分钟后转用50 Hz磁场照射的[Ca2+]i变化曲线,说明了这一现象。照射前的平均quot值为598.0±273.0,2000 Hz磁场照射后的平均quot值为608.4±207.7,换用50 Hz磁场照射后的平均quot值为719.0±248.4(n=30)。
, 百拇医药
图2 PC-12细胞先经2000 Hz正弦磁场照射,然后再经50 Hz正弦磁场照射时的[Ca2+]i变化。50 Hz磁场引起[Ca2+]i升高
Fig 2 [Ca2+]i of PC-12 cells exposed to 50 Hz, 100 μT magnetic field after exposed to 2000 Hz, 100 μT magnetic field. The 50 Hz magnetic field results in the increase of [Ca2+]i
(3)以100 μT的静磁场照射标准细胞外液中PC-12细胞,不能引起[Ca2+]i的变化(n=4)(图略)。照射前后的平均quot值分别为599.8±147.4和603.5±186.6(n=30)。
, 百拇医药
(4)在无钙液中,50 Hz,100 μT磁场的照射也能引起[Ca2+]i上升,但与标准细胞外液情况相比,上升较为缓慢(图3)。细胞在无钙液中接受磁场照射一段时间(如380 s)后,取一定量100 mmol/L CaCl2母液加入到外液中,使外液中Ca2+的终浓度为2 mmol/L。继续照射期间[Ca2+]i上升速度明显加快,出现另一个时常数。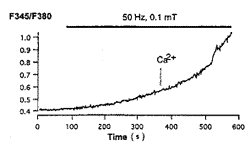
图3 无钙液中PC-12细胞受50 Hz,100 μT正弦磁场照射时,[Ca2+]i缓慢上升,在外液加入Ca2+后,[Ca2+]i显著上升
Fig 3 [Ca2+]i of PC-12 cells exposed to 50 Hz, 100 μT magnetic field increases slowly in decalcium solution. After Ca2+ is added to the initial solution, the [Ca2+]i increases evidently
, 百拇医药
5 讨 论
各国学者所提出的极低频弱磁场生物效应机理大致分为两大类:磁场直接作用机制和磁场间接作用机制。磁场间拉作用机制认为生物效应是由磁场的感应电场所诱发,而与磁场本身无关。磁场直接作用机制则认为生物效应是由磁场直接诱发(如参量谐振理论)或由磁场与感应电场共同诱发(如离子回旋谐振)。本实验中,细胞基本上处于细圈中心,膜上的感应电场最大不会超过100 V/m,膜电势的波动在1 μV数量级,比热噪声所引起的膜电势波动还要小一个数量级,故磁场间接作用机制可剔除。我们将重点放在磁场直接作用机制上。在极低频弱磁场作用下 ,[Ca2+]i的升高具有频率特异性,即50 Hz有升高而0 Hz和2000 Hz无变化,这似乎与某种谐振理论相吻合。在实验当地,地磁场的垂直分量为38.0 μT,水平分量为28.6 μT,50 Hz与钙离子回旋谐振频率的两倍相近。
膜电势1 μV的波动是无法打开电压门控性离子通道的,因此磁场引起[Ca2+]i升高可能是通过如下两个途径:①影响胞内钙库的细胞器膜,促使Ca2+释放;②增加细胞膜的通透性,使细胞外Ca2+涌入胞内。与有钙液相比,无钙液中的升高较为缓慢,这说明[Ca2+]i的升高部分依赖于外钙内流,部分依赖于钙库释放。
, 百拇医药
本研究证实了一定强度下特定频率的极低频弱磁场能够影响钙离子的跨膜运输和胞内钙库的释放,从而在细胞和分子水平产生生物效应。■
基金项目:国家自然科学基金资助项目(39670194)
参考文献:
[1]Smith JA.Regulatiion of cell proliferation. In:George MP et al Eds. Cell cycle controls, New York:Academic,1974∶43-60
[2]张沪生,叶晖,张晴川等.用电镜观测超低频脉冲磁场对鼠S-180肉瘤的抑制作用.科学通报,1994;39(21)∶2000
[3]Tuffet S, de Seze R, Veyret B. Effect of a strong pulsed magnetic field on the proliferation of tumour cells in vitrol. Bioelectrochemisty and Bionergetics, 1993; 30∶151
, 百拇医药
[4]张小云,刘栋,张晓鄂等.磁场对细胞生长分裂的影响及机制的探讨.中国科学(B辑),1989;19(2)∶164
[5]Mulay IL, Mulay LN. Effect of a magnetic field on sarcoma 37 ascites tumour cells. Nature, 1960; 4780∶1019
[6]Malgaroli A, Milani D, Meldolesi J et al.Fura-2 measurement of cytosolic free Ca2+ in monolayers and suspensions of various types of animal cells. J Cell Biol,1987; 105∶2145
[7]de Seze R, Lahitte A, Moreau JM et al.Generation of extremely-low-frequency magnetic fields with standard available commerical equipment:implications for experimental bioelectromagnetics work. Bioelectrochemistry and Bionenergetics, 1994; 35∶127
, http://www.100md.com
[8]Grykiewiez G, Poenie M, Tsien RY. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem, 1985; 260(6)∶3440
[9]Barbier E, Dufy B, Veyret B. Stimulation of Ca2+ influx in rat pituitary cells under exposure to a 50Hz magnetic field. Bioelectromagnetics, 1996; 17∶303
[10]Reinbold KA, Pollack SR. Serum plays a critical role in modulating [Ca2+]c of primary culture bone cells exposed to weak ion-resonance magnetic fields. Bioelectromagnetics, 1997;18∶203
, 百拇医药
[11]叶晖,林家瑞,叶琴.低频磁场对膜离子通道状态的影响.武汉大学学报(应用物理专刊),1997;6∶217
[12]Borle AB. Control, Modulation and regulation of cell calcium. Rev Physiol, Biochem, 1981; 90∶131
[13]Rasmuss EH, Rarrett PQ. Calcium messenger system. An Integrated Review, 1984; 64∶938
[14]Williamson JR, Cooper RH, Hoek JB. Role of calcium in the hormonal regulation of liver metablism. Biochem Biophys Acta, 1981;639∶243
[15]张沪生,叶晖,张传清等.超低频脉冲磁场抑制癌瘤和提高细胞免疫功能的实验研究.中国科学(C辑),1997;27(2)∶173
收稿日期:1998-09-07, 百拇医药
单位:黄春明(华中理工大学 生物工程系,武汉 430074);叶晖(华中理工大学 生物工程系,武汉 430074);林家瑞(华中理工大学 生物工程系,武汉 430074);徐建华(华中理工大学 生物物理与生物化学研究所,武汉 430074);瞿安连(华中理工大学 生物物理与生物化学研究所,武汉 430074)
关键词:极低频弱磁场;显微荧光测量;胞内游离钙离子浓度
生物医学工程学杂志000118 摘 要:采用极低频弱磁场对鼠嗜铬细胞瘤PC-12株系细胞进行照射,利用显微荧光技术动态监测胞内游离钙离子浓度([(Ca2+]i)的变化,实验结果表明:50 Hz,100 μT的正弦磁场照射引起[Ca2+]i明显升高;而在同等强度的静磁场和2000 Hz正弦磁场照射下,[Ca2+]i基本维持不变。进一步的实验说明[Ca2+]i的升高部分源于细胞外Ca2+的跨膜内流,部分源于胞内钙库的释放。证实了一定强度下特定频率的极低频弱磁场能够影响钙离子的跨膜运输和胞内钙库的释放,从而在细胞和分子水平产生生物效应。
, 百拇医药
Effects of Extremely Low Frequency Weak Magnetic Fields
on the Intracellular Free Calcium Concentration
in PC-12 Tumor Cells
Huang Chunming Ye Hui Liu Jiarui
(Dept. of Bioengineering, Huazhong Univ of Sci & Tech, Wuhan 430074)
Xu Jianhua Qu Anlian
(Inst. of Biophysics & Biochemistry, Huazhong Univ of Sci & Tech, Wuhan 430074)
, 百拇医药
Abstract:In this study the effects of the extremely low frequency (ELF) magnetic fields on intracellular Ca2+ concentration ([Ca2+]i) of rat chromaffinoma PC-12 cells were examined by using a digital fluorescence image microscopy system. A 50 Hz, 100 μT sinusoidal ELF magnetic field increased [Ca2+]i to a marked level, whereas a static field or a field of higher frequency (2000 Hz) did not cause a [Ca2+]i increase. The magnetic field-induced [Ca2+]i rise was partly due to an influx of extracellular Ca2+ and partly due to the release of intracellular Ca2+ pool. It seemed likely that the Ca2+ transport ability of the cell membranes was increased by the 50 Hz magnetic field.
, http://www.100md.com
Key words:Extremely low frequency magnetic field Microfluorimetry Intracellular free calcium concentration▲
1 引 言
近年来,有关交流时变磁场的生物效应研究广泛展开。随着用电量的增大,人们越来越关心低能量的极低频磁场对生物体的影响。由于缺乏严谨完善且为大家所普遍接受的生物物理机制,极低频弱磁场是否能对活的有机体产生影响仍大有争议。许多研究者以实验证明极低频弱磁场的确会引起显著的生物效应,而另外一些科学家却从势噪声限制条件出发推出了否定的结论。已报道的极低频弱磁场的生物效应包括刺激神经再生、改变基因转录和细胞繁殖等,Ca2+在这些效应的传导中所起的作用已有论述,也有Ca2+参与的证据。细胞溶质Ca2+稳定是调节各种生物效应的关键,具有重要的生理意义。本文以Fura-2为荧光指针,研究了同等强度(100μT)而频率不同的正弦磁场对PC-12瘤细胞胞内游离钙离子浓度的影响。实验结果表明PC-12细胞确实能对极低频弱磁场做出反应且具有频率特异性,胞内增加的Ca2+部分源于胞外Ca2+的跨膜内流,部分源于胞内钙库的释放。
, 百拇医药
2 材 料
(1)Fura-2/AM,胰蛋白酶,Hepes等,SIGMA公司产品;DMEM培养基,胎牛血清等,GIBCO产品;磁场发生装置与线圈自制;大鼠嗜铬细胞瘤PC-12株系细胞来自同济医科大学;
(2)细胞外液成分(mmol/L) NaCl 140,CaCl2 1.0;MgSO4 0.4,MgCl2 0.5,KCl 5.0,NaHCO3 3.0,KH2PO4 0.4,Na2HPO4 0.6, Hepes 20,D-Glucose 10(pH=7.3);
(3)无钙液(D-Hanks)成分(mmol/L) NaCl 140,KCl 5.0, Na2HPO4 H2O 0.4, KH2PO4 0.4, NaHCO3 4(pH=7.4);
, 百拇医药
(4)钙溶液成分(mmol/L) CaCl2 100。
3 方 法
3.1 细胞的荧光负载
在细胞外液中加入适量的Fura-2/AM荧光探针至终浓度4 μmol/L,37 ℃下温育30 min[6],然后用细胞外液冲洗三次,以除去未负载的Fura-2/AM,将贴附着细胞的盖玻片置于测定槽中,滴加500 μl细胞外液或D-Hanks液。
3.2 磁场照射
采用自制正弦电流发生装置与圆形线圈产生磁场。正弦电流大小、频率可调。线圈直径D=9.8 cm,以直径0.7 mm的漆包铜线紧密绕制而成,总匝数N=25。线圈中心处磁感应强 度的大小根据B=μ0IN/D计算[7]。其中μ0=1.257×10-6H.m-1是真空磁导率,I是线圈中的电流强度(A)。实验选择磁感应强度B=100 μT,磁场频率f=0、50、2000 Hz。静磁场由外接稳压电源产生的直流电流流过线圈产生。实验时线圈置于工作台上,测定槽置于线圈中央。
, http://www.100md.com
3.3 单细胞的[Ca2+]i测量
我们用75 W的氙光源作为荧光激发光源,该光源通过一可程控转角的光栅反射后成为单色光源(T.I.L.L.Photonics,Genmany),通过计算机选择不同波长的单色光,其响应时间为2 ms,单色光通过一段光纤导入屏蔽罩,通过倒置荧光显微镜(Zeiss Axiovert 100,Germany)的激发荧光通路,由分光镜反射后经40X,NA 0.75的plan Neofluar紫外物镜聚光后照射在贴附于盖玻片底的细胞上。细胞受激发产生的荧光通过物镜,500 nm带通滤光片的光阑进入光电倍增管。记录范围由光阑限制在直径为18 μm的圆圈内。光电倍增管的输出信号经10 KHz的频率采样送计算机(Apple Macintosh Quadra 650,USA)处理。
3.4 Fura-2荧光微量测量法原理
, http://www.100md.com Fura-2[8]是疏酯分子,不能自由进入细胞,它是以乙酰羟甲基酯即Fura-2/AM的形式负载入目标细胞的。进入细胞后,胞浆内的非特异性酯酶可将Fura-2/AM水解为Fura-2,与胞浆内游离Ca2+结合形成Fura-2-Ca2+化合物。当激发波长大于370 nm时,该化合物的荧光强度随Ca2+浓度的升高而降低;而当激发波长小于370 nm时,该化合物的荧光强度随Ca2+浓度升高而升高。实验中记录激发波长分别为345 nm和380 nm时的发射荧光强度F345和F380以及它们的比值:quot=F345/F380,该值反映[Ca2+]i的变化情况。
4 结 果
(1)在标准细胞外液下,采用50 Hz,100 μT正弦磁场对细胞照射一段时间后,一般引起[Ca2+]i升高,升高曲线平缓。开始出现升高的时间以及升高的幅值随细胞不同而不同,但一般在照射20 min后都有明显的变化。随着照射时间的增加,[Ca2+]i上升速度逐渐加快,出现另一个时间常数。在磁场加入前后各记录30例细胞的瞬时quot值作统计分析。结果表明经过60 min的照射,细胞的平均quot值由740.0±104.4上升至863.0±181.4,[Ca2+]i明显上升。图1是50 Hz,100 μT磁场照射下的[Ca2+]i动态曲线图谱,对该曲线进行指数拟合,其时间常数τ分别是6.8×10-4(ab)和1.6×10-3(cd)。说明在照射期的前15 min内是一个相对缓慢的上升过程,而在15 min后是一个相对快速的上升过程。

, http://www.100md.com
图1 50Hz, 100 μT正弦磁场引起PC-12细胞[Ca2+]i上升
Fig 1 The increase of [Ca2+]i of PC-12 cells results from 50Hz, 100 μT sine magnetic field
(2)同等强度的较高频率正弦磁场(2000 Hz,100 μT)在约1 h的照射期内不能引起[Ca2+]i的变化(n=4)(图略)。照射前后的平均quot值分别为548.2±47.4和541.8±46.6(n=30)。
在2000 Hz磁场照射一般时间后,[Ca2+]i并无变 化,此时再换用50 Hz磁场照射,[Ca2+]i都有不同程度的升高(n=4),这表明细胞对50 Hz磁场的敏感性强。图2是一例经2000 Hz,100 μT磁场照射55分钟后转用50 Hz磁场照射的[Ca2+]i变化曲线,说明了这一现象。照射前的平均quot值为598.0±273.0,2000 Hz磁场照射后的平均quot值为608.4±207.7,换用50 Hz磁场照射后的平均quot值为719.0±248.4(n=30)。

, 百拇医药
图2 PC-12细胞先经2000 Hz正弦磁场照射,然后再经50 Hz正弦磁场照射时的[Ca2+]i变化。50 Hz磁场引起[Ca2+]i升高
Fig 2 [Ca2+]i of PC-12 cells exposed to 50 Hz, 100 μT magnetic field after exposed to 2000 Hz, 100 μT magnetic field. The 50 Hz magnetic field results in the increase of [Ca2+]i
(3)以100 μT的静磁场照射标准细胞外液中PC-12细胞,不能引起[Ca2+]i的变化(n=4)(图略)。照射前后的平均quot值分别为599.8±147.4和603.5±186.6(n=30)。
, 百拇医药
(4)在无钙液中,50 Hz,100 μT磁场的照射也能引起[Ca2+]i上升,但与标准细胞外液情况相比,上升较为缓慢(图3)。细胞在无钙液中接受磁场照射一段时间(如380 s)后,取一定量100 mmol/L CaCl2母液加入到外液中,使外液中Ca2+的终浓度为2 mmol/L。继续照射期间[Ca2+]i上升速度明显加快,出现另一个时常数。

图3 无钙液中PC-12细胞受50 Hz,100 μT正弦磁场照射时,[Ca2+]i缓慢上升,在外液加入Ca2+后,[Ca2+]i显著上升
Fig 3 [Ca2+]i of PC-12 cells exposed to 50 Hz, 100 μT magnetic field increases slowly in decalcium solution. After Ca2+ is added to the initial solution, the [Ca2+]i increases evidently
, 百拇医药
5 讨 论
各国学者所提出的极低频弱磁场生物效应机理大致分为两大类:磁场直接作用机制和磁场间接作用机制。磁场间拉作用机制认为生物效应是由磁场的感应电场所诱发,而与磁场本身无关。磁场直接作用机制则认为生物效应是由磁场直接诱发(如参量谐振理论)或由磁场与感应电场共同诱发(如离子回旋谐振)。本实验中,细胞基本上处于细圈中心,膜上的感应电场最大不会超过100 V/m,膜电势的波动在1 μV数量级,比热噪声所引起的膜电势波动还要小一个数量级,故磁场间接作用机制可剔除。我们将重点放在磁场直接作用机制上。在极低频弱磁场作用下 ,[Ca2+]i的升高具有频率特异性,即50 Hz有升高而0 Hz和2000 Hz无变化,这似乎与某种谐振理论相吻合。在实验当地,地磁场的垂直分量为38.0 μT,水平分量为28.6 μT,50 Hz与钙离子回旋谐振频率的两倍相近。
膜电势1 μV的波动是无法打开电压门控性离子通道的,因此磁场引起[Ca2+]i升高可能是通过如下两个途径:①影响胞内钙库的细胞器膜,促使Ca2+释放;②增加细胞膜的通透性,使细胞外Ca2+涌入胞内。与有钙液相比,无钙液中的升高较为缓慢,这说明[Ca2+]i的升高部分依赖于外钙内流,部分依赖于钙库释放。
, 百拇医药
本研究证实了一定强度下特定频率的极低频弱磁场能够影响钙离子的跨膜运输和胞内钙库的释放,从而在细胞和分子水平产生生物效应。■
基金项目:国家自然科学基金资助项目(39670194)
参考文献:
[1]Smith JA.Regulatiion of cell proliferation. In:George MP et al Eds. Cell cycle controls, New York:Academic,1974∶43-60
[2]张沪生,叶晖,张晴川等.用电镜观测超低频脉冲磁场对鼠S-180肉瘤的抑制作用.科学通报,1994;39(21)∶2000
[3]Tuffet S, de Seze R, Veyret B. Effect of a strong pulsed magnetic field on the proliferation of tumour cells in vitrol. Bioelectrochemisty and Bionergetics, 1993; 30∶151
, 百拇医药
[4]张小云,刘栋,张晓鄂等.磁场对细胞生长分裂的影响及机制的探讨.中国科学(B辑),1989;19(2)∶164
[5]Mulay IL, Mulay LN. Effect of a magnetic field on sarcoma 37 ascites tumour cells. Nature, 1960; 4780∶1019
[6]Malgaroli A, Milani D, Meldolesi J et al.Fura-2 measurement of cytosolic free Ca2+ in monolayers and suspensions of various types of animal cells. J Cell Biol,1987; 105∶2145
[7]de Seze R, Lahitte A, Moreau JM et al.Generation of extremely-low-frequency magnetic fields with standard available commerical equipment:implications for experimental bioelectromagnetics work. Bioelectrochemistry and Bionenergetics, 1994; 35∶127
, http://www.100md.com
[8]Grykiewiez G, Poenie M, Tsien RY. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem, 1985; 260(6)∶3440
[9]Barbier E, Dufy B, Veyret B. Stimulation of Ca2+ influx in rat pituitary cells under exposure to a 50Hz magnetic field. Bioelectromagnetics, 1996; 17∶303
[10]Reinbold KA, Pollack SR. Serum plays a critical role in modulating [Ca2+]c of primary culture bone cells exposed to weak ion-resonance magnetic fields. Bioelectromagnetics, 1997;18∶203
, 百拇医药
[11]叶晖,林家瑞,叶琴.低频磁场对膜离子通道状态的影响.武汉大学学报(应用物理专刊),1997;6∶217
[12]Borle AB. Control, Modulation and regulation of cell calcium. Rev Physiol, Biochem, 1981; 90∶131
[13]Rasmuss EH, Rarrett PQ. Calcium messenger system. An Integrated Review, 1984; 64∶938
[14]Williamson JR, Cooper RH, Hoek JB. Role of calcium in the hormonal regulation of liver metablism. Biochem Biophys Acta, 1981;639∶243
[15]张沪生,叶晖,张传清等.超低频脉冲磁场抑制癌瘤和提高细胞免疫功能的实验研究.中国科学(C辑),1997;27(2)∶173
收稿日期:1998-09-07, 百拇医药