肿瘤靶向治疗新思路:纳米给药系统
 |
 |
 |
最近数年,肿瘤的药物治疗领域已经发生了巨大的变化,靶向药物的研制、开发及临床应用已经成为人们关注焦点。肿瘤靶向治疗的另一个重要研究领域就是具有肿瘤靶向性的药物载体。该载体能使药物得以在肿瘤局部长效释放并发挥作用。上世纪90年代后期,随着现代生物技术的迅猛发展,肿瘤靶向药物载体研究获得了突破性进展,涌现了免疫靶向载体、受体靶向载体、pH靶向载体、磁靶向载体、酶靶向载体和热靶向载体等多项分支。目前,该领域的一大研究热点为纳米技术和纳米材料结合后所产生的纳米给药系统。纳米药物载体控释系统研究最多、最有应用价值的就是抗肿瘤药物载体。在南京大学医学院附属鼓楼医院肿瘤中心暨南京大学临床肿瘤研究所,笔者领导的研究团队一直致力于将纳米技术与临床实践相结合,开发具有临床应用前景的靶向抗肿瘤纳米给药系统,至今已经取得了可喜的成果。
热靶向载体 热化疗协同效应
热疗是通过加热使肿瘤组织升温达40℃~43℃,引起肿瘤细胞生长受阻、死亡的一种治疗方式。热疗除本身对肿瘤具有一定的杀伤作用外,与化疗联合还可发挥协同抗肿瘤作用。热疗可增加肿瘤组织血流速度和血管渗透性,再加上肿瘤血管发育不全、渗漏性高,肿瘤组织无完整的淋巴系统,因此在加热状态下热靶向多聚物载体的肿瘤组织分布率高。
, http://www.100md.com
近年来,热敏聚合物作为药物载体的靶向性与可行性已获证实,但作者领导的研究小组发现,国外热敏多聚物研究在设计上未考虑人体的热疗温度条件。我们自行设计研制了具有合理稳定低临界溶解温度(LCST)的热敏聚合物。原子力显微镜显示, 我们用合成的热敏聚合物为载体所制备的紫杉醇载药微球在25℃下为分散的圆球形,大小约为80 nm,而在43℃时载体转变为疏水性结构,从而互相积聚并沉淀,证明这一载体具有良好的温敏特性,在低温下亲水而在高温下沉聚。
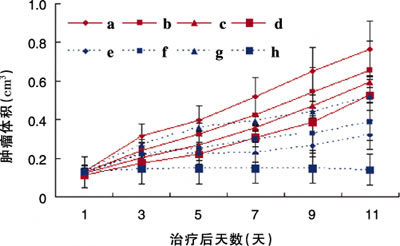
体外细胞实验表明,在未加热状态下,紫杉醇载药纳米微球的细胞生长抑制效果弱于紫杉醇注射液,而在43℃加热30分钟后,紫杉醇载药纳米微球对肿瘤细胞的抑制作用显著增强。体内实验结果表明,紫杉醇载药纳米微球具有良好的抗肿瘤效果,当联合热疗时效果更为优异(图1)。
二亲嵌段高分子聚合物纳米给药系统 高效低毒
在纳米给药系统的研制中,目前最具有应用前景的当属二亲嵌段高分子共聚物,即载体一端为亲水端,一端为疏水端。该聚合物在水相可以自组装成为亲水端向外、疏水端向内的具有核壳结构的纳米级微球,其疏水性内核可以用来存储药物,而亲水性外壳则可赋予其良好的水溶性。
, 百拇医药
作者领导的研究团队在该领域中进行了卓有成效的尝试,目前已经取得了令人兴奋的研究成果。我们选用聚己内酯-聚乙二醇(PCL-PEG)合成二亲嵌段共聚物,并以此作为载体高分子材料制备了顺铂纳米微球。所得到的顺铂纳米微球为不规则的圆形,表面光滑,其粒径小于100 nm。通过调整不同的投料比,测得载药量在5%左右,包封率则超过80%。在最初的5小时内,该微球大约有30%的顺铂释放,而在随后的3天内,总共释放60%左右的顺铂。这样,该微球在体内可通过最初的突释达到一个较高的血药浓度,而随后的长时间释放则为保持一定的有效浓度提供了保证,从而达到长效缓释的抗肿瘤效果。
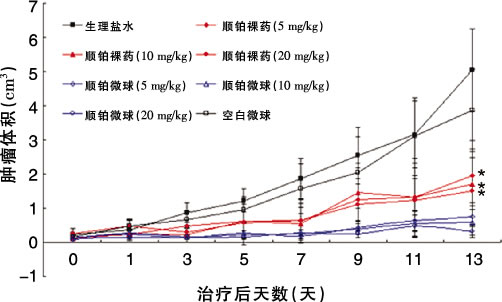
体外实验发现,顺铂微球与裸药顺铂对于人胃癌BGC-823和小鼠肝癌H22细胞系肿瘤细胞的杀伤作用相差不大,且都具有浓度及时间依赖性,空白载药微球则对细胞生长基本无毒性。动物实验支持我们最初的设想,对小鼠肝癌H22细胞系皮下移植瘤模型给予选择性肿瘤局部给药,显示了良好的抑瘤效果。肿瘤局部给予顺铂裸药及顺铂纳米微球均有效抑制了肿瘤生长,顺铂纳米微球显示出更为优越的结果(图2、3)。这可能由于局部给药后,肿瘤部位迅速达到了较高的药物浓度,从而有效地杀伤肿瘤细胞,同时又通过载药纳米微球的缓释作用,使药物浓度在后期能保持在有效杀伤水平,继而达到优于裸药的效果。另外,由于顺铂的肾毒性、消化道毒性、骨髓抑制等副作用限制了其临床应用,而顺铂纳米微球制剂则可以克服裸药治疗所带来的巨大毒副作用。
, http://www.100md.com
药物共同投递技术平台 给药理念的革新
随着药物靶向载体研究的的日益成熟并逐渐走向实际应用,人们发现,如果能够模拟临床肿瘤治疗的联合用药模式,将药物组合后共同进行投递,使药物达到微观水平上的共同、序贯作用,则能够显著提高疗效。
2005年,美国麻省理工学院学者构建了一种新型双层药物投递系统,药物在载体中分两层负载:内层为多柔比星,外层则为一种抗血管生成药物。在肿瘤组织中,抗血管生成药物首先释放,破坏肿瘤组织的血供系统,随后释放的化疗药物就能够聚集在肿瘤组织中并长时间发挥作用,达到良好的效果。此后,美国东北大学学者又构建了将紫杉醇和凋亡信号通路分子神经酰胺(ceramide)通过纳米微球共同投递的系统,体内外实验均证实该系统可以有效逆转肿瘤细胞的耐药性。
在这一理念的基础上,依托南京大学临床肿瘤学研究所对中药抗肿瘤机制的研究成果,我们建立了抗肿瘤药物共同投递的载体平台。我们首先选择被证明具有协同作用的化疗药物和中药单体,然后将其共同包覆于我们研制的新型双层微球载体中,使其得以共同投递到肿瘤部位,发挥协同作用。目前,我们已经研制出顺铂-汉防己甲素双层微球。这种微球的抗肿瘤效果已在细胞水平得到验证,体内疗效验证正在开展。另外,我们发现藤黄酸可逆转肿瘤细胞对多西他赛的耐药性,在此基础上,我们正在构建藤黄酸-多西他赛双层微球。
, 百拇医药
展望
未来高分子药物载体的研究可以在以下方面取得突破。首先,由单一功能向多功能纳米给药系统发展,通过修饰合成高分子材料,引入肿瘤特异性表面分子,负载抗肿瘤药物及造影剂,形成具有诊断、治疗双重效果的靶向纳米给药系统。其次,通过临床前及临床试验,阐明纳米给药系统在体内的一系列独特的药物效应及代谢动力学特点,为纳米制剂走向临床提供依据。
图1 裸鼠皮下移植瘤模型不同给药组的肿瘤生长曲线
(a为生理盐水对照组,e为紫杉醇注射液组,g为紫杉醇载药纳米胶束未联合热疗组,h为紫杉醇载药纳米胶束联合热疗组)
图2 顺铂肿瘤局部给药对小鼠H22皮下移植瘤的治疗效果
图3 小鼠H22皮下移植瘤局部给药后PET/CT扫描结果
(A为生理盐水对照组,B为顺铂裸药治疗组,C为顺铂载药纳米微球治疗组。CT扫描可见顺铂裸药与顺铂载药纳米微球均有效抑制了小鼠左上肢皮下肿瘤的生长,但是PET扫描则显示,在降低肿瘤代谢率方面顺铂载药纳米微球明显降低肿瘤组织代谢率。), http://www.100md.com