叶酸对胃癌前细胞凋亡的影响
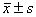 |
曹大中,刘顺英,东南大学附属中大医院消化科 江苏省南京市 210009
赵建学,江苏省中医院消化科 江苏省南京市 210029
铁道部基金资助课题,No. J98Z034
项目负责人:曹大中,210009,江苏省南京市,东南大学附属中大医院消化科.bnj5326447@jlonline.com
收稿日期:2002-10-07 接受日期:2002-10-29
摘要
目的:研究叶酸对胃癌前细胞凋亡的影响.
, 百拇医药
方法:胃镜下活检,病理证实癌前病变患者38例(结肠型肠上皮化生18例和轻、中度非典型增生20例),癌前病变组织经胃蛋白酶消化液消化成单个细胞后,采用PI单染法和AnnexinV FITC/PI双参数染色法用流式细胞仪检测细胞凋亡率.将癌前病变患者随机分为治疗组19例,对照组19例(每组包括结肠型肠上皮化生9例和轻、中度非典型增生 10例),治疗组给予叶酸10mg,3次/d,治疗3mo,对照组给予硫糖铝1.0g,3次/d,治疗3mo,治疗结束后复查组织细胞凋亡率.
结果:治疗组治疗后细胞凋亡率增高(P<0.05),对照组治疗后细胞凋亡率无明显变化(P >0.05).
结论:叶酸具有诱导胃癌前病变细胞凋亡的作用.
, http://www.100md.com
曹大中,刘顺英,赵建学.叶酸对胃癌前细胞凋亡的影响.世界华人消化杂志 2003;11(6):846-848
0 引言胃癌癌前病变(包括胃黏膜肠化与不典型增生)是容易发展为胃癌的胃黏膜病理变化,其转化与逆转近年来渐受关注,对此进行研究,不仅有利于明确胃癌的发生规律,而且对胃癌的早期诊断及干预胃癌发生药物的选择均有重要临床意义.叶酸与癌前病变的关系也是目前较受关注的问题之一.有研究提示叶酸治疗对萎缩性胃炎具有逆转作用[1],也有研究提示叶酸治疗可以影响胃癌组织细胞的凋亡[2].我们的研究目的主要是观察叶酸治疗对胃癌前病变组织细胞凋亡的影响.
1 材料和方法
1.1 材料 标本均由东南大学附属中大医院胃镜室1999-10/2000-12胃镜检查时采集,并经病理证实.取材部位为胃窦距幽门2cm处,共选择胃癌癌前病变病例38例(结肠型肠上皮化生18例,轻、中度非典型增生20例).叶酸为常州制药厂生产,每片5mg. 5 g/L胃蛋白酶由华美公司生产.Triton-X-100由美国进口分装.Annexin V FITC/PI kit 系法国IMMUNOTECH公司产品.流式细胞仪(flowcytometry,FCM),型号FACSCalibur,美国B-D公司.
, http://www.100md.com
1.2方法
1.2.1 流式细胞仪检测细胞凋亡 将癌前病变组织加入已配制的pH1.5含5g/L胃蛋白酶4mL的蛋白消化液中,37°C孵育30 min,消化期间,每隔5min悬浮振荡1次,消化后加入生理盐水10mL终止消化,1500 rpm×5 min,以300目筛网滤除未消化的组织碎片,弃上清,再加5mL生理盐水漂洗2次,红细胞计数板计数,加入冰冷的700mL/L乙醇调整细胞密度为107-109/L并固定.(1)流式细胞仪检测细胞DNA倍体及细胞增生周期:取上述细胞液800rpm×5 min,弃上清,加入冰冷的0.1mol/L PBS液洗涤,800rpm×5 min,弃上清,加10g/L Triton-X-100摇匀后静置10min,1 500 rpm×5min,弃上清.加0.1 g/L RNA酶消化10min,1 500 rpm×5min,弃上清.加0.05 g/L PI染色15min,用300目丝网过滤后即可上机分析.CellQuest软件采集样本后,用ModfitLT软件进行分析.(2) 流式细胞仪双染法检测细胞凋亡:取上述细胞液4°C 500 rpm×5 min,弃上清,加入冰冷的0.1mol/L PBS液洗涤,4°C 500 rpm×5 min,弃上清,加结合缓冲液至细胞为105-106/mL,取上述细胞液490mL,加入5mL已稀释AnnexinVFITC溶液和5 mL已溶解的PI,轻轻振动,4°C避光孵育10min,上机检测,每份样本计数10000个细胞.
, 百拇医药
1.2.2 分组 将38例癌前病变患者随机分为治疗组和对照组各19例(每组含胃黏膜结肠型肠上皮化生9例和轻、中度非典型增生10例),治疗组男13例,女6例,年龄50±7岁.对照组男14例,女5例,年龄49±9岁.治疗组给予叶酸10mg ,3次/d×3mo,对照组给予黏膜保护剂硫糖铝1.0g,3次/d×3mo,复查组织细胞凋亡的变化,进行统计学处理(复查时依据治疗前取活组织时的录相准确定位).
统计学处理 分组实验比较采用t检验计算,以P <0.05为差异有统计学意义.
2 结果
2.1 流式细胞仪PI单染法检测细胞凋亡 凋亡细胞DNA荧光强度降低,DNA组方图显示,在G0/G1峰前出现一个小于DNA二倍体含量的小峰,即亚二倍体峰,又称细胞凋亡峰(AP峰),根据AP峰面积可直接分析得出凋亡细胞的百分率.统计结果见表1.
, http://www.100md.com
表1 流式细胞仪单染法检测治疗前后细胞凋亡率AI()
| 分组 | 治疗前 | 治疗后 | |
| 治疗组 | 轻中度胃黏膜非典型增生组 | 6.19±2.82 | 6.78±2.15a |
| 结肠型肠上皮化生组 | 6.17±2.39 | 6.74±2.21a | |
| 对照组 | 轻中度胃黏膜非典型增生组 | 6.27±3.24 | 6.23±2.70b |
| 结肠型肠上皮化生组 | 6.24±2.29 | 6.17±3.17b |
aP<0.01, bP >0.05 vs 相应治疗前.
, 百拇医药
2.2 流式细胞仪双染法检测细胞凋亡 表2.
表2 流式细胞仪双染法检测治疗前后细胞凋亡AI()
| 分组 | 治疗前 | 治疗后 | |
| 治疗组 | 轻中度胃黏膜非典型增生组 | 16.22±3.801 | 21.00±4.610a |
| 结肠型肠上皮化生组 | 16.84±2.805 | 21.87±4.823a | |
| 对照组 | 轻中度胃黏膜非典型增生组 | 15.1±2.52 | 15.7±2.56b |
| 结肠型肠上皮化生组 | 14.9±2.59 | 15.0±2.44b |
, 百拇医药
aP<0.05 ,bP>0.05 vs 相应治疗前.
3 讨论细胞凋亡是细胞分化与发育过程中,受一系列基因调控而发生的具有特征性形态和生化改变的细胞死亡过程,正常情况下,其与细胞增生基本保持衡定,以维持机体的相对稳定.正常胃黏膜中,凋亡细胞位于黏膜表层,形成“凋亡细胞带”,增生细胞位于小凹腺颈部,形成“增生细胞带”.这种分布特点反映了胃黏膜上皮自腺颈部向表层逐渐成熟、衰老、死亡的过程[3,4].胃癌及癌前病变存在着细胞增生和凋亡的失调[5].目前认为从慢性浅表性胃炎、萎缩性胃炎、肠上皮化生及不典型增生到胃癌的发展过程是肠型胃癌发生的基本规律[4].胃黏膜细胞凋亡减少,生成期延长,细胞大量堆积是胃癌发生的病理基础.胃黏膜细胞病变从轻度不典型增生、重度不典型增生、早期胃癌到进展期胃癌,细胞凋亡逐渐受到抑制,细胞凋亡受抑制越明显,恶性程度越高[6].因此抑制细胞过度增生、促进细胞凋亡是防止胃黏膜癌变的一种重要方法.胃癌发生过程中有血清叶酸水平降低.叶酸干预慢性萎缩性胃炎患者半年后,其萎缩、肠化和炎症均有明显改善[7].叶酸对胃癌细胞凋亡的实验研究显示,叶酸对胃癌细胞有明显的促凋亡作用[2].
, 百拇医药
本研究采用流式细胞仪单染法及双参数染色法检测细胞凋亡,虽其结果不同,但是经叶酸治疗后,胃癌前病变细胞凋亡率均明显增加,而对照组无明显变化,表明叶酸治疗对胃癌前病变胃黏膜细胞的凋亡有明显的促进作用.这与既往的叶酸对萎缩性胃炎具有逆转作用的报道在一定程度上是相符的[1],这为我们使用叶酸防止胃癌前病变向胃癌转变进一步提供了依据.但是其作用机制及部位尚不明确.既往的研究认为叶酸防止肿瘤的机制包括维持DNA甲基化状态[8]和抑制鸟氨酸脱羧酶[9]的活性,而叶酸干预细胞凋亡与上述机制有何内在联系尚不清楚.
DNA甲基化的生物学意义在于对基因表达的限制,甲基可关闭基因复活的开关,叶酸主要是参与供甲基过程以维持DNA甲基化状态.已知细胞凋亡与许多癌基因的表达密切相关,凋亡基因家族(bcl-2[10],bax[11],c-myc[12],Fas[13],FasL[14]等)的异常-激活凋亡基因的丢失或抑制凋亡基因的过度表达,都可导致凋亡与增生的平衡破坏.有研究发现羟基喜树碱诱导胃癌细胞凋亡时有p53和bcl-2基因的蛋白和mRNA表达下调[15].那么,叶酸与凋亡基因关系如何?即叶酸能否通过对DNA甲基化的影响而改变凋亡基因的表达,从而影响胃癌癌前状态细胞凋亡,并且叶酸是否还会通过其他途径而影响细胞凋亡,有待于我们今后进一步深入研究.
, http://www.100md.com
4 参考文献1 周连鸿,施尧,江绍基,萧树东,吴裕炘,吴云林,袁耀宗,翟祖康,王秀玲,宗春华,马菊珍,汪敏,鲍继桂,张金龙.叶酸及硒酵
母对慢性胃炎的萎缩、肠化及非典型增生的疗效观察.中华消化杂志 1993;13:217-219
2 房静远,萧树东,童菊芳,陈向荣.叶酸对胃癌细胞凋亡的影响.中华消化杂志 1999;19:79-81
3 Correa P.Helicobacter pylori and gastric carcinogenesis. Am J Surg Pathol 1995;19(Suppl 1):S37-43
4 Fuchs CS, MagerRJ. Gastric carcinoma. New Engl J Med 1995;333:32-41
, http://www.100md.com
5 郭玉庆,朱兆华,黎锦芳.流式细胞术分析胃癌及癌前病变中细胞凋亡与增生.世界华人消化杂志 2000;8:983-987
6 许岸高,李韶光,刘集鸿,浓剑刚,姜泊,甘爱华.胃癌癌前病变演化与细胞凋亡增生的关系.中华医学杂志 1999;79:185-186
7 房静远,朱舜时,萧树东,李蓉蓉,施尧,江绍基,周怡和,夏德凰,金冠球,谢宇野.叶酸阻断胃癌机制的初步研究.中华医
学杂志 1997;77:546-547
8 Fang JY, Xiao SD,Zhu SS, Yuan TM, Qiu DK, Jiang SJ. Relationship of plasma folic acid andstatus of DNA methylation
, 百拇医药
in human gastric cancer. J Gastroenterol 1997;32:171-175
9 Nensey YM, ArlowFL, Majumdar AP. Aging increased responsiveness of colorectal mucosa toCarcinogen stimulation
and protective role of folic acid. Dig DisSci 1995;40:396-404
10 刘海峰,刘为纹,房殿春,门荣甫.bcl-2蛋白在胃癌组织中的表达和意义.肿瘤防治研究 1997;24:269
11 刘海峰,刘为纹,房殿春,杨仕明,汪荣春.胃癌前组织和胃癌中Bax基因表达及其与细胞凋亡的关系.世界华人消化
, 百拇医药
杂志2000;8:665-668
12 李雪莉,郝远瑞,邹建湘,杨金花,耿建华.C-myc,Bcl-2与胃癌生物学行为和细胞凋亡.世界华人消化杂志 1997;5:773-774
13 刘海峰,刘为纹,房殿春,门荣甫.Fas抗原在胃癌组织中的表达及其与细胞凋亡的关系.第三军医大学学抱 1998;20:9
14 刘海峰,刘为纹,房殿春,门荣甫,王振华.胃癌前病变及胃癌中细胞凋亡及其与FasL表达的关系.世界华人消化
杂志 1999;7:561-563
15 涂水平,江石湖,谭继宏,钟捷,乔敏敏,蒋晓华,章永平,袁耀宗,吴云林,吴裕炘.羟基喜树碱诱导胃癌细胞凋亡的作用机制
初步研究. 中华消化杂志 2001;21:274-277, http://www.100md.com
