 |
 |
关键词:血管紧张素转换酶;基因多态性;糖尿病肾病
摘要:应用PCR扩增方法检测203例NIDDM患者和165例正常对照者血管紧张素(ACE)基因的16内含子中287bp片段缺失/插入多态性。结果显示,糖尿病肾病患者组ACE基因缺失纯合型(DD)频率明显高于非肾病组和正常对照组,P<0.001;DD缺失纯合型患者肾病进展速度明显快于缺失/插入(DI)杂合型及插入/插入(II)纯合型糖尿病患者,P<0.01。表明ACE基因缺失纯合型是糖尿病肾病的独立危险因素之一,并可作为NIDDM肾病发生发展的有效预测指标。
中图分类号 :R587.2 文献标识码 :A
文章编号:1001-6325(2000)05-0027-03
Associationof DD genotype of ACE gene with diabetic nephropathy
CHEN Shu-je,ZHOU Zhe,CHEN Mong-zhi,et al
( Institute of Basic Medical Sciences ,Chinese Academy of Medical Sciences ,Beijing 100005,China)
Abstract :To investigate the association of deletion/insertion polymorphismthe onset and of angiotensin converting enzyme(ACE) gene with diabetic nephropathy in NIDDM. A case-control study was carried out in 203 NIDDM patients(109 with DN,94 without DN)and 216 control subjects.The287bp deletion/insertion polymorphism of ACE gene was deleted by polymerase chain reaction (PCR).DDgenotype frequencies were significantly increased in DN group than that in the groupwithout DN and controls, DN v.s control,P<0.001;DN v.s NDN,P<0.01,respectivityconclusion the DD genotype of ACE gene might be an independent risk factor for the onsetand procession of diabetic nephropathy in chinese Han's NIDDM patients.
Key words: Angiotensin converting enzyme;gene polymorphism; diabetic nephropathy
糖尿病肾病(Diabetic Nephropathy,DN)是糖尿病患者常见的严重合并症之一。目前尚未完全阐明其发病机理。近年来,某些研究资料表明糖尿病肾病与遗传因素有关[1] ,为从基因水平探索糖尿病肾病发病机理提供了可能性。
肾素-血管紧张素系统(RAS)参与血压和局部组织体液平衡的调节作用。大量研究已证明该系统可能参与高血压和糖尿病肾病的发病过程[2,3] 。据报道,血管紧张素在肾脏也有调控细胞生长和间质产生的作用[4] 。推测该作用可能与体液平衡效应一起,在引发和加速肾病发生发展中起作用。肾素-血管紧张素系统,特别是其中ACE基因第16内含子中287bp片段的插入/缺失多态性与ACE活性水平相关联,由此提高机体对外源血管紧张素I的反应性,从而导致IgA肾病和糖尿病肾病[4~8] 。
本文旨在观察ACE基因多态性是否参与汉族2型糖尿病肾病发病并影响其发展速度。以期为糖尿病肾病发病前诊断和预防提供科学依据及有效方法。
1 材料和方法
1.1 病例选择
按1985年WHO规定的糖尿病诊断标准,从抚顺市中心医院和唐山市工人医院门诊及住院患者中选择203例2型糖尿病患者,男98例,女105例,平均年龄57.6±10.8岁,病程7.6±2.3年。参照Mogensen等[8] 糖尿病肾病诊断标准,将203例2型糖尿病患者分为肾病组(DN)109例和非肾病组(NDN)94例。正常对照组165例,男80例、女85例,平均年龄51.3±14.2岁,均为体检正常者,并排除糖尿病、高血压病、冠心病及肾病家族史。
1.2 基因分型
1.2.1基因组DNA提取 取外周血5mL,用2%EDTA-Na2 抗凝(v:v=10:1),低渗破红细胞。酚/仿法从白细胞中提取基因组DNA,A260:A280≥1.8[9] 。
1.2.2 PCR扩增反应 ACE基因16内含子引物序列同文献[5] 。反应体系25mL,含正(P1)反向(P2)引物各4pmol,5x缓冲液5mL,DNA 0.05~0.1mg,4种dNTP 各125pmol ,Taq DNA聚合酶0.5单位,混匀,表面覆盖液体石蜡。94℃预变性2min,然后按94℃变性1min,58℃退火2 min,72℃延伸1.5min的程序循环30次,72℃再延伸5 min。
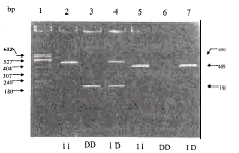
1.2.3 基因型鉴定 PCR产物用2%的琼脂糖凝胶(含0.5mg/L溴化乙啶),在100V电压下泳动20min。紫外灯下观察结果并确定基因型别。
只显现490bp或190bp一条区带者为ACE基因插入纯合型(I/I)或ACE基因缺失纯合型(D/D);而490bp和190bp两条区带均显现者,则为ACE基因插入/缺失杂合型(I/D)。
1.3 统计学分析
应用Stata统计,计算各组ACE插入/缺失等位基因及基因型频率,确认其符合Hardy-Weinberg平衡。组间频率比较用x2检验,均数比较用t检验。
2 结果
2.1 对照组、肾病组和非肾病组临床特征及生化指标(表1)
2.2 对照组、肾病组和非肾病组ACE等位基因及基因型频率
ACE基因16内含子中287bp片段插入/缺失多态性电泳结果如图1。肾病组ACE的DD纯合基因型及等位基因频率明显高于非肾病组和对照组(见表2)。
表1 对照组NDN 和DN 组临床参数
Table 1 Clinical Parameters of Control,NDN and DN groups (±s)
| Parameter | Control(165) | NDN(94) | DN(109) |
| BMI(kg/m2 ) | 22.8±2.4 | 26.0±2.5 | 24.8±2.0 |
| HbAic(%) | 4.1±1.5 | 12.8±2.1* | 13.9±1.7* |
| UAER(mg/min) | 7.5±3.6 | 10.8±5.4* | 155.5±25.0** |
| Serumcreatinine(mmol/L) | 58.0±11.3 | 69.7±15.3 | 197.3±70.2*** |
| Cholesterol(mmol/L) | 4.20±0.68 | 4.89±1.10 | 5.54±1.21 |
| Highdensitylipoprotein | 1.10±0.41 | 1.75±1.0 | 1.75±1.10 |
| (mmol/L) | 1.42±0.40 | 1.30±0.42 | 1.42±0.50 |
表2 对照组与NDN DN 组ACE等位基因和基因型频率
Table 2 Genotype and allele frequencies of I/D
polymorphism of the ACE gene among Control,
NDN and DN groups
| Control(165) | NDN(94) | DN(109) | |
| Alleles(%) | |||
| D | 130(39.3) | 66(35.5) | 123(56.4) |
| 1 | 200(60.7) | 122(64.5) | 95(43.6) |
| Genotypes(%) | |||
| DD | 26(15.7) | 17(18) | 37(34) |
| ID | 78(47.3) | 32(34) | 44(40) |
| II | 61(37.0) | 45(48) | 28(26) |
图 1 PCR 产物电泳图谱
Fig 1 Determination of ACE gene genotypes by PCR .
An example of three genotypes (II,ID,DD)was shown on an ethidium
bromide stained gel after running PCR products amplified using
5'flanking primer (5'F primer,lane 2-4)and 5'insertion-specific primer
(5'primer,lane5-7).The first lane shows size maker (pBR322/Msp
I).The numbers of the left indicated the size of PCR products.
2.3 ACE的缺失纯合基因型DD是肾病发病的独立危险因子之一
如表2结果,109例肾病患者中81例携带D等位基因,占患者总数74%。灵敏性分析结果表明,携带D等位基因的2型糖尿病患者合并肾病相对危险性较携带I等位基因者明显增加,其优势比(oddsratio,OR)为2.70, 95%可信区间为0.95~1.58。
ACE基因型与糖尿病肾病进展相关分析结果显示,DD、DI、II基因型糖尿病患者发生肾病的平均病程分别为4.42±2.83,6.49±4.96和9.10±4.09年。DD基因型合并肾病进程明显快于DI和II患者,P<0.01。
3 讨论
3.1 血管紧张素转换酶(ACE)基因在糖尿病肾病发病中的可能作用
NIDDM系多基因多因素引起的复杂疾病。据报告,10%~20%的NIDDM患者可合并肾病[8] 。近年来的研究表明肾病患者的NIDDM同胞与其有相似的肾脏病理损伤,说明肾病也有明显遗传倾向[6] 。因此,遗传因素在肾病发病中的作用倍受关注。1994年Marre等[5] 发现白种人血管紧张素转换酶(ACE)基因缺失/插入多态性与其血清ACE活性水平及1型糖尿病肾病相关联。此后,Schmidt[6] 又报道在进行血液透析的NIDDM肾病患者中ACE基因DD纯合基因型频率明显增高。临床研究也证明ACE抑制剂可减轻肾病患者尿蛋白排出和延缓肾功能进行性减退[7] 。提示ACE可能参与肾病发病,但也有不同的报告[10] 。
本文结果显示,正常对照组汉族人群ACE插入/缺失等位基因频率与朝鲜人、日本人基本一致,而不同于白种人,表现出明显种族差异。肾病组ACE缺失纯合基因型频率较非肾病组明显升高。而基因型与ACE活性水平呈正相关,说明ACE活性增高参与了肾病发病。关于ACE活性水平影响肾病发生机制,推测可能是通过加速血管紧张素II生成和缓激肽失活而调节出入球小动脉收缩,增高球内压;刺激微血管增殖,使细胞外基质增多,导致肾小球和近曲小管细胞肥大,以及增加系膜大分子物质摄取并延缓其清除,从而引起肾脏病变[5] 。
3.2 ACE分型的临床意义
糖尿病肾病是糖尿病患者常见而严重的合并症。目前,国内外尚无有效地防止糖尿病肾病发生发展的方法。因此,寻找和建立有效的糖尿病肾病风险预测和发病前诊断技术,在临床上具有重要实用价值。本文结果证明ACE的D等位基因与糖尿病肾病正相关,其OR值与文献[7] 报道相似。值得提及的是本文作者又研究了ACE基因型与糖尿病肾病进展的关系。发现DD纯合基因型与糖尿病肾病发展速度密切相关,DD型别的糖尿病患者合并肾病的进展速度明显快于ID和型患者。因此,将ACE基因多态性分析作为预测糖尿病肾病发生发展的分子生物学标志,可能具有重要的临床实用价值。
基金项目:国家自然科学基金(39670693,39870687)
参考文献:
[1] Trevisan B,Viberti G. Genetic factors in the development ofdiabetic nephropathy[J]. J Lab Clin Med, 1995,126:342.
[2] Davission RL, Kim HS, Krege JH, et al. Complementation of reduced survival,hypertension and renal abnormalities in angiotensinogen-deficient mice by the human renninand human angiotensinogen genes[J]. J Clin Invest, 1997,99:1258-1264.
[3] Cervenka L, Wang CT, Navar LG. Effects of acute AT1 receptor blockade bycandesartan on arterial pressure and renal function in rats[J]. Am J Physiol, 1998,274:F940-F945.
[4] Navar LG,Inscho EW,Majid DSA,et al. Paracrine reequlation of the renalmicrocirculation[J]. Physiol Rev,1996,76: 425-536.
[5] Marre M, Bernadet P, Gallois Y, et al. Relationship between angiotensinI-converting enzyme gene polymorphism, plasma levels,and diabetic retinal and renalcomplications[J]. Diabetes,1994,43:384-388.
[6] Schmidt S,Strozek K,Grzeszak W,et al.Excess of DD homozygous inhaemo-dialysed patients with type II diabetes[J]. Nephrol Dial Transplant,1997,12:427-429.
[7] Laffel LMB, Mcgill JB, Gans DJ. The beneficial effect of angiotensin-converting enzyme inhibition with coploprilon on diabetic nephropathy innormotensive IDDM patients with microalbuminuria[J].Am J Med,1995,99:497-502.
[8] Mogensen CE,Christensen.Predicting diabetic nephropathy in insulin-dependentpatients[J].New Eng Med,1984,311:89~93.
[9] Liu Y(刘英), Qiu CC(邱长春), Zhou WY(周文郁), et al. Genepolymorphism of the renin-angiotensin system in essential hypertension[J].ChineseMedical Journal,1999,122:115-120.
[10] Cosmo SD, Margaglione M, Tassi V, et al. ACE, PAI-1, Decorin andwerner helicase genes are not associated with the development of renal disease in europeanpatients with type I diabetes[J]. Diabetes Metab Rcs,1999,15:247-253.
收稿日期:2000=04-12 修回日期:2000-05-18 , http://www.100md.com