 |
关键词:移植;肾;免疫抑制剂
摘要 目的 观察环孢素A(CsA)、霉酚酸(MPA)和雷帕霉素(RPM)对CD28 通路共刺激后淋巴细胞IL-4mRNA表达的影响。 方法 以PCR扩增方法获得IL-4特异的cDNA片段,并将其克隆至PGEM-3Z载体中。以此作为探针对RT-PCR产物进行杂交定量,比较三种免疫抑制剂对CD28 通路共刺激后淋巴细胞IL-4mRNA表达的影响。 结果 以抗CD3 mAb+抗CD28 mAb共刺激后,发现淋巴细胞稳定地表达IL-4mRNA;CsA和MPA未能抑制淋巴细胞IL-4 mRNA的表达,而RPM则能产生显著抑制。 结论 RPM能抑制CD28 通路共刺激后IL-4mRNA的表达,而CsA和MPA对这一过程无抑制作用。
The effect of CsA、 MPA and RPM on IL-4 mRNAexpression of CD28 costimulated lymphocytes
ZHOU Peijun,WANGXianghui,TANG Xiaoda,et al.
Center of Renal Transplantation,Shanghai First People's Hospital,Shanghai 200080
Abstract Objective To evaluate theeffect of CsA、MPA and RPM on IL-4 mRNA expression of CD28 costimulatedlymphocytes. Methods A specific segment of IL-4 cDNA,obtained by means of RT-PCR,wasinserted into PGEM-3Z vector,and the insertion was confirmed by DNA senquencing.This probewas used to detect the level of IL-4 mRNA expression in CD28 -costimulatedlymphocytes under the suppression of CsA,macophenolic acid,and rapamycin. Results Itwas found that IL-4 mRNA expression was markedly suppressed by rapamycin,but not by CsAand macophenolic acid. Conclusions Rapamycine has suppressive effect on this Ca2+ -independentCD28 pathway.In this regard,rapamycine is unique to be used as animmunosuppressive drug.
Key words Transplantation Kidney Immunosuppressive agents
白介素4(IL-4)是一种由Ⅱ型辅助性T细胞(Th2)产生的细胞因子。在移植免疫研究中,Th2细胞的代表性因子受到广泛重视。本研究以PCR扩增方法获得了一段IL-4特异的cDNA片段,并将其克隆至PGEM-3Z载体中。以此作为探针对RT-PCR产物进行杂交定量,比较环孢素A(CsA)、霉酚酸(MPA)和雷帕霉素(RPM)对CD28 通路共刺激后淋巴细胞IL-4mRNA表达的影响。
材料和方法
一、主要试剂
鼠抗人CD3 mAb和鼠抗人CD28 mAb分别购自Dako公司和Becton-Dickinson公司,CsA为Sandoz公司产品,MPA和RPM均为Sigma公司产品。TRIzol和MMLV逆转录酶购自Gibco公司。六聚体随机引物和PGEM-3Z载体购自Promega公司。[α-32 P]dATP和[γ-32 P]ATP购自Dupont公司。PstI、EcoRI和JM-109大肠杆菌购自华美公司。DNA循环测序试剂盒、探针标记试剂盒购自Amersham公司。
二、淋巴细胞分离培养
采用密度梯度离心法分离外周血单个核细胞。以RPMI 1640完全培养液培养,细胞浓度为1×106 个/ml。培养液中加入抗CD3 mAb 500μg/L和抗CD28 mAb 1mg/L共刺激;置37℃培养箱(含5%CO2 ),24小时后收集细胞[1] 。
另设三组,培养液中加入CsA、MPA和RPM,三种免疫抑制剂的终浓度分别为400μg/L、300μg/L和300μg/L,培养6小时和24小时后收集细胞。
三、淋巴细胞总RNA的提取
收集培养细胞,移入1.5ml Eppendorf管,加TRIzol试剂0.8ml。氯仿、异丙醇抽提,75%乙醇洗涤。RNA沉淀空气干燥后,重悬于无RNase水中,分光光度计定量。-70℃冰箱保存备用。
四、RT-PCR扩增IL-4 mRNA
取1μg RNA,采用MMLV逆转录酶,总反应体积20μl进行cDNA第一链的合成。反应产物稀释至100μl,置于-20℃冰箱保存。
PCR总反应体积为50μl,加入cDNA 10μl。IL-4 PCR扩增的引物序列为:5′-端:CGGCAACTTTGACCACGGACACAAGTGCGATA;3′-端:ACGTACTCTGGTTGGCTTCCTTCACAGGA
CAG,扩增片段长度为344bp。循环参数:94℃预变性5分钟;变性:94℃/45秒;退火:55℃/45秒;延伸:72℃/2分钟。共35次循环,最后72℃保温5分钟。琼脂糖凝胶电泳显示344bp扩增条带。
五、IL-4扩增片段的克隆
分子克隆的全过程均规范进行[2] 。对纯化后的PCR产物和PGEM-3Z载体进行EcoRⅠ、PstⅠ双酶切,于37℃反应2小时。PCR产物的酶切片段长度为150bp。以1.5%低熔点胶对酶切产物电泳分离,切取含有所需DNA片段的凝胶块;纯化酶切产物。T4 DNA连接酶进行连接反应,制备JM109大肠杆菌感受态、重组质粒转化。酶切筛选含重组质粒的阳性克隆,经培养后大量抽提质粒。采用DNA循环测序试剂盒,进行DNA序列测定。
六、IL-4探针制备和点杂交
重组质粒以EcoRⅠ和PstⅠ双酶切后,低熔点胶回收并纯化所插入150bpDNA片段。取经过纯化的DNA约15ng作同位素探针标记。随机引物法标记IL-4探针,对IL-4的RT-PCR扩增产物作点杂交,-80℃放射性自显影12小时。扫描定量,比较CsA、MPA和RPM对刺激后IL-4mRNA表达的抑制作用。
结 果
一、IL-4基因片段的克隆
通过PCR扩增出一段IL-4基因的特异片段。将长度为150bp的酶切片段插入PGEM-3Z载体,经EcoRⅠ和PstⅠ双酶切鉴定,插入片段长度正确。
二、DNA序列测定
所插入DNA片段的测序结果:GGGCTTGC
GACTGTGCTCCGGCAGTTCTACAGCCACCATG
AGAGGGACACTCGCTGCCTGGGTGCGACTGCA
CAGCAGTTCCACAGGCACAAGCAGCTGATCCG
ATTCCTGAAACGGCTCGACAGGAACCTCTGGG
GCCTGGCGGGCTTG。以上序列与已发表的IL-4 cDNA序列一致。
三、点杂交结果
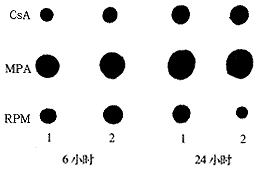
以抗CD3 mAb+抗CD28 mAb共刺激后,发现淋巴细胞稳定地表达IL-4mRNA。在共刺激后培养6小时和24小时,CsA和MPA未能抑制淋巴细胞IL-4mRNA的表达;而RPM则能对IL-4 mRNA表达产生显著抑制(图1),以培养24小时明显,抑制程度达4~5倍。
图1 RT-PCR检测共刺激后IL-4mRNA表达的点杂交结果:
1.共刺激无免疫抑制剂;2.共刺激加入免疫抑制剂
讨 论
CD4 +Th细胞与抗原递呈细胞相互作用时,至少需要两种刺激信号,T细胞才能充分活化增殖。T细胞通过CD3 -TCR与外来抗原+MHCⅡ类分子复合物相结合产生信号1;抗原递呈细胞表面B7 与T细胞表面CD28 分子结合而提供共刺激信号2。共刺激信号在T细胞的活化增殖过程中起着十分关键的作用,决定T细胞是否发生克隆增殖反应或者进入免疫无反应状态。在免疫耐受的诱导以及排斥反应的防治中,这一T细胞活化CD28 通路已经引起重视。
本研究从体外培养淋巴细胞提取总RNA,采用RT-PCR方法扩增获得IL-4特异的cDNA片段,并将其中150bp长的酶切片段克隆至PGEM-3Z载体中。经DNA测序证实,重组质粒中含有符合预期设计的插入片段。再以此作为探针,对RT-PCR产物进行点杂交,定量分析CsA、MPA和RPM对CD28 通路共刺激后淋巴细胞IL-4mRNA表达的影响。杂交信号强,扫描定量结果满意。
CsA作为一种基础免疫抑制剂,在临床广泛使用。本研究发现CsA对CD28 通路共刺激后淋巴细胞IL-4mRNA的表达无明显抑制作用,与文献结果一致[1] 。
近年来在器官移植临床开始使用的新型免疫抑制剂霉酚酸酯(MMF),是MPA的一种2-乙基酯类衍生物。MPA是高效、选择性、非竞争性和可逆性的次黄嘌呤单核苷酸脱氢酶(IMPDH)抑制剂,可抑制鸟嘌呤核苷酸的经典合成途径,对排斥反应的预防和难治性排斥反应的治疗有效。以往研究表明,MPA对淋巴细胞活化后的早期信号传导系统无影响,MPA不能抑制淋巴细胞活化后IL-2、IL-4和IL-13的产生[3] 。本研究发现,MPA在浓度为300μg/L时,对CD28 共刺激后IL-4mRNA的表达无抑制作用。MPA对CD28 共刺激后其它免疫活化基因表达的影响,有待深入研究。
RPM属大环内酯类抗生素,其结构与FK-560相似。CsA和FK-506主要抑制活化早期的淋巴细胞G0 期~G1 期的转化;而RPM主要抑制细胞增殖周期中淋巴细胞G1 期~S期的转化过程[4] 。RPM和FK-560的细胞内受体蛋白相同,均为FKBP。对酵母的研究表明:RPM-FKBP的直接靶分子为TOR(targetsof rapamycin),推测RPM-FKBP在T细胞内的靶分子可能是TOR的同源物[5] 。RPM可抑制IL-2/IL-2R结合后的细胞内信号传导通路,通过抑制细胞因子诱导下淋巴细胞的蛋白质和DNA的合成过程,发挥免疫抑制效应。因而RPM不干扰T细胞活化早期的信号产生,并且RPM对淋巴细胞产生细胞因子过程的抑制,也不如CsA和FK-506那样有效。
本研究结果证实,RPM对CD28 通路共刺激后淋巴细胞IL-4 mRNA的表达,可产生明显的抑制作用。研究结果表明:尽管具体的作用环节尚不清楚,RPM能够对CD28 信号传导通路产生抑制;而目前在器官移植临床已被采用的多种免疫抑制剂,均不具备这一作用。RPM已进入临床试验阶段,对其免疫抑制效应的观察尚在进行中。如果仅就免疫抑制剂对T细胞活化CD28 通路的影响而言,RPM的作用无疑是独特的。
IL-4基因探针的克隆,丰富了移植免疫的研究手段。对RT-PCR产物的杂交定量研究,已初步显示其应用价值。该探针可用于对多种临床和实验标本进行分子杂交。对CsA、MPA和RPM的比较研究则发现,RPM能抑制CD28 通路共刺激后IL-4mRNA的表达,而CsA和MPA对这一过程无抑制作用。
本课题受国家自然科学基金(39570731)及Novartis移植科研基金资助
参考文献
1 周佩军,唐孝达,王祥慧,等.环孢素A对T细胞活化CD28 通路的影响.中华器官移植杂志,1998,19∶113-115.
2 萨姆布鲁克,弗里奇,曼尼阿蒂斯主编.金冬雁,等译.分子克隆实验指南.第2版.北京:科学出版社,1992,343-350.
3 Lemster B,Woo J,Wang SC,et al.Cytokine gene expression in murine lymphocytes activatedin the presence of FK-560,bredinin,mycophenolic acid,or brequinar sodim.TransplantProc,1992,24∶2845-2847.
4 Morris R.Mechanisms of action of new immunosuppressive drugs.Kidney Int,1996,49∶S26-31.
5 Brown E,Albers MW,Shin TB,et al.A mammalian protein targeted by G1 -arrestingrapamycin receptor complex.Nature,1994,369∶756-757.
收稿:1998-12-23
修回:1999-05-24, 百拇医药