关键词:Epstein-Barr病毒;病毒抗原;血清学诊断;酶联免疫吸附测定
【摘要】 目的 研制epstein-Barr(EB)病毒诊断试剂。方法 将重组痘苗病毒表达的Epstein-Barr病毒(EBV)壳抗原(VCA)主要多肽gp125纯化,作为诊断抗原建立了酶联免疫吸附试验(ELISA),检测了48份鼻咽癌(NPC)病人血清及10份正常人血清中的VCA/IgA抗体。结果 该方法与免疫荧光(IF)检测结果一致,但ELISA的平均几何滴度(GMT)是IF的12倍。结论 以纯化的EB病毒壳抗原主要多肽gp125作为诊断抗原建立的检测方法,更适合于EBV相关疾病的血清学诊断和血清流行病学调查。
The purification and application of Epstein-Barr virus gp125 Wang Guimin,Pi Guohua,Gu Shuyan. Institute of Virology,Chinese Academy of Preventive Medicine,Beijing 100052
Abstract Epstein-Barr virus (EBV)virion capsid antigen (VCA)gp125 as a diagnostic antigen was expressed in infected cells by recombinant vaccinia virus. The presence of IgA antibody to VCA of EBV was tested by ELISA in sera from nasopharyngeal carcinoma (NPC) patients and normal individuals. The ELISA consisted of three steps involving test serum,mouse monoclonal antibody to human IgA and rabbit anti-mouse IgG.The antibody titers of sera determined by this way correlated well with those by IF.The GMT by ELISA was 12 times higher than that by IF.Furthermore,efforts to develop gold-conjugated immunosorbent assay (GCISA),which is a more sensitive assay for measuring IgA antibody to VCA,has met with initial results.
Key words: Epstein-Barr virus Antigen viral Serodiagnosis Enzyme-linked immunosorbent assay
鼻咽癌(NPC)在我国南方高发区的发病率和死亡率均占恶性肿瘤的第三位,EB病毒与NPC有密切关系,回顾性血清流行病学调查表明,NPC确诊前病人血清中往往已有VCA/IgA抗体,所以检查血清中的EBV-VCA/IgA抗体在NPC的早期诊断和防治上意义重大[1] 。通常检查EBV-VCA/IgA抗体是采用B95-8 细胞涂片的免疫荧光(IF)或免疫酶法,结果判定带有一定的主观性。国外许多实验室建立ELISA方法检查血清中的VCA/IgA抗体[2,3] ,但由于从类淋巴母细胞株中提取的VCA抗原表达量较低,限制了这一方法的实际应用。基因重组技术的广泛应用为此提供了极大的方便,一系列EBV特异的相关抗原得到表达,并表现出良好的免疫活性[4,5] 。作为VCA主要抗原多肽的gp125也得以在痘苗病毒和杆状病毒中表达[4,6] ,并表现出良好的活性。本研究是将以基因工程手段表达的VCA主要多肽gp125加以纯化,作为诊断抗原建立检查血清中的VCA/IgA抗体的酶联免疫吸附法(ELISA),并与B95-8细胞涂片的IF作对比;同时对更简便、快速、特异、敏感的胶体金联免疫吸附方法(GCISA)在检查血清中的EBV-VCA/IgA抗体的应用进行了尝试,为NPC血清学诊断方法的改进和大规模的血清学普查提供重要手段。
1 材料和方法
1.1 细胞和病毒 H143细胞在含10%新生牛血清的Eagle's培养液中,37℃静置培养,维持液为含2%新生牛血清的Eagle's培养液;B95-8细胞培养于含10%小牛血清的RPMI 1640培养液,经25ng/ml TPA激活后细胞涂片,丙酮固定;含有EBV gp125基因的重组痘苗病毒由谷淑燕教授惠赠,病毒感染H143细胞表达gp125,感染细胞以蚀斑法测得病毒滴度为4×106 PFU/ml。
1.2 血清 鼻咽癌病人和正常人血清来自1989年广东NPC高发区普查的阳性和阴性血清;将当时确定的阳性血清1∶10稀释在B95-8细胞片上检查VCA/IgA抗体,选择抗体阳性血清48例。
1.3 层析纯化介质 DEAE-Sepharose Fast Flow购自Pharmacia公司。JL-Q76-SL4疏水层析柱由北京大学肖能庆教授提供,将经处理的上述纯化介质室温平衡后装柱,去离子水充分洗涤后以平衡液平衡用于层析。
1.4 金联免疫吸附法 参照文献[7]。
2 结果
2.1 病毒的接种量和收获时间的确定 以不同的病毒感染量感染细胞,并于不同时间观察细胞病变,收集细胞裂解液,免疫斑点检测,病毒接种量在IPFU/cell,感染48小时,抗原表达量最高。
2.2 不同的细胞裂解方法对抗原的影响 将感染细胞经不同的物理化学方法裂解,免疫斑点检测,结果表明,1%NP40(1%NP40,2mmol/L PMSF)结合超声波处理效果最好。
2.3 抗原的不同纯化方法
2.3.1 JL-Q76-SL4疏水柱层析 柱高2cm,直径0.8cm,上样量10ml,流速0.5ml/分钟,收集各峰做免疫斑点检测,结果表明平衡液洗脱下来的为特异性蛋白,而洗脱液洗脱下来的为阴性蛋白。表明特异性的抗原成分不是疏水性蛋白。
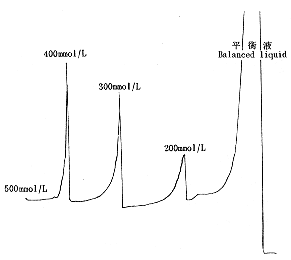
2.3.2 DEAE-Sepharose Fast Flow离子交换层析 层析柱高12cm,直径1.5cm,上样量10ml,流速0.6ml/分钟,以不连续NaC1梯度洗脱,洗脱浓度依次为200mmol/L、300mmol/L、400mmol/L、500mmol/L,见图1。收集各蛋白洗脱峰免疫斑点检测,400mmol/L NaC1洗脱峰为阳性峰。将此收集峰进一步经疏水层析
图 1 DEAE-Sepharose Fast Flow层析图
Fig.1 Elution on DEAE-Sepharose Fast Flow chromatography
图 2 DEAE-Sepharose Fast Flow阳性峰进一步经JL-Q76-SL4疏水层析峰图
Fig.2 Elution on JL-Q76-SL4 column after DEAE-Sepharose Fast Flow chromatography
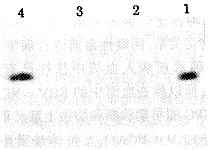
图 3 纯化产物免疫印迹方法的检测结果
1:层析纯化前的粗提物; 2:野型病毒感染的细胞粗提物;3:未经感染的细胞粗提物; 4:经纯化的蛋白
Fig.3 Detection of purified protein by immuno-blot
1:Unpurified protein. 2:Extract of cells infected with vaccinia virus 3:Extract of cells un-infected with virus. 4:Purified protein
柱纯化,结果(图2)表明经DEAE-SepharoseFast Flow洗脱下来的阳性峰中已不含疏水杂蛋白,并经Western-blot证明,其为特异性蛋白(见图3)。
2.4 检查血清中EBV-VCA/IgA抗体ELISA的建立 经方阵滴定确定纯化的抗原包被量为1~2μg/ml,并以PBS+0.05% Tween-20为稀释液,PBS+2% BSA为封闭液,效果最佳。
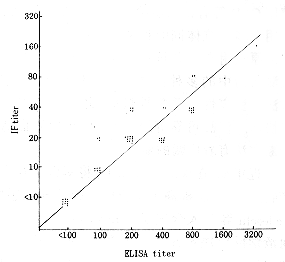
先用间接ELISA检查血清中VCA/IgA抗体,结果A值较低,采用三步放大ELISA,即在第一和第二抗体之间加入鼠抗人IgA单克隆抗体,收到了较好的效果。以此检测了48份鼻咽癌病人和10份正常人血清中的VCA/IgA抗体,并与B95-8细胞片的IF进行对比(表1),表明二者检测的抗体滴度分布情况基本一致,48份鼻咽癌病人血清ELISA的GMT是IF的12倍;而10份正常人血清中VCA/IgA抗体分别小于1∶100和1∶10。进一步将两种方法的检测结果进行了比较(图4),可以看到,二者有较好的相关性。
图 4 血清中VCA/IgA抗体滴度分布
Fig.4 Distribution of titers of VCA/IgA antibody in sera
表 1 鼻咽癌病人血清中VCA/IgA抗体滴度分布
Tab.1 The titers of VCA/IgA antibody in sera of NPC patients
| 方 法 Methods | 血清份数 No.of sera | 抗体滴度分布(例数) Titers of antibody(No.cases) | GMT | ||||||
| ELISA | 48 | 100(10) | 200(15) | 400(10) | 800(11) | 1600(1) | 3200(1) | 1∶302.87 | |
| IF | 48 | 10(7) | 20(23) | 40(14) | 80(3) | 160(1) | 320(0) | 1∶25.12 | |
2.5 检查血清中VCA/IgA抗体的金联免疫吸附法(Gold-conjugated immunosorbent assay,GCISA)的初步建立 将纯化的抗原以0.2μg/条开始倍比稀释吸附于硝基纤维素膜上用于检测,阳性血清的抗体特异性地与纤维膜上的抗原结合,呈现一条红色条带,阴性血清孵育的抗原条带呈无色;在0.05μg/条的抗原量时仍可检测出阳性血清。
3 讨论
本研究是将以基因工程手段表达的VCA主要多肽gp125纯化,并以此作为诊断抗原建立敏感、特异的检测血清中VCA/IgA抗体的方法。在抗原纯化前,对病毒感染量、细胞收获时间及裂解方法进行了探索,以求最大限度地获取抗原粗制物。在抗原纯化过程中,对多种纯化手段进行了比较,最终选用了DEAE-Sepharose Fast Flow,这是由于:①蛋白吸附量大,流速快,操作时间短;②重复性好,再生时柱体积变化不大;③操作简便,不需特殊的试剂。疏水层析柱纯化结果表明,gp125不是疏水性蛋白,故单独选用疏水层析柱纯化此抗原效果不好,但作为辅助手段,将经DEAE-Sepharose Fast Flow纯化的阳性峰,再经此疏水柱层析纯化以去除疏水性蛋白成分,进一步提高蛋白的纯度,则不失为一个可行的纯化方案。在诊断方法上,建立ELISA方法检测了鼻咽癌病人和正常人血清中的VCA/IgA抗体,其结果与IF的检测结果基本一致,但其敏感性高于IF,更适合于疾病的血清学诊断和大规模的血清流行病学调查。此外,本文建立的GCISA方法,具有以下优点:①抗原包被量较少;②快速、简便、安全,在加入胶体金标记羊抗鼠IgG抗体后30分钟左右即可显色,显色无需底物液,一方面简化了实验步骤,缩短了实验时间,另一方面避免了使用OPD等有毒物质给实验者带来的危害;③可用于多种抗体同时检测,将两种或两种以上的抗原吸附在一条抗原条带上,可以一次性地检测血清中的多种抗体。有资料显示[7] ,这种方法的稳定性和重复性较好,此外加之观察结果快速,直观,可靠等,作为一种新型的血清学诊断方法有着广阔的前景。
近年来,在疾病的诊断上,将基因工程表达产物进行纯化,提高了反应的特异性和敏感性。Tedeschi等[8] 人合成了一系列ZEBRA蛋白中血清学反应决定簇的寡聚多肽,并对其一一检测,最后得出结论,ZEBRA蛋白中的不同的血清学反应决定簇与不同的EBV相关疾病有关,例如,他们合成的第22个多肽只与NPC有关,与EB病毒其它相关疾病无关,这样,使得疾病的诊断更为确切。多抗原联合包被用于检测正是本课题继续努力的方向之一,例如,在鼻咽癌病人的血清中,VCA/IgA抗体阳性率在90%以上,EA/IgA仅50%,而在VCA/IgA抗体阳性正常人中鼻咽癌的检出率为1.9%,EA/IgA抗体阳性正常人中鼻咽癌的检出率达30%。可见,VCA/IgA抗体对鼻咽癌较为敏感,而EA/IgA抗体较为特异[9] 。若将二者联合用于鼻咽癌的诊断,则兼顾了敏感性和特异性,将更利于鼻咽癌的诊断。
参 考 文 献
1 Zeng Y.Seroepidemiological studies on nasopharyngeal carcinoma in China.Advances in Cancers Research,1986,44:121-138.
2 Luka J,Chase R C,Pearson G R,et al.A sensitive enzyme-linked immunosorbent assay (ELISA)against the major EBV-associated antigens:I Correlation between ELISA and immunofluorescence titers using purified antigens.J,Immunol Methods,1984,67:145-156.
3 Dolken G,Weitzmann D,Boldt C,et al.Detection of IgA antibodies to Epstein-Barr virus associated antigens by ELISA.J Immunol Methods 1984,68:331-339.
4 Sanchez-Martinez D L, Pattony A,Stewart J,et al.Detection of Epstein-Barr virus specific antibodies by means of bacuclovirus-expressed EBV gp125.J Virol Methods,1995,52:145-153.
5 Pulford D,Lowrey P J, Morgan A.Expression of the Epstein-Barr virus envelope fusion glycoprotein gp85 gene by a recombinant baculovirus.J Gen Virol,1994,75:3241-3248.
6 谷淑燕,王轶龙,李燕,等.EB病毒壳抗原gp125的表达和初步应用.中华实验和临床病毒学杂志,1996,1∶62-66.
7 皮国华,何红英,谷淑燕,等.胶体金联免疫吸附试验检测丙型肝炎病毒抗体.中华实验和临床病毒学杂志,1995,4∶371-374.
8 Tedeschi R,Foong Y T,Cheng H M,et al.The disease associations of the antibodies response against the Epstein-Barr virus transactivator protein ZEBRA can be separated into different epitopes.J Gen Virol 1995,76∶1393-1400.
9 皮国华,曾毅,方仲,等.测定Epstein-Barr病毒IgA/EA抗体的改进方法.病毒学报,1986,4∶372-376.
1997年1月20日收稿 11月24日修回