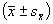 |
关键词:
【摘要】 目的 探讨糖尿病患者尿白蛋白排出率 (UAE) 与糖尿病自主神经病变之间的关系。方法 对56例糖尿病患者及54例正常对照者进行了UAE测定,并应用24小时动态心电图心率变异性频谱分析技术测定了两组的心脏自主神经功能。结果 糖尿病患者在不同 UAE 阶段,其反映迷走神经功能的入睡后高频成分均显著低于对照组(P=0.0001)。随着UAE的增加,心脏自主神经病变的各项指标均值呈明显的减低趋势,同时出现迷走-交感神经的联合损害。结论 UAE越高,心脏自主神经病变的各项指标越低,即自主神经病变越明显。
The relationship between cardiac autonomic neuropathy and urinary albumin excretion in diabetic patients Bian Rongwen* , Lu Juming, Pan Changyu, et al. * Department of Endocrinology, Chinese PLA General Hospital, Beijing 100853
【 Abstract 】 Objective To investigate the relationship between urinary albumin excretion (UAE) and cardiac autonomic neuropathy in diabetics. Methods The UAE was measured, and the cardiac autonomic function was tested by 24-hour electrocardiogram spectral analysis of heart rate variability in 56 diabetic patients and 54 normal controls. Results The high frequency at sleeping reflecting the cardiac vagus nerve function was significantly lower in diabetic patients with different UAE than normal controls (P=0.0001). With the increasing of UAE, the test values of cardiac autonomic neuropathy were gradually decreased, and combined vago-sympathetic nerve impairment developed. Conclusion The higher the UAE, the lower the test values of cardiac autonomic neuropathy, i.e. the more significant autonimic neuropathy.
【 Key words 】 Diabetic neuropathies Urinary albumin excretion
白蛋白尿与糖尿病患者心血管疾病的发生率和病死率之间有密切关系 [1 ,2 ] 。糖尿病伴心脏自主神经病变者心脏意外的发生率及病死率明显增加 [ 3 ] 。但对尿白蛋白排出率 (UAE) 与糖尿病自主神经病变之间存在的关系,尚无一致认识。有报道认为,糖尿病神经病变的发生与微血管病变有关,临床上也发现伴微量白蛋白尿的患者中有合并自主神经病变者,因此自主神经病变与UAE相关 [ 4 ] 。但有些学者认为,心脏自主神经病变的各项试验与UAE无关 [ 5 ] 。24小时动态心电图心率变异性的能谱分析比传统的检查方法能更敏感地早期发现心脏自主神经病变。我们应用这一检查技术并结合传统的检查方法,分析了UAE与糖尿病心脏自主神经病变之间的关系。
对象与方法
一、研究对象
1.糖尿病组:56例,均为本院住院病人。按WHO(1985年)标准诊断为糖尿病。所有患者均无泌尿系感染,无急、慢性肾脏疾病,无充血性心力衰竭,无高血压,无发热、酮症等应激情况。按UAE(μg/min)结果将患者分为3组。
(1)正常白蛋白尿组(UAE<20 μg/min):31例,男20例,女11例。平均年龄43.2±10.7岁,范围17~64岁。病程4.3±4.7年。
(2)微量白蛋白尿组(UAE值为20~200 μg/min):16例,男女各8例。平均年龄46.8±12.8岁,范围23~67岁。病程9.5±8.3年。
(3)大量白蛋白尿组(UAE>200 μg/min):共9例,男4例,女5例,平均年龄50.4±16.2岁,范围30~70岁。病程11.5±3.8年。
2.正常对照组:54例,男37例,女17例,平均年龄43.6±13.9岁,范围20~67岁。无高血压,冠心病及脑血管病,常规12导联心电图检查正常。
二、方法
1.UAE测定:收集过夜12小时尿液,离心后加叠氮钠防腐,置4℃冰箱待测。测定药盒由中国原子能研究所提供。结果用μg/min表示。批内变异系数(CV)为1.2%~3.1%,批间CV为4.1%~4.6%[6] 。每例测3次,取均值按不同的UAE标准归入各试验组。
2.心脏自主神经功能测定:包括深呼吸心率差,立卧位心率差、乏氏动作指数、30∶15比值、立卧位收缩压差。
3.频谱分析:受试者佩带DCG100型双通道心电图记录仪(北京新兴生物医学工程研究中心提供),连续记录24小时心电信号。初始,受试者平卧15分钟,然后直立10分钟,同时记录心电信号。用DCG102型回放分析主机对24小时心电信号采样,经模数转换后,分析系统对每个QRS波群进行识别和标记,以4分钟为单位,取256或512个连续正常R-R间期,由计算机进行统计学分析,得出心率变异的时域各参数。同时进行快速富立叶转换并运算,得出心率变异的能谱图。对数据作如下分析:
(1)时域分析参数:①平均R-R间期(AVGR-R),单位用ms表示。②24小时R-R间期的标准差(SDNN)。③变异系数。④连续R-R间期差值均方的平方根(rMSSD)。
(2)频率带设置:频率在0.019~<0.10 Hz定为低频段。0.10~<0.15 Hz为中频段。0.15~0.40 Hz为高频段。
(3)频域参数:①直立位及卧位,入睡后低频(LF),单位:ms。②入睡后的高频(HF),单位:ms。③立位LF/HF比值。④卧位LF/HF比值。
三、统计学处理
所有数据呈正态分布,用±s表示。利用SAS软件对各指标组间差异进行协方差分析(analysis of covariance),控制各组年龄因素对指标分析的影响,同时采用Lsmean程序对修正均数进行两两对比。尿白蛋白测定结果经对数转换满足正态分布后与反映自主神经病变的各项指标作相关性分析。
结果
一、不同UAE组与正常对照组心脏自主神经功能测定结果(表1)
随着UAE的增加,反映心脏自主神经病变的各项指标均值呈明显的减低趋势,除30∶15比值外,其他参数间差异均有显著性意义。正常对照组与正常白蛋白尿组相比较,深呼吸心率差和立卧位血压差差异有显著性,P=0.0057和P=0.0235。
二、心率变异性时域测定结果(表2)
表1 各组心脏自主神经功能试验结果
| 组别 | 例数 | 男/女 | 心率差(次/分) | 乏氏指数 | 30∶15比值 | 立卧位收缩压差 (mmHg) | |
| 深呼吸 | 立卧位 | ||||||
| 正常对照组 | 54 | 37/17 | 18.0±1.0 | 22.6±1.0 | 1.30±0.03 | 1.14±0.02 | 0.5±1.3 |
| 糖尿病组 | |||||||
| 正常白蛋白尿组 | 31 | 20/11 | 13.6±1.2 | 22.6±1.3 | 1.23±0.03 | 1.12±0.03 | -4.5±1.7 |
| 微量白蛋白尿组 | 16 | 8/8 | 9.1±1.7 | 16.5±1.8 | 1.18±0.05 | 1.05±0.04 | -11.2±2.4 |
| 大量白蛋白尿组 | 9 | 4/5 | 3.8±2.3 | 7.8±2.4 | 1.06±0.06 | 1.02±0.05 | -24.7±3.2 |
| F值 | 17.18 | 16.10 | 4.84 | 2.41 | 22.24 | ||
| P值 | 0.0001 | 0.0001 | 0.0033 | 0.0716 | 0.0001 | ||
注:1 mmHg=0.133 kPa
表2 不同尿白蛋白排出组心率变异性时域分析
| 组别 | 例数 | 平均R-R间期(ms) | 24小时R-R间期的标准差(ms) | 变异系数(%) | 连续R-R间期差值均方的平方根 |
| 正常对照组 | 54 | 863±16 | 55.9±2.2 | 6.41±0.22 | 30.5±1.6 |
| 糖尿病组 | |||||
| 正常白蛋白尿组 | 31 | 824±22 | 48.5±4.2 | 5.74±0.28 | 26.3±2.1 |
| 微量白蛋白尿组 | 16 | 782±30 | 38.5±0.4 | 4.86±0.39 | 19.2±2.9 |
| 大量白蛋白尿组 | 9 | 742±41 | 22.1±5.6 | 2.84±0.53 | 14.9±3.9 |
| F值 | 3.08 | 16.29 | 19.14 | 10.15 | |
| P值 | 0.0309 | 0.0001 | 0.0001 | 0.0001 |
| 组别 | 例数 | 立位低频(ms) | 卧位低频(ms) | 入睡高频(ms) | 卧位低频/高频比值 | 立位低频/高频比值 |
| 正常对照组 | 54 | 103.24±2.95 | 78.36±3.28 | 140.05±3.42 | 1.10±0.06 | 2.06±0.09 |
| 糖尿病组 | ||||||
| 正常白蛋白尿组 | 31 | 103.45±3.88 | 107.49±4.31 | 105.04±4.49 | 1.37±0.08 | 1.59±0.12 |
| 微量白蛋白尿组 | 16 | 93.01±5.42 | 93.56±6.02 | 102.65±6.28 | 1.31±0.12 | 1.38±0.16 |
| 大量白蛋白尿组 | 9 | 75.32±7.27 | 88.53±8.08 | 99.59±8.42 | 0.75±0.16 | 0.85±0.22 |
| F值 | 5.09 | 9.69 | 20.43 | 6.72 | 12.84 | |
| P值 | 0.0025 | 0.0001 | 0.0001 | 0.0004 | 0.0001 |
三、不同UAE组频谱指标分析结果(表3)
反映迷走神经功能的入睡后HF成分在不同的UAE糖尿病组均显著低于对照组,P=0.0001。反映交感神经活动的卧位状态LF成分在正常对照组最低,其次是UAE>200 μg/min组。改立位状态后,对照组的LF成分明显上升,而UAE>200 μg/min组反而有所下降。其他两组在立卧位状态时LF值没有明显变化。卧位LF/HF比值在正常白蛋白尿组及微量白蛋白尿组均高于正常对照组(P<0.05)。随体位改变正常对照组LF/HF比值明显上升,与其他组相比P<0.001。在正常白蛋白尿组,其比值也有所升高,但还是低于正常对照组。随着尿白蛋白排出的增加,LF/HF比值逐渐降低。
四、糖尿病患者UAE与心脏自主神经病变指标的关系(表4)
表4 糖尿病患者UAE与其他因素的关系
| r | P值 | |
| 深呼吸心率差 | -0.44 | 0.0006 |
| 30∶15比值 | -0.28 | 0.0338 |
| 乏氏指数 | -0.41 | 0.0016 |
| 立卧位心率差 | -0.49 | 0.0001 |
| 立位低频 | -0.50 | 0.0001 |
| 入睡高频 | -0.19 | 0.1531 |
| 变异系数 | -0.58 | 0.0001 |
注:UAE:尿白蛋白排出率
讨论
Jensen等[7] 对18例有糖尿病自主神经病变患者的尸检研究发现,10例合并有肾脏病变。已有人提出,自主神经病变可能使患者夜间UAE和肾血流量增加,加速糖尿病肾病的发展[8,9] 。有报道糖尿病患者在微量白蛋白尿阶段,已存在自主神经的损害[6,10] 。我们的观察结果证实,糖尿病伴微量白蛋白尿患者,甚至在正常UAE者,已有迷走神经功能损害的表现。正常UAE组与正常对照组比较,深呼吸心率差异常,入睡后HF成分降低。在体位变化后,反映交感-迷走神经活动平衡指标的LF/HF比值明显低于正常对照组(P<0.001),提示病人交感神经张力对体位变化的反应已有减弱。心率变异的能谱分析比传统的自主神经功能检查更全面地反映这种病变,有助于早期发现交感神经功能的损害。随着UAE的增加,自主神经病变也逐渐加重,明显累及心脏交感神经功能,出现心脏自主神经功能试验各项指标异常,LF成分也明显降低,LF/HF比值对体位的变化几乎无反应。UAE的增加与自主神经病变的发展趋于一致。
SDNN被认为是反映迷走神经张力的敏感指标,正常值为50~100,低于50即认为有迷走神经张力的减弱[11] 。本研究中,正常UAE组SDNN均值<50,与正常对照组相比差异有显著性(P<0.05)。
本组糖尿病患者UAE与自主神经的各项指标间呈负相关性。表明尿白蛋白排出越多,心脏自主神经的损害越重。自主神经病变可能发生在先,由此而致夜间肾血流量增加,继之UAE排出增加。但明确二者的相互影响尚需大量研究。
参考文献
1 Mogensen CE. Microalbuminuria predicts clinical proteinuria and early mortality in maturity onset diabetes. N Engl J Med, 1984,310:356-360.
2 Jarret RJ, Viberti GC, Arggropoulos A. Microalbuminuria predicts mortality in non-insulin-dependent diabetes. Diabet Med, 1984,1:17-19.
3 Ewing DJ, Martyn CN, Young RJ, et al. The value of cardiovascular autonomic function tests: 10 years experience in diabetes. Diabetes Care, 1985,8:491-498.
4 Gambardella S. Relationship between autonomic neuropathy in insulin-dependent diabetes and its pathogenetic meaning. Diabetes, 1991,40(Suppl 1):554A.
5 Tsai TJ, Chen YM, Chu TS, et al. Cardiovascular autonomic dysfunction in non-insulin-dependent diabetes mellitus and its relation to renal dysfunction. J Formos Med Assoc, 1993,92:509-513.
6 卞茸文,陆菊明,潘长玉.不同储存温度和时间对糖尿病患者尿白蛋白测定的影响.中国糖尿病杂志,1996,4:38-40.
7 Jensen T, Borch JK, Kofoed EA, et al. Coronary heart disease in young type Ⅰ (insulin dependent) diabetic patients with and without diabetic neuropathy-incidence and risk factors. Diabetologia, 1987,30:144-148.
8 Menzinger G, Gambardella S, Spallone V. The relationship of autonomic neuropathy to other diabetic complications. Diabet Med, 1993.10(Suppl 2):74S-76S.
9 Winocour PH, Dhar H, Anderson DC. The relationship between autonomic neuropathy and urinary sodium and albumin excretion in insulin treated diabetics. Diabet Med, 1986,3:436-444.
10 Zander E, Schulz B, Heinke P, et al. Importance of cardiovascular autonomic dysfunction in IDDM subjects with diabetic nephropathy. Diabetes Care, 1989,12:259-264.
11 Akinci A, Celiker A, Baykal E, et al. Heart rate variability in children: sensitivety of the time-and frequency-domain methods. Pediatr Cardiol, 1993,14:140-146.
(收稿:1996-10-25 修回:1997-08-11)