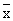 |
关键词:缺氧症;高血压,肺性;离子通道;肺动脉
【摘要 】 目的 研究慢性缺氧性肺动脉高压发生机制中钾通道活性改变的作用,及其开放剂卡吗克林(cromakalim)对钾通道活性的调控作用。方法 20只Wistar大鼠随机分为对照组10只和缺氧组10只,缺氧组大鼠缺氧3周,每天缺氧8小时;运用急性酶分离法对Wistat大鼠肺动脉平滑肌细胞进行了分离;应用膜片钳小片膜单通道技术,分别对正常和慢性缺氧3周大鼠的肺动脉平滑肌细胞的钾离子通道进行了测定;记录并比较了两组大鼠肺动脉平滑肌细胞钙、ATP激活性钾通道(K+ Ca-ATP )和延迟整流性钾通道的活性,并观察了cromakalim对缺氧组大鼠钾通道的影响。结果 慢性缺氧组大鼠肺动脉平滑肌细胞钙、ATP激活性钾通道(K+ Ca-ATP )和延迟整流性钾通道的活性均比正常组低,cromakalim可使慢性缺氧组K+ Ca-ATP 的活性明显增高(P均<0.01)。结论 慢性缺氧可明显抑制大鼠肺动脉平滑肌细胞钾通道活性,这可能在慢性缺氧性肺动脉高压的发病机制中发挥重要的作用,钾通道开放剂cromakalim可作为降低缺氧性肺动脉高压的有效药物。
Inhibition of potassium channel bychronic hypoxia on pulmonary artery smooth muscle cells in rats Xiao Xinrong,Chen Wenbin,Cheng Deyun. Respiratory Department,First Hospital Affiliated toWest China University of Medical Sciense, Chendu 610041
【Abstract 】 Objective Toexplore the possible effect of potassium channel in chronic hypoxic pulmonaryhypertension. Method Male Wistarrats were placed in the identical normobaric or hypoxic environmental chamber. In onechamber, rats were maintained in 10%±0.5% O2 (by displacement with N2 )for 3 weeks, whereas in the other, rats were maintained in air. The single smooth musclecell was isolated from pulmonary artery (ψ 200~700 μm) of Wistar rats withacute enzymatic digestion method. Using patch-clamp technique, we recorded the outward K+ currents in pulmonary artery smooth muscle cells and identified a Ca2+ . ATPactivated K+ channel (K+ Ca-ATP ) and a delayed rectifier K+ channel among the outward K+ currents. We compared the activities of Ca2+ .ATPactivated K+ channel (K+ Ca-ATP ) or delayed rectifier K+ channel in smooth muscle cells isolated from pulmonary artery of chronic hypoxic andnormoxic rats. Result Theactivities of
Ca2+ .ATP activated K+ channel (K+ Ca-ATP ) anddelayed rectifier K+ channel in chronic hypoxic group are much lower than thatin normal group (T test, P<0.01). Cromakalim (10 mmol) caused a marked enhancement ofactivity of the reduced K+ Ca-ATP but not the delayed rectifier K+ channel in rats of hypoxic group. Conclusion The persistent decrease of potassium channel activity maycontribute to setting the development of chronic hypoxic pulmonary hypertension. Cromakalim, one of potassium channel openers, can decrease the pulmonary hypertensioninduced by chronic hypoxia and may be a new effective drug for treatment of hypoxicpulmonary hypertension.
【Key words 】 Anoxia Hypertension, renal Ion channels Pulmonaryartery
有研究证实,慢性缺氧7天可使大鼠肺动脉主干平滑肌去极化[1] 。另有作者提出肺血管高张力的建立,可能是慢性缺氧对肺动脉平滑肌细胞静息膜电位的去极化作用,而且主要发生在直径≥200μm的肺小动脉[2] ,而钾通道活性与血管平滑肌细胞的极化状态密切相关。因此,我们应用膜片钳小片膜单通道技术对正常和缺氧3周大鼠肺动脉平滑肌细胞的钾通道电流进行了比较,并观察了钾通道开放剂卡吗克林(cromakalim)对缺氧组大鼠钾通道活性的调控作用。
材料与方法
1.动物: 雄性Wistar大鼠20只,重250~320 g(购于华西医科大学实验动物中心)。随机分为正常对照组和缺氧组,每组各10只。
2.实验试剂和药物:胶原酶Ⅺ,4-(2-羟乙基)-1-哌嗪乙烷磺酸(4-(2-hydroxyethyl-1-piperazine-ethanesulfonic acid,HEPES),小牛血清白蛋白,木瓜蛋白酶(papain),卡吗克林(cromakalim),四乙铵(TEA),4-氨基吡啶(4-AP),ATP钠(Na2 -ATP),乙烯乙二醇-双(β-氨基乙醚) -N,N,N′,N′-四乙酸(ethyline glycol-bis(β-aminoethyl ether )-N,N,N′,N′-tetraaceticacid, EGTA)和4,4′-双异硫氰酸芪-2,2′-双磺酸(4,4′-diisothiocyano-stilbene-2,2′disulphonicacid,DIDS,均购于SIGMA公司;二硫苏糖醇(dithiothreitol,DTT),购自Promega公司,HEPES缓冲的细胞分离液(HPSS)。
3.主要实验仪器:膜片钳放大器(CEZ-2200 Nihon konden,JaPan),微电极拉制仪(PP-83Narishige,JaPan),微电极抛光仪(MF-83 Narishige),倒置相差显微镜(IMT-2Olympus,JaPan),三维操纵器(WN203 Narishige,JaPan),电子计算机(586),数模转换器(Digital-1200Axon instrument american),激光打印机(Laserjet,ⅢHP),微电极玻璃毛坯(上海脑生物研究所)。
4.动物缺氧:参照薛全福等[3] 报道的方法,将实验大鼠置于常压低氧舱内,舱内灌充氮气,使其氧分压下降,氧气监测仪测定开关控制舱内氧浓度为10%±0.5%,舱内CO2 和水蒸汽用钠石灰吸收,每天缺氧8小时,连续缺氧3周。
5.肺动脉平滑肌细胞的分离:正常对照组和缺氧组大鼠肺动脉平滑肌细胞均采用急性酶分离,大鼠麻醉后,剖胸,迅速游离肺脏,置于HPSS中,在体视显微镜下,分离出左、右肺动脉(ψ200~700 μm)分支。将动脉管沿纵行方向剖开,并将血管壁剪成1 mm×1 mm的组织小片。在盛有组织小片的试管中加入低Ca2+ 的HPSS液2ml(Ca2+ ,20 μmol/L),内含胶原酶Ⅺ 1 mg/ml,木瓜蛋白酶1 mg/ml,小牛血清白蛋白2mg/ml,37℃孵育酶解40分钟,低速离心(1 000 r/min)5分钟,用无Ca2+ 的HPSS液洗涤2次,再低速离心5分钟,均弃上清液。加入低钙HPSS液4 ml,用尖端抛光、开口较大的巴斯德(pasteur) 吸管轻柔地吹打20分钟,即得到单个的肺动脉平滑肌细胞,4℃低温保存[4] ,8小时内备用。
6.高阻封接及膜片形成:在表面涂有1%多聚赖氨酸的盖玻片上,将分离好的肺动脉平滑肌细胞沉底,并用细胞浴液冲洗2次。在倒置相差显微镜下,选择分散的、形态典型、表面光滑的肺动脉平滑肌细胞,应用三维显微操纵器的粗推将微电极尖端与待测细胞接近,然后改换细推使微电极尖端与细胞表面接触,同时由计算机经膜片钳放大器向微电极发放一电压为0.1mV,波宽为40 ms的脉冲方波,然后通过与探头相连的负压抽吸管向微电极尖端施以0.49~1.96kPa(1 kPa=7.5 mmHg)的负压,使微电极尖端与细胞膜形成近似电绝缘,计算机显示其阻抗值≥1GΩ(1G=1×109 ),即形成高阻封接(giga-seal),这时形成的膜片为细胞贴附式(cell-attached patch);此时,只要轻轻提起电极,将其尖端暴露于空气中几秒钟,即形成内面向外式膜片(inside-outpatch)[5] 。在所需膜片形成后,通过灌流装置(2~3 ml/min)对待测细胞给予不同浓度的钙离子、ATP、钾通道阻断剂和钾通道开放剂,以观察不同因素对肺动脉平滑肌细胞的影响。
7.实验温度:所有膜片钳实验均在室温(20~24℃)条件下进行。
8.数据采集、输入与分析:(1)数据采集及输入:数据采集与输入均使用Axon公司(Axon Instructment)软件pClamp6.02,采样频率为33.33 kHz,采样方式为无间隔(Gap free),每一钳制电压下膜片电信号的记录时间为10秒。(2)数据分析:采用软件pClamp 6.02版本进行处理。数据处理后可得电导值、开放概率(POPEN )、开放时间(TOPEN )、关闭时间(TCLOSE )。
9.统计学处理:实验结果采用t检验,数据以±s表示。
结果
一、正常对照组大鼠肺动脉平滑肌细胞钾通道的分离及鉴定
采用内面向外细胞膜片,在两组大鼠的肺动脉平滑肌细胞膜上,均可记录到两种外向性钾电流。根据钾通道、单通道的电生理特性,以及加入特异性的钾通道阻断剂而将这两种钾电流分离。其中,一种电流的电导值较大,约240±10pS,具有明显的电压依赖性,钙离子和ATP浓度的增加能使之激活,钾通道阻断剂TEA能特异性的阻断该通道,这种大电导的钾通道为钙、ATP激活的钾通道(K+ Ca-ATP )[6] 。另一种电流的电导值较小,为9.10±1.03pS,也具有明显的电压依赖性,钙离子和ATP对其几乎无影响,TEA不能阻断该通道,而4-AP却对其具有明显的抑制作用,这种小电导的钾通道为延迟整流性钾通道[7] 。
二、正常对照组大鼠肺动脉平滑肌细胞的钾通道活性
1.K+ Ca-ATP 通道的活性:当细胞浴液内Ca2+ 、ATP浓度分别为3×10-6 mol/L和101μmol/L时,膜电压保持在+60 mmol的情况下,K+ Ca-ATP 通道的活性较好[6] 。在正常组24个细胞膜片中所记录到K+ Ca-ATP 通道的平均开放概率为0.25±0.02,平均开放时间为1.89±0.12ms,平均关闭时间为8.74±2.02 ms(图1,表1)。
A:正常组K+ Ca-ATP 电流,B:缺氧组K+ Ca-ATP 电流
图1 正常组和缺氧组K+ Ca-ATP 钾通道活性具有明显差异,
两组Ca2+ :3×10-6 mol,ATP:101 μmol/L,膜电位(Vm):+60 mV
表1 两组大鼠肺动脉平滑肌细胞K+ Ca-ATP 的比较和cromakalim对其的影响(±s)
| 项目 | 膜片数 | POPEN | TOPEN (ms) | TCLOSE (ms) |
| 正常组 | 24 | 0.254±0.016〓 | 1.886±0.117〓 | 8.735±2.023〓 |
| 慢性缺氧组 | 18 | 0.013±0.001 | 0.287±0.021 | 18.78±2.821 |
| Cromakalim | 12 | 0.207±0.042△ | 1.422±0.203△ | 1.643±0.472 |
-膜电位(Vm):+100 mV。A:正常组,B:缺氧组
图2 正常组和缺氧组延迟整流性钾通道电流的比较
表2 两组大鼠肺动脉平滑肌细胞延迟整流性钾通道的比较和cromakalim对其的影响(±s)
| 项目 | 膜片数 | POPEN | TOPEN (ms) | TCLOSE (ms) |
| 正常组 | 10 | 0.488±0.041 | 2.655±0.310 | 4.8±1.1 |
| 慢性缺氧组 | 12 | 0.028±0.003* | 0.241±0.002* | 26.5±2.1* |
| Cromakalim | 6 | 0.026±0.002△ | 0.267±0.004△ | 27.3±2.9△ |
三、慢性缺氧组对正常对照组大鼠肺动脉平滑肌细胞钾通道活性的影响
1.慢性缺氧对K+ Ca-ATP 通道活性的抑制作用:在Ca2+ 、ATP浓度和膜电压与正常组完全相同的情况下,缺氧组18个膜片K+ Ca-ATP 通道的平均开放概率为0.013±0.001,平均开放时间为0.287±0.021ms,平均关闭时间为18.78±2.82ms。
2.慢性缺氧对延迟整流性钾通道的抑制作用:在膜电压与正常对照组完全相同的情况下,缺氧组12个膜片的延迟整流性钾通道的开放概率仅为为0.028±0.003,其平均开放时间为0.241±0.002ms,平均关闭时间为26.52±2.12 ms。
3.cromakalim对缺氧组钾离子通道的激活作用:在缺氧组的12个细胞膜片中,应用10mmol的钾通道开放剂cromakalim可使缺氧组钙、ATP激活性钾通道的开放概率由0.013±0.001增加到0.207±0.042,平均开放时间由0.287±0.021ms增加到1.422±0.203 ms,平均关闭时间由18.78±2.82 ms缩短到1.64±0.47 ms(P均<0.01,图3)。在缺氧组的6个膜片中,10mmol的cromakakim对延迟整流性钾通道无明显激活作用(P>0.05)。
Ca2+ :3×10-6 mol/L,ATP:101 μmol/L,Vm:+60 mV
图3 cromakalim对缺氧组K+ Ca-ATP 通道的激活作用
讨论
一、慢性低氧对钙、ATP激活性钾通道的影响
慢性低氧对肺动脉平滑肌细胞钾通道活性的影响国外研究甚少。一些学者发现,慢性低氧首先导致低氧性肺血管舒张反应(hypoxicpulmonary vasodilation),然后发生持续性地低氧性肺血管收缩反应。Rodman[8] 证实,慢性缺氧72小时可通过激活大鼠肺动脉平滑肌细胞ATP敏感性钾通道(K+ ATP )而导致低氧性肺血管舒张反应的发生,那么,K+ ATP 通道可能主要参与低氧性肺血管舒张(HPD)而与低氧性肺血管收缩(HPV)无关,这一观点已得到许多研究证实。与上述结果不同,我们应用膜片钳单通道技术,在大鼠肺动脉平滑肌细胞膜上证实存在一类新型钾离子通道,其单通道电导值为240±10pS,它具有钙激活性和电压依赖性的电生理特性,并可特异性地被TEA所阻断,除此之外,该通道在细胞内ATP浓度增高时活性明显增加,这一特性与经典的ATP敏感性钾通道不同;我们实验所测定的该类钾通道可能与最近Albarwani等[6] 在大鼠肺动脉平滑肌细胞膜上发现的钙、ATP激活性钾通道(K+ Ca-ATP )相同。我们的实验结果表明,慢性低氧可使肺动脉平滑肌细胞的氧化还原代谢降低,即降低细胞内ATP浓度而对K+ Ca-ATP 通道产生明显的抑制作用(P<0.01),使肺动脉平滑肌细胞膜发生去极化,细胞膜兴奋性增高,肺血管收缩,肺动脉压增高。
二、慢性低氧对延迟整流性钾通道的影响
Albarwani等[9] 还对大鼠肺动脉床各段平滑肌细胞的钾离子通道进行过比较系统的对比研究,发现在主肺动脉平滑肌细胞膜上K+ Ca-ATP 通道占据主导地位,而在肺小动脉,除了K+ Ca-ATP 通道以外,延迟整流性钾通道也起着十分重要的作用,但在大鼠肺动脉平滑肌细胞上其它种类的钾通道电流却很难记录到。Smirnov等[4] 应用全细胞膜技术研究发现,慢性缺氧4周可引起肺动脉高压大鼠肺动脉平滑肌细胞延迟整流性K+ 通道电流的活性和幅值明显降低,这种现象在停止缺氧后仍可维持6小时以上,并推测该通道与Yuan等[10] 观察到的4-AP敏感性电压门控K+ 通道相一致。他们认为,这种延迟整流性K+ 电流振幅的降低,与慢性缺氧所致肺动脉血管重建的平滑肌细胞表现型的变化有关,即低氧导致肺血管重建的平滑肌细胞延迟整流性钾通道基因表达的减少,增加细胞内Ca2+ 水平,促进平滑肌细胞生长或向动脉内膜迁移。我们应用小片膜单通道技术的研究结果表明,慢性缺氧3周可使大鼠肺动脉平滑肌细胞延迟整流性钾通道的活性明显降低(P<0.01)。与他们结果不同的是,我们发现慢性缺氧对大鼠肺动脉平滑肌细胞延迟整流性钾通道的电流幅值影响不大,这可能与实验时采用的膜片构型不同有关;但与他们实验结果一致的是,慢性缺氧可明显抑制肺动脉平滑肌细胞延迟整流性钾通道的活性。尽管本组实验都是在正常氧分压下进行,但缺氧组肺动脉平滑肌细胞的钾通道活性仍然比正常对照组明显降低,说明慢性缺氧对钾通道的抑制有持续作用,至少在脱离缺氧环境6~8小时内仍然存在。
三、cromakalim对钾通道活性的调控作用
钾通道开放剂cromakalim属苯丙吡喃类衍生物,许多作者的研究结果表明,cromakalim主要通过激活K+ ATP 通道而逆转低氧性肺血管收缩反应[11] ,除此之外也有研究证实,cromakalim对某些血管平滑肌钙激活性钾通道具有激活作用。我们的研究结果表明,cromakalim可对因慢性缺氧所抑制的K+ Ca-ATP 通道有明显的激活作用(P<0.01),从而拮抗慢性缺氧所致的肺血管收缩反应,导致肺血管发生舒张;因此,由于对K+ ATP 和K+ Ca-ATP 通道均具有开放作用的特性,cromakalim可能在治疗低氧性肺动脉高压方面具有良好的应用前景。迄今为止,具有特异性开放延迟整流性钾通道的药物尚未发现。一些作者研究表明,cromakalim不但对脑血管平滑肌细胞延迟整流性钾通道没有激活作用,相反却产生抑制作用;我们的研究没有发现cromakalim对大鼠肺动脉平滑肌细胞的延迟整流性钾通道具有抑制作用,但它亦无激活作用。
本课题受国家“九五”科技攻关和国家自然科学基金部分资助(基金编号:96-906-02-17)
参考文献
1 SuzukiH, Twarog BM. Membrane properties of smooth muscle cells in pulmonary hypertensive rats.Am J Physiol,1982, 242: 907-915.
2 Davies P,Reid L. The distal artery segments of lung: structure and early remodeling in hypoxiadetermined by microdissection. Fed Proc ,1988, 20:1578.
3 薛全福,谢剑鸣,胡长贵,等.常压低氧性肺动脉高压模型的建立.中华结核和呼吸杂志,1989,12:350-352.
4 Smirnov SV,Robertson TP, Ward JPT, et al. Chronic hypoxia is associated with reduced delayedrectifier K+ current in rat pulmonary artery muscle cells. Am J Physiol,1994,266:365-370.
5 HamillOP,Marty A,Neher E,et al.Improved patch-clamp techniques for high-resolution currentrecording from cells and cell-free membrane patches.Pflugers Arch,1981,391:85-100.
6 AlbarwaniS, Robertson BE, Nye PCG, et al. Biophysical properties of Ca2+ -and MgATP-activated K+ channels in pulmonary arterial smooth muscle cells isolatedfrom the rat. Pflugers Arch, 1994, 428: 446-454.
7 Okabe K,Kitamura K, Kuriyama H. Features of 4-amiopyridine sensitive outward current observed insingle smooth muscle cells from rabbit pulmonary artery. Pflugers Arch, 1987, 409:561-568.
8 Rodman DM.Chronic hypoxia selectively augments rat pulmonary artery Ca2+ and K+ channel-mediated relaxation. Am J Physiol ,1992, 263:88-94.
9 AlbarwaniS, Heinert G, Turner JL, et al. K+ channel diversity in smooth muscle cellsisolated from the pulmonary artery tree of the rat. J Physiol ,1995,483:110.
10 Yuan XJ, Goldman W, Tod ML, et al. Hypoxiareduces potassium currents in cultured rat pulmonary but not mesentueric arterial myocytes. Am J Physiol ,1993, 264: 116-123.
11 Robertson BE, Steer S, Nye PCG. Cromakalimabolishes hypoxic vasoconstriction of the isolated rat lung. J Physiol,1990, 425,609.
(收稿:1998-01-06 修回:1998-05-19)
, 百拇医药