关键词: 磁共振成像;神经胶质瘤;手术后期间
【摘要 】 目的 探讨颅内恶性胶质瘤术后的MRI表现。方法 选取559例恶性胶质瘤作为试验组,126例良性星形细胞瘤作为对照组,回顾性分析其MRI表现,所有病例均经手术与病理证实,并在术后2个月内至少行1次MR平扫及增强扫描,全部病例均追踪至软化灶形成或肿瘤复发。结果 颅内恶性胶质瘤术后MRI表现主要有以下特点:(1)术后反应性增强的发生率为76.4%(417/559),在术后8~25d时强化明显,其环形增强的厚度一般<3 mm,边界清楚锐利,极少伴结节状增强影;(2)肿瘤残存的发生率约为24.2%(135/559),病灶边界模糊,厚度一般≥3mm,多伴有结节或团块状增强影;(3)术区脑膜增强的发生率为90.9%,持续时间较长,可持续3年甚至更长。结论 恶性胶质瘤的术后早期MRI表现尽管错综复杂,但仍可以在全面、细致的分析中发现某些规律和特点,从而提高术后诊断水平,对于评价手术效果和制定下一步治疗方案有着客观、重要的临床意义。
MR imaging in patients with intracranial postoperative malignant gliomas
ZHANG Hongmei, GAO Peiyi.
Center of Neuroimaging, Beijng Neurosurgical Institute, Beijing 100050, China
【 Abstract 】 Objective To evaluate the MR imagingfindings of the intracranial postoperative malignant gliomas. Methods 559 cases of high-grade gliomas and 126 cases ofpreoperative nonenhancing low-grade astrocytomas confirmed by operation and pathology wereevaluated. All cases were examined by postcontrast MRI at least one time within two monthsafter surgery, and followed up by MRI serially till the enhancement disappeared or theresidual tumor regrowed obviously. The MRI findings were analyzed retrospectively. Results The findings of postoperativemalignant gliomas on MRI were as follows: (1)The incidence of the “benign” postoperative enhancement was 74.6%. Its feature presentedas circular without any nodular or mass-like enhancement, the margin was clear and sharp,thickness of enhanced ring usually <3 mm and was maximal between 8 to 25 days; (2) Theincidence of the residual enhancement was about 24.2%, it mostly as nodular or mass-likeenhancement thickness of enhancement >3 mm. If accompanied with benign postoperativechanges, it could also appear as circular enhancement with faint margin and irregularthickness; (3)The incidence of the postoperative meningeal enhancement was 90.9%. Themeningeal enhancement at the surgical site may persist for several years. Conclusion The findings of postoperativemalignant gliomas on MRI are quite characteristic,and can be used as modality forevaluating the therapeutic effect and drawing up the next plan.
【 Keywords 】 Magnetic resonance imaging; Glioma; Postoperative period
恶性胶质瘤是颅内常见的恶性肿瘤之一,其残存与复发的问题一直是困扰其预后的重要因素,外科手术切除是目前主要的治疗方法之一。而外科手术切除作为一种创伤性治疗方法,可以引起术区周边正常脑组织发生一系列病理生理的改变,术后行影像学检查,在术区边缘可出现反应性环形增强,这种反应性环形增强与肿瘤残存所出现的病理性增强在影像学上表现相似,有时很难区别。为了客观评价手术效果、正确制订下一步治疗方案,以及早期发现复发肿瘤,术后及时、定期地行影像学检查是非常必要的。到目前为止,国内学者对胶质瘤术后的早期影像学表现缺乏足够的重视和研究,而将其统称为“术后状态”,因此也就不能为神经外科医师和放疗科医师提供更精确的信息。为了进一步提高对胶质瘤术后MRI表现的认识,笔者对1992~1996年间我院经手术与病理证实的559例恶性胶质瘤和126例良性星形细胞瘤的术后MR影像学表现进行了分析,以期为临床治疗方案的拟订和预后的评估提供参考。
材料与方法
一、 临床资料
搜集1992年2月至1996年3月我院经手术与病理证实的颅内恶性胶质瘤病例559例,其中男385例,女174例,年龄14~67岁,平均38.6岁。包括星形胶质细胞瘤(术前MRI检查有不同程度的增强)358例,胶质母细胞瘤142例,少枝胶质细胞瘤59例;其中幕上476例(占85.1%),幕下83例(占14.9%)。另选良性星形细胞瘤(术前MRI无增强)126例作为对照组,其中男74例,女52例,年龄12~56岁,平均32.7岁。
二、病例分组
1.术后残存:手术记录中记载肿瘤为部分切除的病例共有23例,除此以外,如果影像学上同时符合以下2点即认为是术后残存肿瘤的增强:(1)术后第1次MR检查即出现的增强;(2)追踪观察并无减弱或消失的趋势,直至增强部位出现肿瘤的复发。术后残存与术后反应性增强同时存在时,归为术后残存组。
而对于肿瘤复发的诊断标准,除了第2次手术和病理证实为肿瘤复发的病例(共56例)以外,影像学上符合以下任一条件即认为是肿瘤复发:(1)脑内出现新的增强灶;(2)原有残存增强的病灶增大20%以上;(3)如果原有残存增强的病灶增大小于20%,但同时出现以下任一种情况仍高度怀疑复发:①水肿及占位征象加重或重新出现;②临床症状加重。
2.术后反应性增强:术后反应性增强以以下2点判断:(1)追踪观察,术区周边的增强有逐渐减弱或消失的趋势,直至在原增强的部位有软化灶形成;(2)对照组病例(术前无增强)术后早期MR检查,术区边缘出现新的增强灶。
三、检查方法
MR仪为GE公司Signa 1.5 T和0.5 T超导型机,采用自旋回波或快速自旋回波扫描序列。扫描参数:T1 WI时,TR450、500 ms,TE 24、30 ms;T2 WI时,TR 2 000、2 200 ms,TE 85、95 ms。矩阵256×256。检查包括矢、冠、轴面平扫和增强扫描。对比剂为磁显葡胺(钆喷替酸葡甲胺,Gd-DTPA),注射剂量0.1 mmol/kg,注药后立即扫描。部分病例加做磁共振血管造影(MRA)检查。
所有病例在术后2个月内至少进行1次MR检查,最早者术后24 h之内。以后每2~3个月复查1次,所有病例均追踪至软化灶形成或肿瘤复发,最长追踪5年,最短追踪2年。
四、统计学处理
将各组病例MR影像学特点逐一记录,数据差异显著性检验采用χ2 检验。
结果
一、术后反应增强与术后残存增强
试验组术后反应性增强的发生率为74.6%(417/559)(图1~3),最早可出现在术后24h之内,其持续时间长短不一,最短者持续2个月,最长者可持续至术后9个月,平均6个月左右消失。在术后8~25d时增强最明显。术后残存肿瘤增强的发生率为24.2%(135/559)(图4~6)。有7例术后无增强,其中5例在术后24h之内行MR检查,2例分别在术后41 d和45 d时行MR检查。对照组术后反应性增强的发生率为85.9%(108/126)。因对照组术前无增强,其术后残存的发生率未统计。术后反应性增强与术后残存增强的影像学表现特点见表1。

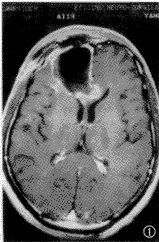
图1~3 患者 男,35岁。左额星形胶质细胞瘤术后第8d,术区周边有不规则环形增强,边缘比较清楚,厚度均匀,<3 mm(图1);术后3个月,术区明显缩小,原术区边缘增强已不明确,占位效应消失(图2);术后6个月,术区软化灶形成,原有增强已消失(图3),说明图1的增强为术后反应性增强

图4~6 患者 男,45岁。右颞胶质母细胞瘤。术前病灶不规则环形增强,有囊变,占位征象明显(图4);术后1个月,术区边缘有结节状增强及轻度占位征(图5);术后8个月,术区周边原增强灶增大,水肿及占位征象明显。第2次手术证实肿瘤复发(图6);图5所示残存肿瘤的增强与术前增强部位无明显的对应关系
表1 术后反应性增强与术后残存增强的影像学表现
| 增强 特点 | 例数 | 厚度 | 结节 | 边界 | |||
| <3 mm | ≥3 mm | 有 | 无 | 清楚 | 模糊 | ||
| 反应性 | 525 | 497 | 28 | 98 | 427 | 509 | 16 |
| 残存性 | 135 | 60 | 75 | 123 | 12 | 8 | 127 |
二、脑膜增强
所有病例中,出现术区附近脑膜增强者623例(占90.9%),其中143例伴远处脑膜增强(占20.9%),未见仅有远处脑膜增强的病例。脑膜增强的影像学特点见表2。
表2 不同位置脑膜增强的影像学特点
| 脑膜增强 位置 | 例数 | 厚度 | 结节 | 存在时间 | |||
| <2 mm | ≥2 mm | 有 | 无 | <1年 | ≥1年 | ||
| 术区附近 | 623 | 136 | 487 | 52 | 571 | 34 | 589 |
| 术区远处 | 143 | 124 | 19 | 2 | 141 | 142 | 1 |
三、术区积血或渗血
所有病例中出现术区积血268例(占39.1%),其中重度瘤腔积血39例,术区积血或渗血多在1个月左右吸收,但有8例患者在术后2个月MR复查时仍可出现高信号,有2例在术后24h之内即有高信号的出现(图7,8)。术后积血的存在使得术后影 像学表现更加错综复杂。

图7,8 患者 女,52岁。左额间变性星形细胞瘤术后20h。平扫可见术区周边有少量积血,表明有正铁血红蛋白的早期形成(图7)。注药后可见术区附近脑膜增强(图8)
四、术后的其他征象 讨论
1.脑外积血或积液:所有病例中发现脑外积血或积液289例,占42.2%。脑外积血或积液多在术后50d内吸收,有1例重度积液并伴局部脑膨出的患者在术后3个月完全吸收。
2.术后水肿:术后早期(7 d之内)均可见术区周围不同程度的水肿,并多在术后20d之内吸收完全,少数重度水肿患者(20例)在术后30 d左右水肿吸收完全。本组发现有15例患者在术后1个月仍有明显水肿,追踪观察表明有肿瘤复发。
3.术后梗塞:本组发现术后梗塞2例,均为颞叶胶质母细胞瘤,另有14例行MRA检查示术侧大脑中动脉变细。
4.术后感染:本组有3例患者术后MR发现术区脑膜增强厚度>5 mm,并伴明显结节,临床有发热等感染症状,考虑为术后感染。本组未见术后脓肿形成。
颅内恶性胶质瘤的外科手术切除作为一种创伤性治疗方法,可以引起术区周边正常脑组织发生一系列病理生理学的改变,术后行影像学检查,在术区边缘可出现反应性环形增强。有研究表明这种术后“非肿瘤性”增强的机理主要与以下因素有关:(1)血脑屏障的破坏;(2)血管肉芽组织增生;(3)血管自身调节功能紊乱引起的过度灌注[1] 。这种术后反应性增强与残存肿瘤或肿瘤早期复发所出现的病理性增强在影像学上表现相似,不易鉴别[1-5] 。Forsting等[4] 认为术后5d之内的增强多为残存肿瘤的增强,此时行MR检查可以避开术后反应性增强的混淆因素。而在本组病例中,术后24h之内行MR检查者共8例,其中出现反应性环形增强者3例,占37.5%(3/8)。由此看来,单纯从时间上对两者进行鉴别是不客观的,也是不准确的。
笔者通过对559例恶性胶质瘤和126例良性星形细胞瘤术后的MR影像学资料进行回顾性分析发现,术后反应性增强与术后残存增强的MRI表现各有一定的特点,通过影像学全面、细致的分析,对两者进行鉴别诊断是完全有可能的。术后反应性环行增强的特点是:(1)环的厚度多<3mm,而>3 mm者少见;(2)一般情况下不伴有结节;(3)边界清楚,略 有僵直。术后肿瘤残存的增强则表现为:(1)环形,也可为不规则形;(2)环的厚度不一,可以>3mm,常伴有结节状或团块状增强;(3)边缘模糊。在两者的鉴别中,边界是否清楚整齐非常重要。术后典型反应性环形增强围绕术区,边界非常清楚,甚至给人一种僵直的感觉。由于残存肿瘤常同时伴有术后反应的存在,因此其术后的增强也以环形为多见,但其边界比较模糊,常伴片状或结节状增强。Albert等[1] 认为,术后残存肿瘤的增强可与术前肿瘤的增强部分相对应。而本组并未发现两者有明确的对应关系。这是因为,对于所有病例,术中均进行了“全切”或“近全切”,只是由于MR所观察到的肿瘤边缘比肉眼敏感,才会在“全切”术后出现肿瘤残存的增强,在多数情况下这种肿瘤残存的增强是很小的一部分,再加上手术创伤,以及对比剂等多方面因素的影响,很难将术后残存肿瘤的增强与术前肿瘤的增强相对应,尽管理论上两者应该是前后一致的。
术区积血或渗血是1个无法避免的混淆因素。在本研究中,有相当一部分病例由于术区积血使术后反应性增强失去其特征性表现,边界模糊,并可见结节状增强,重度瘤腔积血的病例甚至无法观察是否有术后增强。但在多数情况下,平扫与增强的对比观察可以尽可能地缩小积血或渗血的负面影响。在研究中还发现,冠状面可以清楚地显示瘤腔内的积血情况,是比较理想的观察方位。术后渗血的机理是由于血管壁受损,血管舒缩功能发生障碍,引起通透性增高,从而导致红细胞的渗出。这与高血压或动脉瘤破裂引起的出血机理明显不同。本组术后24h之内即可有术区积血或渗血所导致的高信号出现,说明有正铁血红蛋白的早期形成。Albert等[1] 报道术后4d有正铁血红蛋白的形成,认为是由于术中应用H2 O2 止血所致。H2 O2 是一种强氧化剂,可以加速正铁血红蛋白的形成。国内术中并未使用H2 O2 这种氧化剂,显然不能解释术后24h之内正铁血红蛋白的形成,关于其形成机理有待进一步研究。
术后反应性环形增强持续时间长短不一,最短者术后2个月消失,最长者可持续至术后9个月,平均6个月左右。在一般情况下,术后6~7个月以后仍有明显的增强应考虑为病理性因素。多数病例术后8~25d时增强最明显,以后逐渐变淡。病理学上此期血管肉芽组织增生最明显。由此看来,对于术后反应性环形增强起主要作用的病理基础是血管肉芽组织的增生。
由于硬脑膜无血脑屏障,正常情况下,对比剂可以从血中被动扩散至细胞外间隙,出现脑膜增强。但因为硬脑膜本身血供并不丰富,所以注入对比剂后并非绝对出现增强。正常脑膜的增强一般较薄(<1 mm),呈细线形、阶段性增强。本研究发现,术区附近脑膜增强的发生率高达90.9%,其厚度常>2mm,甚至可以超过5 mm,可伴有结节,且存在时间较长,可持续3年甚至更长,但追踪观察有逐渐吸收变薄的趋势。这种变化并不代表术后感染。远处脑膜增强厚度相对较薄,多不伴有结节,存在时间也相对较短,一般不超过1年。如果术后1年远处脑膜仍出现厚薄不一的明显增强,应高度怀疑术后感染的可能,此时应密切结合临床作出正确诊断。关于脑膜增强的机理,可能与以下因素有关:(1)手术造成蛛网膜下腔出血,刺激脑膜产生局限性或弥漫性化学性炎性反应;(2)术后脑外积液对脑膜产生机械性压迫使血流减慢。
恶性胶质瘤的生长特点决定了其复发的不可避免性,本研究发现恶性胶质瘤的复发率明显高于良性星形细胞瘤(P<0.01),而良性星形细胞瘤术后复发的恶性度将普遍升高。另外本组出现术后梗塞者2例,与文献报道差别较大。Albert等[1] 报道恶性胶质瘤术后梗塞的发生率为10%。关于术后梗塞的发生机理,目前尚不清楚,可能与手术及某些坏死代谢产物刺激脑血管引起持续性痉挛有关。本研究还发现,有2例患者术后6个月待反应性环形增强消失后,在术区附近又出现新的小片状增强,追踪观察并无扩大或缩小的趋势,临床也无复发征象,其病理基础有待进一步探讨。
颅内恶性胶质瘤的术后影像学表现尽管错综复杂,但仍可以在全面细致的分析中发现某些规律和特点,术后MRI增强前后的对比观察以及追踪观察,基本可以作出可靠的诊断。但是,对于部分病例在缺乏二次手术和病理证实的情况下,完全根据影像学标准判断肿瘤复发具有一定的局限性。同时由于MR敏感性较高,在某些情况下影响了其特异性诊断,这也是MR检查的遗憾之处。
基金项目: 本研究为北京市自然科学基金资助项目子课题(编号:7992006)
参考文献
[1] Albert FK, Forsting M, Sartor K, et al. Early postoperative magneticresonance imaging after resection of malignant glioma: objective evaluation of residualtumor and its influence on regrowth and prognosis. Neurosurgery, 1994, 34: 45-61.
[2] Forsyth PA, Petrov E, Mahallati H, et al. Prospective study of postoperativemagnetic resonance imaging in patients with malignant gliomas. J Clin Oncol, 1997, 15:2076-2082.
[3] Sato N, Bronen RA, Sze G, et al. Postoperative changes in the brain: MRimaging findings in patients without neoplasms. Radiology, 1997, 204: 839-846.
[4] Forsting M, Albert FK, Kunze S, et al. Extirpation of glioblastomas: MR andCT follow-up of residual tumor and regrowth patterns. AJNR, 1993, 14: 77-87.
[5] Rollins NK, Nisen P, Shapiro KN. The use of early postoperative MR indetecting residual juvenile cerebellar pilocytic astrocytoma. AJNR, 1998, 19: 151-156.
收稿日期: 1999-05-24 , 百拇医药