日本药品上市后监测的立法过程及对相关行业的要求
 |
关键词:
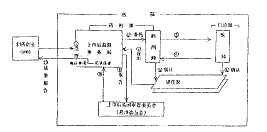
1 新药品上市后监测实施标准的形成与颁布
1.1 日本药品上市后监测制度的建立过程
日本自1967年开始建立药物不良反应监测制度,成立全国性药物监测系统(NDMS),到1979年以立法(收进药事法)手段确立“药品上市后监测制度(PMS)”,乃至1997年3月10日伴随“药事法”修订,厚生省发布的第10号令《关于药品上市后监测的省令》,前后大约用了30余年的时间,日本建立起了一整套药品上市后监测的法规体系,详见表1。
表1 日本药品上市后监测制度的建立
| 年度 | 政 策 |
| 1967 | 成立全国性药物监测系统 ......
您现在查看是摘要页,全文长 10896 字符。 |