Oritavancin破茧化蝶尚需努力
 |
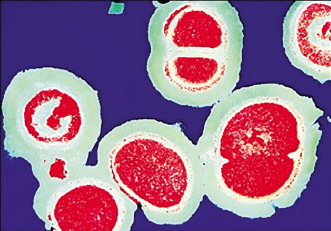 |
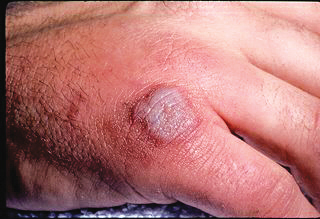
监测结果表明,耐甲氧西林金黄色葡萄珠菌的检出率在某些国家和地区增长很快,在我国一些地区引起的院内感染MRSA的分离率高达80%以上,且出现多重耐药性。
近日,美国Targanta Therapeutics生物制药公司向证交会递交了首发新股(IPO)的申请,计划公开募集8630万美元,主要用于公司的抗生素产品Oritavancin的商业化。
然而,对于投资者来说,如今最大的问题是Oritavancin的开发仍然充满变数,而还有一个不容忽略的事实是,Targanta 公司受让得到Oritavancin的补偿款到目前为止仍未完全支付给原研厂商美国礼来公司。诸多可能产生动荡的现实问题都在提醒投资者:是否值得投资?
1
诞生时机有些不利
总部位于美国马萨诸塞州剑桥市的生物制药公司Targanta主要致力于治疗严重感染性疾病抗生素的开发和商业化,然而如今,公司已越来越明显地感受到了来自众多竞争对手的压力和挑战。
, 百拇医药
随着抗生素市场许多药物逐渐失去专利保护后通用名药物的大量涌入,以及为抑制耐药现象发生而出台种种限用抗生素的措施等,抗生素市场的发展空间和潜力均得到了有效的提升,再加上严重细菌感染领域有效药物的稀缺,使得众多抗生素制药厂商把目光纷纷投向了这一市场,尤其是耐甲氧西林金黄色葡萄球菌(MRSA)感染和复杂性皮肤和皮肤结构感染(cSSSIs)治疗领域,已成为备受瞩目的焦点,这就不可避免地为Targanta公司处于开发晚期的药物Oritavancin带来了不小的压力。
由此看来,Oritavancin需要获得充分的信任以募到8630万美元资金去更深一步地拓展其市场。如今,Targanta正等着与其他15家生物公司一起IPO竞价。在今年已有18家生物公司IPO、平均募资4570万美元的背景下,Targanta的预期是十分乐观的。但由于Oritavancin的开发充满了变数,这导致投资者对其具有的商业潜力疑问重重,尤其对Oritavancin的开发环境表示担忧,而对该化合物的特性等自身因素的考虑甚至还在其次。
, 百拇医药
2
开发屡遭阻力
现阶段,Oritavancin用于治疗皮肤感染、肺炎球菌感染和全身感染的适应症均处于Ⅲ期临床研究阶段。
Oritavancin是第二代糖肽类抗生素,对革兰氏阳性菌有广谱抗菌效果(包括万古霉素耐药细菌)。该品最初由美国礼来公司研制开发,后美国InterMune公司获得了其在全球范围内的开发和市场权利。早在2002年,美国InterMune公司就期望在次年底递交该产品的新药申请(NDA),然而,却由于一些不良反应的原因而被延迟到2004年底。紧接着,美国FDA又以数据不一致为由要求其提供更多数据。随后,2005年,Targanta公司受让得到了Oritavancin的权利。
在将Oritavancin收入囊中之后,Targanta打算利用3年的时间进行研发,并于2007年底提交该品用于治疗复杂性皮肤和皮肤结构感染的新药申请。然而,其开发进程曾经又因缺乏一个有关生物等效性的Ⅰ期临床研究数据而有所停顿。上述种种因素,均会对该药物在专利保护期内的生命周期持续时间产生影响。
, http://www.100md.com
3
竞争对手强大
即便会顺利完成研究并通过批准,Oritavancin还将面对许多已上市的产品的竞争,这其中包括美国辉瑞公司分别于 2000 年和 2003 年推出的利奈唑烷(linezolid,zyvox)、达托霉素(daptomycin,cubicin)以及专利已到期的万古霉素(Vancomycin)等,Oritavancin在其市场进程上将不可避免地面对这些强劲的对手。
此外,许多正处于研发阶段的药物也是不可小觑的竞争力量,如美国Theravance公司的telavancin、瑞士Arpida公司的iclaprim。现阶段,上述两个产品已分别处于注册前和Ⅲ期临床研究阶段。
虽然“前有猛虎后有追兵”,但Oritavancin还是拥有自身的竞争优势的。一方面,其抗菌作用强大而迅速,据Targanta公司研究表明,该品在体内的作用与万古霉素和奎奴普汀/达福普汀(quinupristin+dalfopristin,synercid)相似;另一方面,其对由耐万古霉素肠球菌(VRE)所导致的心内膜炎拥有巨大的治疗潜力。将Oritavancin用于上述适应症的单一治疗是可行的,此外,将来亦可能会用于联合治疗,前景有待发掘。
, 百拇医药
由此看来,Oritavancin的成功将基于两大因素:良好的临床研究数据和在已知领域的治疗优势。但是,所有的成功因素与药物的安全性相比都没有后者来得重要。需要说明的是,在先前进行的研究中,发生的不良反应均与其他药物辅料有关,未有研究证明Oritavancin出现严重的不良反应。
4
须面对审查关口
其实,Targanta公司也可为其首次公开募股方案制定时间表,将其提前到FDA对telavancin作出裁决前。telavancin的审查预计在今年晚些时候完成,且假设其数据也是依据针对复杂性皮肤和皮肤结构感染进行的非劣效性试验(Non-Inferiority Trial)得出的。
不过,美国FDA如何评价非劣效性试验和优效性试验(superiority trial)在整个制药工业来说都是颇有争议的话题。因此,FDA的审查仍是Oritavancin必须要面对的一道关口。
, 百拇医药
Targanta公司曾引用了多个有关FDA同意公司适当使用非劣效性试验的例子,去年又请求Replidyne公司提供其产品法罗培南与该品针对几个适应症的优效性数据;与此同时,一个咨询小组也向Oscient公司甲磺酸吉米沙星(gemifloxacin mesylate,Factive)针对急性细菌性鼻窦炎的适应症提出了类似的请求。
即使Oritavancin不需要额外的试验即能被批准上市,Targanta公司在美国的商业推广计划仍然可能会遭遇一些阻力。尽管该公司包含10人的管理队伍中有5人之前均是来自礼来公司的主管,但由于该产品在医院的销售力量尚且不足,因此,仍需合伙人和许可商的不断补充和壮大。
5
不断挖掘新适应症
由于Oritavancin的作用范围很广,因此,除了积极进行首次公开招股之外,Targanta公司亦在充分挖掘该产品在其他领域的治疗潜力,且如今大多已有了起色。公司计划近期针对复杂性皮肤和皮肤结构感染适应症的非院内治疗进行有关本品的Ⅱ期临床研究,此外,2008年还将进行该品有关菌血症的Ⅲ期临床研究。
, http://www.100md.com
这些新适应症的开发意味着Oritavancin拥有更大的商业潜力。5月24日,Targanta公司又宣布研究了新的发现,即Oritavancin对炭疽杆菌有作用,在预防炭疽热方面拥有潜力,例如在2001年,有22例炭疽患者(其中5例死亡)就是由美国邮政服务携带的炭疽杆菌芽孢所感染。然而,需要指出的是,在炭疽治疗领域,目前已有的几个口服药物均可有效对抗该感染,相对于Oritavancin的静脉内注射剂型来说,老药物的口服剂型甚至更为方便,且费用相对低廉,因此,Oritavancin尽管拥有治疗潜力,却不适宜大举进入炭疽病药物市场。但不可否认,Oritavancin在炭疽方面的治疗潜力亦为其整体市场拓展增添了一抹亮色。
总体说来,Targanta公司为Oritavancin的商业化而作出的种种努力是值得肯定的,因为该品在许多尚未成熟或饱和的市场具有良好的发展潜力,且公司已经成功地将前人在研发进程中“马失前蹄”的局面扭转了过来,并将产品一路开发到有待监管部门评估审核的阶段,实属不易。但是,要顺利得到FDA批准进入市场,Oritavancin还需要一些雄辨的临床研究和评估数据,且最终结果会怎样目前尚无从知晓,此外,Targanta公司仍需要制定一个强大而周密的商业计划,充分挖掘和扩大Oritavancin的发展潜力,才能在未来获得可喜的市场回报。, http://www.100md.com(本报特约撰稿人 郭文)