造血干细胞移植后水肿、尿检异常
 |
 |
病历摘要
患者女性,21岁,因“异基因造血干细胞移植术后2年,水肿、尿检异常4个月,加重2个月”于2007年4月23日入院。
患者于2004年12月因牙龈肿痛、发热,在当地医院经骨髓穿刺后确诊为急性淋巴细胞性白血病,化疗后效果不佳。于2005年4月18日接受异基因造血干细胞移植(allo-HSCT),HLA配型全相合,预处理方案为标准清髓方案+全身放疗,移植过程顺利,骨髓造血功能重建良好,术后用免疫抑制剂治疗。术后1个月患者反复出现广泛皮肤红色丘疹伴口腔溃疡及腹泻,诊断为移植物抗宿主病(GVHD),给予地塞米松冲击治疗(5 mg/d),并调整免疫抑制剂剂量,先后予霉酚酸酯(MMF)、甲氨蝶呤(MTX)、雷帕霉素(Rapa)等治疗,症状好转,期间曾合并背部带状疱疹及肺部感染。术后15个月停用他克莫司(FK506)改环孢素A(CsA)及小剂量泼尼松治疗(图1)。2006年8月起患者皮肤出现散在苔藓样斑片,钱币大小,伴色素沉着,未引起重视。同年12月出现黄疸、转氨酶升高,伴颜面轻度水肿,当时查尿检蛋白(+),肾功能正常,予地塞米松(DEX)冲击、增加CsA剂量并加用硫唑嘌呤(Aza)治疗,患者黄疸消失、肝酶下降,水肿消失,未复查尿检。2007年2月停用CsA,仅小剂量Aza(25 mg/d)及泼尼松(5 mg/d)治疗,逐渐出现颜面、双下肢水肿,伴有眼干,皮肤苔藓样病变加重,呈地图样改变,逐渐累及四肢躯干,色素沉着明显。当地医院查尿蛋白4.19 g/24 h,隐血(+),再次给予泼尼松(45~50 mg/d)及Aza(50 mg/d)治疗,期间给予甲泼尼龙(MP)冲击(160 mg/d,静滴3天)及口服中药汤剂治疗,治疗3周后尿检无改善,因仍有大量蛋白尿、低蛋白血症,为进一步诊治收住入院。既往史、个人史、家族史无特殊。
, 百拇医药
体格检查 生命体征正常,轻度贫血貌,全身皮肤呈花斑样苔藓样改变,表面有陈旧色素沉着,右手腕关节及手背皮肤发硬。巩膜无黄染,结膜略苍白,未见口腔黏膜破溃,咽不红,扁桃体不大。心肺听诊未见异常,腹膨隆,无压痛反跳痛,肝脾肋下未触及,移动性浊音(+)。双下肢中度凹陷性水肿。
实验室检查
血常规Hb 10.8 g/dl,WBC 8700/mm3,Plt 14.8万/mm3。外周血淋巴细胞计数:CD4+细胞508个/μl,CD8+细胞1208个/μl,CD20+细胞134个/μl。
尿液检查:尿沉渣RBC计数18万/ml(多形型),24小时尿蛋白定量为3.27 g(大分子21.4%,中分子61.6%,小分子18%),C3 4 mg/L,α2M 3.01mg/L,NAG酶94.9 U/g.Cr,视黄醇结合蛋白(RBP) 0.6 mg/L,β2微球蛋白0.8 mg/L,尿渗量540 mOsm/kg·H2O,尿溶菌酶正常,尿糖、尿氨基酸定量正常。
, 百拇医药
粪常规:未见异常。
血生化检查:白蛋白(Alb)21.2 g/L,球蛋白(Glo) 19.4 g/L,丙氨酸转氨酶(ALT) 74 U/L,天冬氨酸转氨酶(AST) 55 U/L,半胱氨酸(CysC) 1.85 mg/L,尿素氮(BUN) 19.4 mg/dl,血肌酐(Scr) 0.6 mg/dl,尿酸(UA) 303 μmol/L,总胆固醇(Chol) 14.05 mmol/L,甘油三酯(TG) 1.75 mmol/L。口服葡萄糖耐量试验(OGTT):空腹血糖6.2 mmol/L,早餐后2小时血糖为12.4 mmol/L。霉酚酸酯浓度测定:霉酚酸12小时曲线下面积(AUC0-12 h)为29.83 mg·h/L。
免疫学检查:免疫球蛋白IgG 5.49 g/L,IgA 1.16 g/L,IgM 3.3 g/L;补体C3、C4正常;自身抗体阴性,抗中性粒细胞胞浆抗体(ANCA)阴性,抗心磷脂抗体谱IgM 25.7 U/ml,ENA多肽抗体谱阴性;乙肝二对半阴性。
, 百拇医药
辅助检查:双肾体积(LK/RK):(111×41×55)mm/(107×45×53)mm,皮质厚度不清,余结构正常。心电图:窦性心律,T波改变(I、avL、V2-V4切迹、低平、双向)。肝胆胰脾超声:胆囊继发性改变,腹水。腹水检查为漏出液。X线胸片、甲状腺超声、眼底检查未发现明显异常。
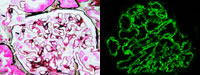
肾活检:部分小球呈缺血皱缩状。余小球脏层上皮细胞肿胀,外周袢略显僵硬,节段系膜区增宽,囊壁节段增厚、分层伴节段壁层上皮细胞增生。PASM-Masson:外周袢上皮侧少量细颗粒样嗜复红物沉积,偶见“钉突”形成(图2,×400)。肾小管间质轻度慢性病变,多处灶性肾小管萎缩、基膜增厚,部分非萎缩小管肥大,灶性间质增宽、纤维化,小灶性浸润细胞,管腔内少量蛋白管型。小动脉透明变性,多处增厚、闭锁。
免疫荧光示IgG++、IgA+、IgM+、C3++、C4+、C1q+,弥漫分布,呈颗粒状弥漫分布血管袢(图3,×400)。IgG、C3、C1q小管基膜弥漫阳性。
, 百拇医药
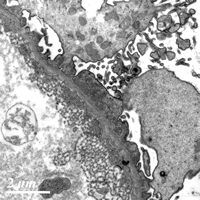
电镜下见1个肾小球(图4),节段肾小球基膜膜上见大小不一、中等电子密度的致密物,有的致密物间见基膜样物质将致密物包饶,节段基膜膜上未见电子致密物,一处内皮下亦见电子致密物。肾小球内内皮细胞胞浆连拱状,足细胞肿胀,足突广泛融合、增厚,少量微绒毛化,胞浆内见肿胀的线粒体。
诊断 异基因造血干细胞移植术后,移植物抗宿主病相关性肾损害(肾小球膜性病变)
治疗经过及随访情况
患者为青年女性,allo-HSCT术后20个月出现肾脏损害,临床表现为肾病综合征(NS),无高血压、肾功能损害,院外已予甲泼尼龙冲击,泼尼松治疗(45~50 mg/d)及Aza(50 mg/d)/MMF(1.5 g/d)治疗3周,尿检无改善,尿蛋白仍达3.27 gd/24h,伴低蛋白血症。患者入院后第4日行肾活检,病理诊断为肾小球膜性病变,结合患者骨髓移植术后反复多次出现GVHD,累及皮肤、口腔黏膜、肝脏、消化道,经免疫抑制剂治疗症状改善,术后20个月免疫抑制剂减量后出现肾脏损害,同时伴有皮肤苔藓样变、眼干等GVHD症状,诊断为GVHD相关性肾损害(肾小球膜性病变)。因患者肾脏小管间质损害较重(尿NAG酶、RBP升高,尿渗量降低,病理上存在慢性化病变),同时存在糖代谢异常,故未予FK506及CsA治疗,撤减激素,继续MMF(1.25 g/d)治疗,并加用雷公藤多苷(TW,90 mg/d)。随访1个月后,患者尿蛋白定量由3.27 g/24h降至1.08 g/24h,随访3个月时MMF减量至0.5 g/d,泼尼松10 mg/d,TW90 mg/d,尿蛋白降至0.56g/d,肝酶降至正常,皮肤苔藓样改变明显好转,色素沉着减轻。
, http://www.100md.com
诊断分析
本例患者具有以下临床特点:(1)青年女性,因白血病行allo-HSCT手术,移植前无肾脏病史;(2)allo-HSCT术后反复多次出现GVHD,累及皮肤、口腔黏膜、胃肠道及肝脏等系统,多次调整免疫抑制剂治疗;(3)肾脏病变于术后第20个月免疫抑制剂减量后出现;(4)出现肾脏病变时,皮肤黏膜呈苔藓样病变,地图状分布并累及四肢躯干,伴色素沉着、眼干;(5)肾脏病变表现为肾病综合征(NS),无明显镜下血尿,血压、肾功能正常;病理改变为肾小球膜性病变;(6)肾脏病变对免疫抑制剂治疗反应较好;(7)病史中无关节痛、光敏感、不规则发热、口干等症状。
allo-HSCT是治疗白血病的有效手段,对于白血病、allo-HSCT术后出现肾脏病变的患者,应从以下几个方面进行鉴别诊断:
白血病肾损害:白血病属于造血系统恶性疾病,白血病肾损害多为白血病细胞的直接浸润或代谢物导致肾脏损伤,也可通过免疫反应、电解质紊乱损伤肾脏。临床表现为梗阻性肾病、NS或肾炎综合征、急慢性肾功能不全。本例患者在术前无肾脏受累,术后骨髓造血功能重建良好,肾组织病理上未见白血病细胞浸润,故不支持白血病肾损害。
, http://www.100md.com
药物导致的肾损害:大剂量抗肿瘤药物会破坏体细胞,产生大量尿酸,引起高尿酸血症,导致急性肾损害,本例患者无急性肾损害表现,亦无高尿酸血症,故不支持化疗药物所致的肾脏损害;抗生素可造成急性间质性肾炎或急性肾小管坏死,本例患者肾活检未见明确的小管间质急性病变,也不支持抗生素导致的肾损害;一些药物如青霉胺、金制剂、巯甲丙脯酸等可导致膜性病变,本例患者未使用过上述药物;本例患者在移植后接受FK506和CsA治疗,应注意有无CsA导致的肾中毒,尽管本例患者未提供具体的CsA血药浓度,但肾脏病理上未见间质小管及血管病变,亦不考虑CsA造成的肾损害。
移植物抗宿主病:allo-HSCT不同于实体器官移植,不仅存在宿主抗移植反应,还存在移植物抗宿主反应。本例患者在骨髓移植术后1个月即出现GVHD,反复累及多个脏器系统,包括皮肤、口腔黏膜、胃肠道、肝脏等,经免疫抑制剂治疗后,症状明显改善。术后第20个月撤减免疫抑制剂后出现肾小球膜性病变,同时皮肤病变加重伴有口干等GVHD症状,加强免疫抑制剂治疗后,肾脏及皮肤病变改善。因此考虑该患者肾脏病变继发于GVHD,故诊断为GVHD相关性肾损害(肾小球膜性病变)。
, 百拇医药
讨 论
造血干细胞移植(HSCT)是治疗白血病的有效方法,根据干细胞来源的不同,可分为自体、同基因和异基因HSCT,目前临床上采用的主要是allo-HSCT。1958年Mathe等首先将HSCT用于临床,目前HSCT除了治疗造血系统肿瘤、再生障碍性贫血外,还用于自身免疫性疾病、免疫缺陷病和某些非造血系统肿瘤等疾病的治疗。
移植物抗宿主病(GVHD)是allo-HSCT术后的主要并发症,严重影响allo-HSCT患者的长期生存。GVHD不同于实体器官移植中的排斥反应,它是由移植物中淋巴细胞(主要是T细胞)识别宿主抗原而致敏、增殖、分化,直接或间接攻击受者靶组织而发生的一种排异反应。GVHD的发病机制是一个复杂过程,涉及多种细胞因子、炎症介质和免疫细胞,其中T淋巴细胞在GVHD的病理过程中起着重要作用,细胞因子是诱导和维持GVHD的中心环节。GVHD主要是由于人类白细胞抗原(HLA)不完全相容造成的,在主要组织相容性抗原相容的情况下,由次要组织相容性抗原决定的。
, http://www.100md.com
GVHD分为急性GVHD(aGVHD)和慢性GVHD(cGVHD)。aGVHD通常在骨髓移植后100天内发生,cGVHD可以是aGVHD的延续或在移植100天后直接出现。aGVHD的发病率高达30%-80%,多累及皮肤、肝脏、消化道等器官,可引起皮肤、肝脏和消化道上皮细胞坏死,临床表现为皮肤局部或全身性斑丘疹,黄疸、肝酶升高或口腔溃疡、腹泻、血便等。根据皮肤、肝脏及消化道受累程度,分为1-4级。cGVHD的发病率为60%~70%,依次累及皮肤(65%~80%)、口腔(48%~72%)、肝脏(40%~73%)、眼(18%~47%)、胃肠道/体重下降(16%~26%),肺(10%~15%)、食道(6%~8%)和关节(2%~12%)。在某些患者,cGVHD的临床症状与一些自身免疫性疾病如系统性硬化、干燥综合征、原发性胆汁性肝硬化或多发性肌炎等类似或相关。cGVHD的发生时间,在HLA一致的同胞移植中为4.5个月,而在不相干供体中为4个月,仅5%患者在1年后出现。allo-HSCT 患者出现皮疹、腹泻和肝酶异常等临床症状时,首先要排除感染和药物因素的影响,虽然时间对于诊断急、慢性GVHD有重要意义,但临床表现的差异、受累脏器系统和组织学改变比时间更有价值。aGVHD的表现可以在移植后100天开始,典型的cGVHD也可在100天内发生,或与aGVHD并存,因此诊断cGVHD必需要有其特征性改变,如皮肤苔藓样改变、色素沉着、干眼、硬皮病或闭塞性细支气管炎等。本例患者在移植后1个月即出现aGVHD,累及多个系统脏器,包括皮肤、口腔、肝脏和消化道,典型的cGVHD皮肤改变(皮肤苔藓样改变,色素沉着)出现在移植术后16个月并伴有眼干等症状。
, 百拇医药
Allo-HSCT术后出现肾脏损害较少见,Brukamp等发现1218例HSCT患者中,NS的发生率仅为3.8%,Imai等总结了日本2136例HSCT患者,有51例合并NS(2.4%)。国内郭红最早报道了骨髓移植后与GVHD相关的膜性肾病,目前正式的报告仅有12例。allo- HSCT并发NS通常具有以下一些特点:(1)多发生于allo-HSCT术后2~62月(平均17月),在免疫抑制剂减量或停用后的1~9个月(平均3.6个月)出现;(2)大多数的患者有aGVHD病史,在出现NS时常伴有cGVHD的其他表现;(3)肾脏损害表现为大量蛋白尿,多数达NS程度,镜下血尿不明显,肾功能大多正常;(4)常见的病理改变为膜性病变和微小病变型,局灶节段性肾小球硬化、IgA肾病等少见,国内报道的12例allo-HSCT术后NS患者有9例经肾活检证实为膜性病变;(5)肾脏病变的预后与病理类型有关,经免疫抑制治疗后,微小病变性肾病完全缓解率可达90%,而膜性病变完全缓解率仅为27%。
尽管目前GVHD与NS之间的病理生理关系尚不很清楚,但多数学者一致认为HSCT术后出现NS是GVHD的一种表现。Terrier1等报道allo-HSCT术后出现的膜性肾病,多在移植后17~37个月出现,临床表现为NS,肾功能正常,光镜下细胞增生较少,小管间质和血管病变轻重不等,免疫荧光以IgG1沉积为主,少数可有IgG4或IgG3沉积。本例患者在术后20个月撤减免疫抑制剂后出现肾脏膜性病变,同时伴有皮肤改变、眼干等cGVHD症状,诊断为GVHD相关性肾损害(肾小球膜性病变)。在我国,膜性病变以继发性占主导,常见原因有以下四类:自身免疫性疾病、感染性疾病、肿瘤或药物等。本例患者通过相关检查先后排除了自身免疫性疾病、乙肝相关性肾炎、肿瘤或及药物导致的膜性病变,根据移植后反复多次出现GVHD的发生,在撤减免疫抑制剂时出现肾小球膜性病变,并伴有皮肤改变、眼干等cGVHD症状,对免疫抑制剂治疗有效,考虑肾脏病变是cGVHD的一种表现。
, http://www.100md.com
新近关于膜性肾病的发生机制中认为人类足细胞表面抗原如:二肽基肽酶IV (IV)和中性肽链内切酶(NEP)可能参与了人体膜性肾病的发生。同种异体免疫反应如肾移植和HSCT也会导致受者发生肾脏疾病。关于HSCT后出现膜性肾病的机制尚不清楚,可能是供体的T 淋巴细胞对受者HLA 或非HLA 抗原的不相容性,使移植物中T淋巴细胞活化,促使B细胞产生自身抗体,作用于足细胞表现的相关蛋白,从而引起原位免疫复合物,导致膜性病变产生。动物试验发现cGVHD动物模型中,不仅可见免疫复合物的沉积,同时还发现多种自身抗体,如IgG自身抗体、抗肾小管上皮细胞抗体等。本例患者外周血中CD8+淋巴细胞显著增多,提示存在异常增殖的T淋巴细胞,并可见ACL抗体阳性。
GVHD是影响allo-HSCT远期预后的主要原因,因此需要积极有效地预防和治疗GVHD。移植前HLA配型及术前去除T细胞均可明显降低GVHD的发生率。MTX和CsA是治疗GVHD最有效的药物,可减少黏膜炎,预防GVHD,短期MTX和长期CsA对治疗Ⅲ~Ⅳ级的GVHD效果最佳,但长期应用CsA 易导致移植相关性微血管病。近10年来FK506和Rapa也用于GVHD的预治中,FK506/ MTX方案优于CsA/MTX方案,副作用小,复发率低。糖皮质激素和CsA是治疗aGVHD的首选药物,其次可选用MMF、Rapa、IL-2受体拮抗剂或抗淋巴细胞单克隆抗体。多数用于aGVHD的药物也用于cGVHD的治疗,此外一些新型的免疫抑制剂如沙利度胺(反应停)、利妥昔单抗也用于cGVHD的治疗。本例患者在治疗过程中虽然采用多种免疫抑制,仍反复出现GVHD,包括急性、慢性GVHD,累及器官多,程度重,提示预后较差。GVHD相关性肾损害的治疗与GVHD一样,亦采用免疫抑制剂治疗,与原发性膜性肾病相比,它对免疫抑制剂的反应较好。Terrier报告5例HSCT后膜性肾病患者,分别采用激素和CsA、或Aza、苯丁酸氮芥、利妥昔单抗治疗,其中2例完全缓解,1例部分缓解,仅1例无效。本例膜性病变患者经MMF联合TW治疗后,不仅尿蛋白明显减少,而且cGVHD的临床症状也明显改善,皮肤苔藓样改变明显好转,色素沉着减轻。
小 结
GVHD是allo-HSCT术后最常见的并发症,通常累及皮肤黏膜、肝脏和消化道,而对allo-HSCT术后合并肾脏病变的研究较少。本文通过对表现为肾脏受累的GVHD患者的临床及肾脏病理改变进行了分析,加深了对GVHD临床表现的认识,也为进一步深入探讨膜性肾病新的发病机制提供了新的线索。, 百拇医药