HBxAg和p53蛋白结合在原发性肝癌发生中的意义
作者:朱明华 M.A.Feitelson W.T.London
单位:710032 西安市,第四军医大学病理学教研室(朱明华);美国费城Fox Chase癌症中心(M.A.Feitelson W.T.London)
关键词:基因,p53;乙型肝炎病毒;肝肿瘤;基因调节
中华医学杂志930602 摘要 为探讨p53基因改变与HBV之间是否存在相互作用关系,研究了13例配对肝癌标本。分别应用Southern杂交测定和HBV DNA在组织中的整合状态,免疫组化检测HBsAg、HBcAg和HBxAg的表达,聚合酶链反应并限制性酶切确定p53基因第七外显子点突变,免疫沉淀和Western印迹确定HBxAg和p53蛋白的关系。结果13例样本中9例存在HBV整合或复制,8例检测到HBsAg、HBxAg或HBcAg的表达,p53基因229、247和249三个编码子无一例存在点突变。应用抗HBxAg抗体免疫沉淀,抗p53抗体作Western印迹,7例在53000处出现p53蛋白反应带。用抗p53抗体免疫沉淀,抗HBxAg抗体作Western印迹,5例在13000、17000或28000处出现HBxAg反应带。表明HBxAg与p53蛋白可以互相结合,在与HBV感染有关的肝癌发生中具有重要意义。
, http://www.100md.com
原发性肝癌(PHC)的发生与HBV感染密切相关,但对HBV致癌的确切他子生物学机制并不清楚。近年来,分子遗传学和分子生物的研究发现,PHC的发生与肿瘤抑制基因p53等位基因的丢失有关〔1,2〕,特别是p53基因第249编码子点突变在PHC有较高的发生频率〔3,4〕,但这些变化在与HBV感染密切相关的PHC并不显著〔5,6〕。HBV与逆转录病毒具有进化起源上的同源性〔7〕,HBx基因的编码蛋白亦具有反式激活功能〔8〕,转基因鼠实验证明HBx可以直接引发PHC〔9〕。作者假设HBV的致癌作用是否通过HBx编码蛋白影响或调节p53基因的功能,类似于腺病毒、多瘤病毒与p53和RB基因的关系。为此,我们应用免疫沉淀和Western印迹方法,分别研究了HBxAg与p53蛋白的关系,并应用Southern杂交、免疫组化定位检测PHC组织中HBV整合状态及其产物的表达,应用聚合酶链扩增分析了p53基因第七外显子的突变频率。
, 百拇医药
材料和方法
一、组织标本
13例PHC患者的癌及癌旁肝组织为手术切除标本。2例非肝病死亡者尸检肝和1例正常分娩者的胎盘组织用作正常对照。全部组织-80℃贮存备用。8例血清学检查HBsAg阳性,13例癌旁肝组织均伴有结节性肝硬化。全部病例来源于西北地区,为黄曲霉毒素低含量区。肝母细胞瘤细胞株HepG2及HBV转染细胞HepG2.2.15由美国Fox Chase癌症中心提供,细胞按常规培养,收集2×107细胞备用。
二、DNA提取与Southern杂交
取冻存组织3g,研碎,采用蛋白酶K消化,饱和酚-氯仿抽提法提取DNA,尸检肝和胎盘按提取。取8μgDNA经EcoRI或HindIII酶切后琼脂糖凝胶电泳,按常规转印DNA于尼龙膜(Life Science)并预杂交。HBV全基因(adr)用[32P]dCTP(Dupont)随机引物延伸标记法标记,与转印膜杂交,洗膜后对柯达X线底片自显影。
, 百拇医药
三、HBx基因与胎盘DNA杂交
取胎盘DNA各5μg,分别用EcorI、Hind III、PstI、PVUI、BanHI、Bg1II、HaeIII、HincII、KpnI、MspI、TaqI、Bc1I、XbaI、RsaI、ApaI、NcoI、AVaII和SacI(New England Biolabs)酶切后常规电泳,转印,预杂交。用[32P]dCTP标记HBx基因片段(483bp)在低离子强度条件下杂效,洗膜后对柯达X线底片自显影。
四、HBxAg、HBcAg和HBsAg免疫组化染色
10%甲醛固定,石醋包埋肝癌及癌旁肝组织,切片5μm厚。抗HBxAg抗体为美国Fox Chase癌症中心提供〔10〕,ABC试剂盒购自美国Vector实验室。抗HBcAg、抗HBsAg抗体和PAP试剂盒购自美国Biogenex实验室。ABC和PAP法按常规进行。
, 百拇医药
五、p53第七外显子分析
应用聚合酶边反应(PCR)扩增,引物序列为P1:5′-TCTCCTAGGGTTGGCTCTGAGTG-3′;P2:5-GCAAGTGGCTCCTGACCTGGA-3′。扩增片段长195个核苷酸对。PCR产物分别用RsaI,MspI和HaeIII酶切,检测第229、247和249编码子有无点突变。
六、免疫沉淀和Western印迹
取癌及癌旁肝组织各3g,制作匀浆,加入PBSTDS缓冲液(1mol/L Na2HPO410ml,pH7.2;NaCl9g;Triton X-100 10ml;脱氧胆盐5g;SDS 1g;叠氮化钠2g;加水至1000ml,pH7.25)3ml,4℃30分钟,1500r/min离心15分钟,留上清再离心14000r/min 1小时,取上清备用。
, http://www.100md.com
取1.5ml塑料离心管,加入14μgIgG(美国Pierce公司),1μg抗p53单克隆抗体(Ab2,Oncogene Science)或抗HBxAg单克隆抗体(Wc9-85,Fox Chase癌症中心提供),4℃孵育过夜。3000r/min离心15分钟,弃上清,沉淀用PBSTDS洗2次,最后溶于样本缓冲液供电泳。电泳采用12%SDS-聚丙烯酰胺凝胶不连续缓冲系统。电泳后凝胶进行电转移,印迹蛋白于1mmobilon-P(美国Millipore公司)膜,5%无脂牛奶/TBS缓冲液室温封闭膜后加入第一抗体(p53或抗HBxAg抗体),2小时后洗膜,加过氧化物酶标记杭体,室温1小时,洗膜后用ECL(Amersham)显色系统显色。HepG2、尸检肝和胎盘组织为阴性对照,HepG2.2.15作阳性对照。
结 果
一、HBV全基因Southern杂交
13例PHC患者中9例的配对样本中出现杂交带,其中7例癌及癌旁组织同时出现阳性杂效带,1全仅癌组织,另1例仅癌旁组织中出现杂交带。8例癌组织中出现杂效带的患者中7例表现为整合型,1例为整合并复制型。8例癌旁组织中出现杂效带的患者中5例表现为整合型,1例为整合并复制型,2例为单纯复制型(图1)。9例中8例为血清HBsAg阳性。
, http://www.100md.com
图1 HBV全基因杂交病例1、2、5,肿瘤组织以整合型为主;
例7整合并复制;例9高度复制
二、HBx基因与胎盘DNA杂交
胎盘DNA经18种内切酶消化后用HBx基因杂交,未出现任何杂交带,表明人基因组DNA不存在与HBx基因同源的序列。
三、免疫组化染色
HBsAg 6例阳性,HBcAg 1例阳性 ,HBxAg 8例阳性,其中1例HBxAg阳性位于细胞核(图2)。
图2 抗HBxAg抗体染色,细胞核阳性×100
, 百拇医药 四、p53第七外显子分析
13例癌及癌旁组织DNA经PCR扩增后,均能被RsaI、MspI和HaeIII酶切成相应的电泳带,表明在这三个编码子无点突变(图3)。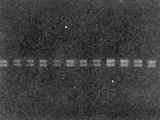
图3 p53第七外显子PCT扩增后均能被HeaIII酶切
五、免疫沉淀和Western印迹分析
应用Wc9-85免疫沉淀,兔抗HBxAg染色,7例分别在13000、17000或28000处出现特异性带(图4A);Ab2免疫沉淀,兔抗HBxAg染色,6例在13000、17000或28000处出现阳性反应带(图4B);Wx9-85免疫沉淀,Ab2染色,7例在53000处出现特异性反应带(图4C)。HepG2.2.15亦出现相应的反应带(图4D),HepG2、尸检肝和胎盘组织未出现特异性反应带。结果初步证明p53蛋白能与HBxAg相互结合形成复合物(附表)。
, http://www.100md.com
图4 A:抗HBxAg免疫沉淀和免疫印迹,28000和17000处显示反应带;B:p53免疫印迹,17000和13000处显示反应带,2例尸检肝对照阴性(3,4);C:抗HBxAg免疫沉淀,p53免疫印迹,53000处显示反应带,胎盘组织阴性(3);D:同c、HepG2细胞阴性(1),HepG2.2.15在53000处显示反应带(2)
附表 HBV-DNA杂交、免疫组化和免疫沉淀结果
例号
HBV-DNA
免疫组化
免疫沉淀和Western印迹
HBsAg
HBcAg
, http://www.100md.com
HBxAg
HBxAg-p53
p53-HBxAg
HBxAg-HBxAg
1
+
+
-
+
53
17,28
17,28
2
, 百拇医药
+
+
-
+
53
17
13,17
3
-
-
-
-
-
-
, 百拇医药
-
4
-
-
-
-
-
-
-
5
+
+
-
+
, 百拇医药
53
17
13,17
6
+
-
-
-
-
-
17
7
+
-
, http://www.100md.com
-
+
53
17
17
8
+
-
-
-
-
-
-
9
, 百拇医药
+
+
+
+
53
17
17,28
10
-
-
-
+
-
-
, 百拇医药
-
11
+
+
-
+
53
ND
ND
12
+
+
-
+
, 百拇医药
53
13,17
13,17
13
-
-
-
-
-
-
-
讨 论
HBV感染者发生PHC的危险性高于无感染者200倍以上,其有关机制之一认为在HBV慢性感染过程中,整合到宿主细胞,并通过插入、重排等变化,使癌基因活化或抑癌基因失活,导致细胞恶性转化。然而不少研究表明,HBV自身不具有病毒癌基因的作用,也未发现HBV整合与任何已知的癌基因有关〔11,12〕。在整合位点和形式上也没有特征性。限制性酶片段长度多态性分析,发现PHC等位基因丢失涉及到18对染色体的不同基因位点。Hsu等的研究发现,p53基因第249编码子存在一个与PHC密切相关的点突变〔3,4,13〕,但不同人群或不同地区的PHC研究结果差异很大〔5,6〕。作者假设HBV与PHC的关系,可能存在蛋白水平上的调节机制。文献报告HBV与逆转录病毒在进化起源上具有同源性〔7〕,HBx基因编码蛋白具有反式激活作用〔8〕。免疫组化发现36%~50%HBxAg阳性物质定痊于细胞核〔14〕,p53蛋白属于核磷酸化蛋白,并具有蛋白质-DNA结合的特性,在HBxAg与p53之间,是否以结合的形式在蛋白水平上对p53起调节作用,类似于多瘤病毒、腺病毒及乳头状瘤病毒与p53和RB基因之间的关系〔15〕。本实验结果显示,本组病例与HBV感染密切相关,但p53第七外显子的三个编码子无点突变存在,而免疫沉淀和Western印迹分析,证明HBxAg与p53蛋白可以相互结合形成复合物,从蛋白水平上对p53进行调节,可能是HBV引发PHC的重要机制之一。本文结果还显示,p53与HBxAg的结合,主要是17000的HBx表达蛋白,应用p53免疫沉淀,HBxAg抗体染色,较少出现13000和28000的反应带,提示17000蛋白是与p53结合的主要功能蛋白。
, 百拇医药
我们认为,与HBV和黄曲毒毒素双重因素有关的PHC,p53的变化主要在DNA水平,包括等位基因丢失和突变,而以HBV感染为主要因素的PHC,其发生机制则可能通过HBx蛋白与p53蛋白的结合,进而调节并影响p53基因的功能,破坏的p53基因负调节作用,导致细胞的恶性转化。对HBxAg与p53蛋白的结合形式及调节机制尚待进一步研究。
参考文献
1.Bressac B,Galvin KM,Liang TJ,et al.Abnormal structure and expression of p53 gene in human hepatocellular carcinoma.Proc Natl Acad Sci USA.1990,87:1973.
2.Murakami Y,Hayashi K,Hirohashi S,et al.Aberration of the tumor suppressor p53 and retinoblastoma genes in human hepatocellular carcinomas.Cancer Res,1991,51;5520.
, http://www.100md.com
3.Hsu IC,Metcalf RA,Sun T,et al.Mutational hotspot in the p53 gene in human hepatocellular carcinoma.Nature 1991,350:427.
4.Bressac B,Kew M,Wands J,et al.Selective G to T muttion of p53 gene in hepatocellular carcinoma from Southern Africa.Nature,1991,350:429.
5.Hosono S,Lee CS,Chou MJ,et al.Molecular analysis of the p53 alleles in primary hepatocellular carcinoma and cell lines.Oncogene,1991,6:237.
, http://www.100md.com
6.Hayward NK,Walker GJ.Hepatocellular carcinoma mutation.Nature,1991,352:764.
7.Miller RH,Robinson WS.Common evalutionary origin of hepatits B virus and retroviruses.Proc Natl Acad Sci USA,1986,83:2531.
8.Zahm P,Hofschneider PH,Koshy R.The HBV X-ORF encodes a transactivator:a potential factor in viral hepatocarcinogenesis.Oncogene,1988,3:169.
9.Kim CM,Koike K,Saito I,ea al.HBx gene of hepatitis B virus induces liver cancer in transgenic mice.Nature,1991,351:317.
, 百拇医药
10.Feitelson MA,Clayton MM,Blumberg BS.The X antigen/antibody markers in hepadnavirus infections.I presecn and signifcance of the hepadnavirus X gene products in serum.Gastroenterology,1989,98:1071.
11.Dejean A,De The H.Hepatitis B virus as an insertional mutagene in a human hepatocellular carcinoma.Mol Biol Med,1990,7:213.
12.Robinson W,Klote L,Aoki N.Hepadnaviruses in cirrhotic liver and hepatocellular carcinoma.J Med Virol,1990,31:18.
, 百拇医药
13.Scorsone KA,Zhou YZ,Butel JS,et al.p53 mutations cluster at codon 249 in hepatocellular carcinoma from China.Cancer Res,1992,52:1635.
14.Wang W,London WT,Feitelson MA.Hepatitis B x antigen in hepatitis B virus carrier patients with liver cancer.Cancer Res.1991,51:4971.
15.Lane DP.Oncogenes of the DNA tumor viruses:their interaction with host proteins.In: Glover DM,Hames BD,eds.Oncogenes.Oxford University press,1989:191-215.
(收稿:1992-09-14 修回:1993-03-24), 百拇医药
单位:710032 西安市,第四军医大学病理学教研室(朱明华);美国费城Fox Chase癌症中心(M.A.Feitelson W.T.London)
关键词:基因,p53;乙型肝炎病毒;肝肿瘤;基因调节
中华医学杂志930602 摘要 为探讨p53基因改变与HBV之间是否存在相互作用关系,研究了13例配对肝癌标本。分别应用Southern杂交测定和HBV DNA在组织中的整合状态,免疫组化检测HBsAg、HBcAg和HBxAg的表达,聚合酶链反应并限制性酶切确定p53基因第七外显子点突变,免疫沉淀和Western印迹确定HBxAg和p53蛋白的关系。结果13例样本中9例存在HBV整合或复制,8例检测到HBsAg、HBxAg或HBcAg的表达,p53基因229、247和249三个编码子无一例存在点突变。应用抗HBxAg抗体免疫沉淀,抗p53抗体作Western印迹,7例在53000处出现p53蛋白反应带。用抗p53抗体免疫沉淀,抗HBxAg抗体作Western印迹,5例在13000、17000或28000处出现HBxAg反应带。表明HBxAg与p53蛋白可以互相结合,在与HBV感染有关的肝癌发生中具有重要意义。
, http://www.100md.com
原发性肝癌(PHC)的发生与HBV感染密切相关,但对HBV致癌的确切他子生物学机制并不清楚。近年来,分子遗传学和分子生物的研究发现,PHC的发生与肿瘤抑制基因p53等位基因的丢失有关〔1,2〕,特别是p53基因第249编码子点突变在PHC有较高的发生频率〔3,4〕,但这些变化在与HBV感染密切相关的PHC并不显著〔5,6〕。HBV与逆转录病毒具有进化起源上的同源性〔7〕,HBx基因的编码蛋白亦具有反式激活功能〔8〕,转基因鼠实验证明HBx可以直接引发PHC〔9〕。作者假设HBV的致癌作用是否通过HBx编码蛋白影响或调节p53基因的功能,类似于腺病毒、多瘤病毒与p53和RB基因的关系。为此,我们应用免疫沉淀和Western印迹方法,分别研究了HBxAg与p53蛋白的关系,并应用Southern杂交、免疫组化定位检测PHC组织中HBV整合状态及其产物的表达,应用聚合酶链扩增分析了p53基因第七外显子的突变频率。
, 百拇医药
材料和方法
一、组织标本
13例PHC患者的癌及癌旁肝组织为手术切除标本。2例非肝病死亡者尸检肝和1例正常分娩者的胎盘组织用作正常对照。全部组织-80℃贮存备用。8例血清学检查HBsAg阳性,13例癌旁肝组织均伴有结节性肝硬化。全部病例来源于西北地区,为黄曲霉毒素低含量区。肝母细胞瘤细胞株HepG2及HBV转染细胞HepG2.2.15由美国Fox Chase癌症中心提供,细胞按常规培养,收集2×107细胞备用。
二、DNA提取与Southern杂交
取冻存组织3g,研碎,采用蛋白酶K消化,饱和酚-氯仿抽提法提取DNA,尸检肝和胎盘按提取。取8μgDNA经EcoRI或HindIII酶切后琼脂糖凝胶电泳,按常规转印DNA于尼龙膜(Life Science)并预杂交。HBV全基因(adr)用[32P]dCTP(Dupont)随机引物延伸标记法标记,与转印膜杂交,洗膜后对柯达X线底片自显影。
, 百拇医药
三、HBx基因与胎盘DNA杂交
取胎盘DNA各5μg,分别用EcorI、Hind III、PstI、PVUI、BanHI、Bg1II、HaeIII、HincII、KpnI、MspI、TaqI、Bc1I、XbaI、RsaI、ApaI、NcoI、AVaII和SacI(New England Biolabs)酶切后常规电泳,转印,预杂交。用[32P]dCTP标记HBx基因片段(483bp)在低离子强度条件下杂效,洗膜后对柯达X线底片自显影。
四、HBxAg、HBcAg和HBsAg免疫组化染色
10%甲醛固定,石醋包埋肝癌及癌旁肝组织,切片5μm厚。抗HBxAg抗体为美国Fox Chase癌症中心提供〔10〕,ABC试剂盒购自美国Vector实验室。抗HBcAg、抗HBsAg抗体和PAP试剂盒购自美国Biogenex实验室。ABC和PAP法按常规进行。
, 百拇医药
五、p53第七外显子分析
应用聚合酶边反应(PCR)扩增,引物序列为P1:5′-TCTCCTAGGGTTGGCTCTGAGTG-3′;P2:5-GCAAGTGGCTCCTGACCTGGA-3′。扩增片段长195个核苷酸对。PCR产物分别用RsaI,MspI和HaeIII酶切,检测第229、247和249编码子有无点突变。
六、免疫沉淀和Western印迹
取癌及癌旁肝组织各3g,制作匀浆,加入PBSTDS缓冲液(1mol/L Na2HPO410ml,pH7.2;NaCl9g;Triton X-100 10ml;脱氧胆盐5g;SDS 1g;叠氮化钠2g;加水至1000ml,pH7.25)3ml,4℃30分钟,1500r/min离心15分钟,留上清再离心14000r/min 1小时,取上清备用。
, http://www.100md.com
取1.5ml塑料离心管,加入14μgIgG(美国Pierce公司),1μg抗p53单克隆抗体(Ab2,Oncogene Science)或抗HBxAg单克隆抗体(Wc9-85,Fox Chase癌症中心提供),4℃孵育过夜。3000r/min离心15分钟,弃上清,沉淀用PBSTDS洗2次,最后溶于样本缓冲液供电泳。电泳采用12%SDS-聚丙烯酰胺凝胶不连续缓冲系统。电泳后凝胶进行电转移,印迹蛋白于1mmobilon-P(美国Millipore公司)膜,5%无脂牛奶/TBS缓冲液室温封闭膜后加入第一抗体(p53或抗HBxAg抗体),2小时后洗膜,加过氧化物酶标记杭体,室温1小时,洗膜后用ECL(Amersham)显色系统显色。HepG2、尸检肝和胎盘组织为阴性对照,HepG2.2.15作阳性对照。
结 果
一、HBV全基因Southern杂交
13例PHC患者中9例的配对样本中出现杂交带,其中7例癌及癌旁组织同时出现阳性杂效带,1全仅癌组织,另1例仅癌旁组织中出现杂交带。8例癌组织中出现杂效带的患者中7例表现为整合型,1例为整合并复制型。8例癌旁组织中出现杂效带的患者中5例表现为整合型,1例为整合并复制型,2例为单纯复制型(图1)。9例中8例为血清HBsAg阳性。

, http://www.100md.com
图1 HBV全基因杂交病例1、2、5,肿瘤组织以整合型为主;
例7整合并复制;例9高度复制
二、HBx基因与胎盘DNA杂交
胎盘DNA经18种内切酶消化后用HBx基因杂交,未出现任何杂交带,表明人基因组DNA不存在与HBx基因同源的序列。
三、免疫组化染色
HBsAg 6例阳性,HBcAg 1例阳性 ,HBxAg 8例阳性,其中1例HBxAg阳性位于细胞核(图2)。

图2 抗HBxAg抗体染色,细胞核阳性×100
, 百拇医药 四、p53第七外显子分析
13例癌及癌旁组织DNA经PCR扩增后,均能被RsaI、MspI和HaeIII酶切成相应的电泳带,表明在这三个编码子无点突变(图3)。

图3 p53第七外显子PCT扩增后均能被HeaIII酶切
五、免疫沉淀和Western印迹分析
应用Wc9-85免疫沉淀,兔抗HBxAg染色,7例分别在13000、17000或28000处出现特异性带(图4A);Ab2免疫沉淀,兔抗HBxAg染色,6例在13000、17000或28000处出现阳性反应带(图4B);Wx9-85免疫沉淀,Ab2染色,7例在53000处出现特异性反应带(图4C)。HepG2.2.15亦出现相应的反应带(图4D),HepG2、尸检肝和胎盘组织未出现特异性反应带。结果初步证明p53蛋白能与HBxAg相互结合形成复合物(附表)。

, http://www.100md.com
图4 A:抗HBxAg免疫沉淀和免疫印迹,28000和17000处显示反应带;B:p53免疫印迹,17000和13000处显示反应带,2例尸检肝对照阴性(3,4);C:抗HBxAg免疫沉淀,p53免疫印迹,53000处显示反应带,胎盘组织阴性(3);D:同c、HepG2细胞阴性(1),HepG2.2.15在53000处显示反应带(2)
附表 HBV-DNA杂交、免疫组化和免疫沉淀结果
例号
HBV-DNA
免疫组化
免疫沉淀和Western印迹
HBsAg
HBcAg
, http://www.100md.com
HBxAg
HBxAg-p53
p53-HBxAg
HBxAg-HBxAg
1
+
+
-
+
53
17,28
17,28
2
, 百拇医药
+
+
-
+
53
17
13,17
3
-
-
-
-
-
-
, 百拇医药
-
4
-
-
-
-
-
-
-
5
+
+
-
+
, 百拇医药
53
17
13,17
6
+
-
-
-
-
-
17
7
+
-
, http://www.100md.com
-
+
53
17
17
8
+
-
-
-
-
-
-
9
, 百拇医药
+
+
+
+
53
17
17,28
10
-
-
-
+
-
-
, 百拇医药
-
11
+
+
-
+
53
ND
ND
12
+
+
-
+
, 百拇医药
53
13,17
13,17
13
-
-
-
-
-
-
-
讨 论
HBV感染者发生PHC的危险性高于无感染者200倍以上,其有关机制之一认为在HBV慢性感染过程中,整合到宿主细胞,并通过插入、重排等变化,使癌基因活化或抑癌基因失活,导致细胞恶性转化。然而不少研究表明,HBV自身不具有病毒癌基因的作用,也未发现HBV整合与任何已知的癌基因有关〔11,12〕。在整合位点和形式上也没有特征性。限制性酶片段长度多态性分析,发现PHC等位基因丢失涉及到18对染色体的不同基因位点。Hsu等的研究发现,p53基因第249编码子存在一个与PHC密切相关的点突变〔3,4,13〕,但不同人群或不同地区的PHC研究结果差异很大〔5,6〕。作者假设HBV与PHC的关系,可能存在蛋白水平上的调节机制。文献报告HBV与逆转录病毒在进化起源上具有同源性〔7〕,HBx基因编码蛋白具有反式激活作用〔8〕。免疫组化发现36%~50%HBxAg阳性物质定痊于细胞核〔14〕,p53蛋白属于核磷酸化蛋白,并具有蛋白质-DNA结合的特性,在HBxAg与p53之间,是否以结合的形式在蛋白水平上对p53起调节作用,类似于多瘤病毒、腺病毒及乳头状瘤病毒与p53和RB基因之间的关系〔15〕。本实验结果显示,本组病例与HBV感染密切相关,但p53第七外显子的三个编码子无点突变存在,而免疫沉淀和Western印迹分析,证明HBxAg与p53蛋白可以相互结合形成复合物,从蛋白水平上对p53进行调节,可能是HBV引发PHC的重要机制之一。本文结果还显示,p53与HBxAg的结合,主要是17000的HBx表达蛋白,应用p53免疫沉淀,HBxAg抗体染色,较少出现13000和28000的反应带,提示17000蛋白是与p53结合的主要功能蛋白。
, 百拇医药
我们认为,与HBV和黄曲毒毒素双重因素有关的PHC,p53的变化主要在DNA水平,包括等位基因丢失和突变,而以HBV感染为主要因素的PHC,其发生机制则可能通过HBx蛋白与p53蛋白的结合,进而调节并影响p53基因的功能,破坏的p53基因负调节作用,导致细胞的恶性转化。对HBxAg与p53蛋白的结合形式及调节机制尚待进一步研究。
参考文献
1.Bressac B,Galvin KM,Liang TJ,et al.Abnormal structure and expression of p53 gene in human hepatocellular carcinoma.Proc Natl Acad Sci USA.1990,87:1973.
2.Murakami Y,Hayashi K,Hirohashi S,et al.Aberration of the tumor suppressor p53 and retinoblastoma genes in human hepatocellular carcinomas.Cancer Res,1991,51;5520.
, http://www.100md.com
3.Hsu IC,Metcalf RA,Sun T,et al.Mutational hotspot in the p53 gene in human hepatocellular carcinoma.Nature 1991,350:427.
4.Bressac B,Kew M,Wands J,et al.Selective G to T muttion of p53 gene in hepatocellular carcinoma from Southern Africa.Nature,1991,350:429.
5.Hosono S,Lee CS,Chou MJ,et al.Molecular analysis of the p53 alleles in primary hepatocellular carcinoma and cell lines.Oncogene,1991,6:237.
, http://www.100md.com
6.Hayward NK,Walker GJ.Hepatocellular carcinoma mutation.Nature,1991,352:764.
7.Miller RH,Robinson WS.Common evalutionary origin of hepatits B virus and retroviruses.Proc Natl Acad Sci USA,1986,83:2531.
8.Zahm P,Hofschneider PH,Koshy R.The HBV X-ORF encodes a transactivator:a potential factor in viral hepatocarcinogenesis.Oncogene,1988,3:169.
9.Kim CM,Koike K,Saito I,ea al.HBx gene of hepatitis B virus induces liver cancer in transgenic mice.Nature,1991,351:317.
, 百拇医药
10.Feitelson MA,Clayton MM,Blumberg BS.The X antigen/antibody markers in hepadnavirus infections.I presecn and signifcance of the hepadnavirus X gene products in serum.Gastroenterology,1989,98:1071.
11.Dejean A,De The H.Hepatitis B virus as an insertional mutagene in a human hepatocellular carcinoma.Mol Biol Med,1990,7:213.
12.Robinson W,Klote L,Aoki N.Hepadnaviruses in cirrhotic liver and hepatocellular carcinoma.J Med Virol,1990,31:18.
, 百拇医药
13.Scorsone KA,Zhou YZ,Butel JS,et al.p53 mutations cluster at codon 249 in hepatocellular carcinoma from China.Cancer Res,1992,52:1635.
14.Wang W,London WT,Feitelson MA.Hepatitis B x antigen in hepatitis B virus carrier patients with liver cancer.Cancer Res.1991,51:4971.
15.Lane DP.Oncogenes of the DNA tumor viruses:their interaction with host proteins.In: Glover DM,Hames BD,eds.Oncogenes.Oxford University press,1989:191-215.
(收稿:1992-09-14 修回:1993-03-24), 百拇医药