人胚胎胰岛 IL-6 基因表达与胰岛素分泌的关系
作者:孙 汭 田志刚 张健华 刘 杰 张 捷 田 彤 明 雨 崔正言
单位:250001 济南山东省医学科学院山东肿瘤生物治疗研究中心
关键词:胰岛;白细胞介素6;基因表达调节;胰岛素;胚胎
中华医学杂志930904 摘要 以胶原酶 V 型消化液消化获取胚胎胰岛进行原代培养,观察胰岛自发分泌白细胞介素6(IL-6)及其与胰岛素分泌的关系和不同剂量 IL-6 对胰岛素分泌的调控效应,并对胚胎胰岛进行了IL-6RNA 斑点杂交。结果表明:体外培养的胚胎胰岛分泌 IL-6,且与胰岛素分泌相一致,随着离体时间延长而降低;IL-6依赖细胞株(MH60*BSF2)在不同浓度的胰岛培养上清中均有明显的增殖;用生物素标记的 IL-6cDNA 探针与胰岛 RNA 进行斑点杂交显示胚胎胰岛表达 IL-6mRNA;IL-6 对胚胎胰岛 24 小时胰岛素释放量具有促进效应。
, http://www.100md.com
白细胞介素6(IL-6)是一种十分重要的细胞因子,分子克隆于 1986年,从而揭开了 IL-6 系列研究的序幕。现已证明 IL-6 是一种多功能的多肽类调节肽,对免疫系统、神经系统、肝 代谢、造血系统均具有正向调节效应〔1〕。近2年有人通过动物实验探讨 IL-6与胰岛功能及其胰岛病变的关系〔2〕,提示 IL-6 可能与胰岛素分泌以及与糖尿病发病有关。我们在此基础上,结合多年的临床胰岛移植工作,直接在人胚胎观察了 IL-6 与胰岛素分泌的关系,现将结果报告如下。
材料和方法
一、标本的采取及胰岛的分离培养
实验所用标本为了生2小时以内的水囊引产胎儿。常规消毒,无菌取出胰腺,去除结缔组织,Hanks 液洗涤2次,剪成约0.5~1mm3的组织块,加入 0.5mg/ml胶酶 V 型(Sigma 公司产品,510U/mg)消化液 38℃水浴逐级消化,每次10~15分钟,直至消化完全,用冷 Hanks 液终止消化,离心洗涤3次后,将胰岛沉淀再悬浮于20%胎牛血清(FCS)完全培养液中,37℃、5%CO2培养。
, 百拇医药
二、IL-6生物活性检测
IL-6生物活性的短期增殖试验,参照文献[3],rIL-6 标准品和 IL-6 依赖细胞株 MH60*BSF2均由日本大阪大学细胞工学中心惠赠。IL-6生物活性的长期传代培养,参照文献[4],培养上清分别为20%、10%、5%、1%4个浓度,每24 小时进行一次活细胞计数。
三、胚胎胰岛 IL-6 RNA 斑点杂交
1.IL-6 cDNA 探针的制备参照文献[5]。
2.胚胎胰岛 RNA 的提取:采用异硫氰酸胍方法〔6〕略加改动。将胶原酶 V 消化获取的胚胎胰岛加入异硫氰酸胍(GIT)液,水浴5分钟后将匀浆裂解液入一新管,加入2mol/L醋酸钠、饱和酚及 49∶1 氯仿异戊醇混匀,4℃ 10 000×g离心20分钟,取上清后加入异丙醇-20℃作用1小时,4℃ 10 000×g 离心20分钟,取沉淀物,再复溶于 GIT 液中,加入等体积异丙醇后,-20℃再作用1小时,4℃ 12 000×g离心20分钟,75%乙醇沉淀后真空抽干备用。
, 百拇医药
3.探针标记:IL-6 cDNA 探针采用生物素切口平移标记技术〔7〕,稍有改动。将0.5μg IL-6 cDNA 加入 dNTP 混合液(ACG) ,同时加入 Bio-ll-dUTP(北京医科大学药物研究所提供)及 DNA 酶I、DNA 多聚酶、10×切口平移缓冲液,消毒三蒸水加至50μl,混匀,14℃水浴 2 小时后加入0.5mol/L乙二胺四醋酸(EDTA)终止反应,Sephadex-G50离心小柱分离法收获标记的探针。
4.RNA 斑点杂交参照文献[8]。
四、IL-6对胰岛分泌胰岛素的调控效应
1.IL-6对胚胎胰岛 24 小时胰岛素释放量的影响:将浓度为1×106/ml胰岛悬液接种于16孔板中,共4孔,2孔加入50μl/mlIL-6,2孔作为对照,每24小时收集1次上清,连续5天,-20℃保存,待测胰岛素含量。
, 百拇医药
2.不同浓度IL-6对胚胎胰岛分泌功能的影响:将浓度为5×105/ml的胰岛悬液接种于16孔板,各孔分别加入rhIL-6,浓度为每毫升100、75、50、25、12、6、3及1U,设2孔作对照,培养 48 小时收获全部上清,-20℃保存,待测胰岛素含量。
五、胰岛素的测定
采用北京原子能研究的提供的胰岛素放射免疫测定试剂盒进行测定。
结 果
一、胰岛的培养及生长特征
经消化的胚胎胰腺组织可获得分散较好的胰岛,成活率在90%以上,平均每毫克胚胎胰腺组织可获约5 000个胰岛,培养48小时胰岛即开始贴壁,5~7天后形成形态较均一的单层细胞,隔天换液一次,体外培养可存活20天以上。
, 百拇医药
二、胰岛培养上清中IL-6生物活性及其与胰岛素分泌的关系
1.胚胎胰岛体外培养每24小时胰岛素和IL-6的分泌量(表1):结果表明,各组上清均有IL-6活性,以第1天分泌量为最高,胰岛素的分泌与IL-6的分泌相一致,均随着离体时间延长,分泌量降低。
表1 胚胎胰岛体外培养中每24小时胰岛素和IL-6分泌量(n=4) 周泌周期
胰岛素含量(μU/ml)
IL-6含量(U/ml)
1
9050±496
1559.7±99.8
2
, 百拇医药
5575±403
528.1±40.0
3
2001±189
324.9±13.3
4
807±54
57.5±4.8
5
525±28
21.8±1.7
2.胚胎胰岛体外培养1~9天胰岛素和IL-6的分泌量(表2):结果表明,IL-6的分泌量在1~5天内波动不大,第7天下降明显,而胰岛素的分泌也以第1天为最高,以后逐渐下降,但较24小时分泌周期下降为慢,说明胚胎胰岛体外培养中随着时间延长,IL-6和胰岛素均有一定的消耗和降解,但IL-6的消耗和降解较胰岛素慢。
, 百拇医药
表2 胚胎胰岛体外培养中胰岛素和IL-6分泌量(n=4) 培养时间(天)
胰岛素含量(μU/ml)
IL-6含量(U/ml)
1
8140±414
683±34
2
6879±328
606±29
3
5903±302
606±28
, 百拇医药
5
4914±284
654±34
7
3791±300
429±31
9
2492±110
200±11
3.MH60.BSF2 细胞在胰岛培养上清中长期培养的增殖情况(表3):结果表明,MH60.BSF2细胞在含有不同浓度的胰岛上清的培养液中均有明显的增殖。培养120小时后,20%、10%浓度组细胞增殖均超过了含有200U/ml rhIL-6的阳性对照,细胞增殖了50倍,结果再次证明胰岛培养上清中含有IL-6。
, http://www.100md.com
表3 IL-6依赖细胞株在不同浓度胰岛培养上清中的倍增状况 培养时间(h)
细胞培养液
IL-6(10U/ml)
MH60.BSF2细胞浓度(×104/ml)
20*
10*
5*
1*
0
1.00
, http://www.100md.com
1.0
1.0
1.0
1.0
1.0
24
0.75
2.5
2.0
3.3
2.5
2.5
48
, 百拇医药
0.00
4.5
4.3
4.5
3.5
3.5
72
0.00
11.5
12.5
14.5
9.5
8.5
, 百拇医药
96
0.00
23.5
29.3
28.5
21.0
19.5
120
0.00
46.8
50.0
50.0
37.8
, 百拇医药
32.5
*20、10、5、1为胰岛培养上清浓度(%,V/V)
三、IL-6 cDNA 探针斑点杂交(图1)
A:IL-6 cDNA:50ng,5ng,0.5ng,50pg,5pg,0.5pg
B:人胚胎胰岛 RNA:3.75μg,3μg,2.25μg,1.50μg,0.75μg,0.1μg
C:λDNA:500ng,50ng,5ng,0.5ng,50pg,5pg
图1 生物素标记的IL-6 cDNA 探针与胰岛细胞 RNA 的班点杂交结果
, http://www.100md.com
生物素标记的IL-6 cDNA 探针与胰岛 RNA 的斑点杂交结果显示胰岛 RNA 中含有高浓度的IL-6mRNA,分设的RNA点样量6个浓度斑点均出现了阳性反应,亲合素——碱性磷酸酶显色反应出现了剂量依赖关系,说明在无任何刺激情况下胰岛细胞转录IL-6mRNA。
四、IL-6对胰岛分泌胰岛素的调控效应
1.IL-6 对胚胎胰岛 24小时胰岛素释放量的促进效应:将每24小时收集1次的IL-6组和对照组的上清进行胰岛素释放量的测定,如图2所示,IL-6组24小时胰岛素释放量明显高于对照组,两组有显著差异(t=31.97,P<0.001)。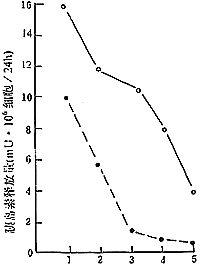
培养时间(天)
图2 IL-6对胚胎胰岛24小时胰岛素释放量的促进效应
, 百拇医药
2.不同浓度IL-6对胰岛分泌功能的影响(图3):将不同浓度IL-6 刺激后的胰岛分泌上清测定其胰岛素含量,由图3所示,IL-6对胰岛分泌功能具有促进效应,并且在一定范围内存在明显的剂量依赖关系。在IL-6含量为 75U/ml时,胰岛素释放量最高,随着IL-6 的剂量减少,分泌胰岛素的能力逐渐下降,在 IL-6 含量为 1U/ml时,其分泌胰岛素的量与对照组基本一致。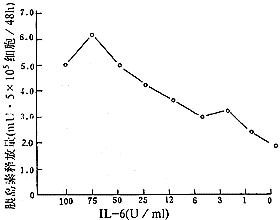
图3 不同浓度IL-6作用48小时后胚胎胰岛素释放量
讨 论
上述结果表明,人胚胎胰岛在无任何刺激情况下即有 IL-6 mRNA 表达而自发分泌IL-6,并且证明了IL-6可以促进胰岛分泌胰岛素,从而使人类对胚胎胰岛分泌功能有了新的认识,尽管全面分析这种现象的生理学意义还为时尚早,但以下两个方面的推测将有利于胚胎胰岛移植工作和糖尿病免疫病理学病因的探讨。
, 百拇医药
一、IL-6 可能作为胰岛分泌胰岛素的促进或调节因子
现已发现,IL-6 可以促进神经母细胞向神经元分化,该作用与神经生长因子相仿〔4,9〕。IL-6还可以促进肝脏细胞处于应激状态而大量分泌急性期蛋〔10〕,因此IL-6被誉为当代“细胞因子家族的核心成员”〔11〕。鉴于IL-6 与胰岛素分泌具有时相有类同性,我们推测 IL-6 可能对胰岛分泌胰岛素具有促进或调节效应,我们的实验中已观察到 IL-6 纯品可以促进胰岛分泌胰岛素,并在一定范围内存在剂量依赖关系。如果该项结论得到完全证实,将为进一步增 IL-6 的临床用途和增强胰岛移植的疗效奠定理论基础。
二、IL-6 可能与胰岛素依赖性糖尿病(IDDM)的免疫病理学病因有关
IDDM的免疫病理学研究一直是目前解释糖尿病的一个重要学说。但自从发现 IL-6 以后,人们已发现糖尿病小鼠中 IL-6 基因表达量增加,推测可引起自身免疫反应而导致病理过程,其机理主要是促进 B 淋巴细胞分化而过量表达 IgG 基因和促进杀伤性 T 淋巴细胞克隆的过度激活。如果该假设得到验证,那么阻断 IL-6 基因表达也许为治疗糖尿病提供新的途径。
, 百拇医药
上述两个假设相互矛盾,前者认为 IL-6 是胰岛行使功能的促进因子,后者则认为是损伤因子,二者之间的真正关系有待事实来验证,也许 IL-6 的适量表达才是胰岛正常分泌胰岛素的基础,揭示这种关系必将对糖尿病的治疗有重要意义。
参考文献
1 Kishimotot T. The biology of interleukin-6.Blood,1989,74∶1.
2 Vampbell IL,Cutri A, Wilson A,et al.Evidence for IL-6 production by and effects on the pancreatic beta cell. JImmunol,1989,143∶1188.=4 孙 汭,田志刚,张 捷,等.原代培养的人胎脑胶质细胞可自发分泌IL-6.中华微生物与免疫学杂志,1991,11∶255.
, 百拇医药
5 田志刚,李登华,孙 汭,等.用改良的双二价阳离子质粒转染法构建人 IL-6cDNA 扩增体系.上海免疫学杂志,1990,10∶302.
6 Promega Corporation.Extraction of total RNA.Protocol and application.Madison:Promega,1990.11-17.
7 Dillon JAR,Nasim A,Nestmann ER.Non-redioactive probe (biotin-avidin). recombinant DNA methodology. New York: Wilew, 1985∶76-79.
8 Sambrook J,Fritsch EF,Maniatis T,eds.Dot and slot hybridization.Molecular cloning-a laboratory manual. Vol 2.2nd ed. New York:Cold Spring Harbor Laboratory Press,1989∶753-758.
, 百拇医药
9 Satoh T,Nakamura S,Taga T,et al.Induction fo neural differentiation in PC12 cell by B cell stimulatory factor 2/ interleukin-6.Mol Cell Biol,1988,8∶3546.
10 Gauldie J,Richards C,Harnish D,et al.Interferon B-2/ B-cell stimulatory factor type 2 shares identity with monocyte-derived hepatocyte-stimulating factor and regulates the major acute phase protein in liver cell. Proc Natl Acad Sci USA,1987,84∶7251.
11 Wolvekamp MC,Marquet RL.Interleukin-6:historical background genetics and biological significance. Immunol Lett,1990,24∶1.
(收稿:1992-08-15 修回:1993-05-17), 百拇医药
单位:250001 济南山东省医学科学院山东肿瘤生物治疗研究中心
关键词:胰岛;白细胞介素6;基因表达调节;胰岛素;胚胎
中华医学杂志930904 摘要 以胶原酶 V 型消化液消化获取胚胎胰岛进行原代培养,观察胰岛自发分泌白细胞介素6(IL-6)及其与胰岛素分泌的关系和不同剂量 IL-6 对胰岛素分泌的调控效应,并对胚胎胰岛进行了IL-6RNA 斑点杂交。结果表明:体外培养的胚胎胰岛分泌 IL-6,且与胰岛素分泌相一致,随着离体时间延长而降低;IL-6依赖细胞株(MH60*BSF2)在不同浓度的胰岛培养上清中均有明显的增殖;用生物素标记的 IL-6cDNA 探针与胰岛 RNA 进行斑点杂交显示胚胎胰岛表达 IL-6mRNA;IL-6 对胚胎胰岛 24 小时胰岛素释放量具有促进效应。
, http://www.100md.com
白细胞介素6(IL-6)是一种十分重要的细胞因子,分子克隆于 1986年,从而揭开了 IL-6 系列研究的序幕。现已证明 IL-6 是一种多功能的多肽类调节肽,对免疫系统、神经系统、肝 代谢、造血系统均具有正向调节效应〔1〕。近2年有人通过动物实验探讨 IL-6与胰岛功能及其胰岛病变的关系〔2〕,提示 IL-6 可能与胰岛素分泌以及与糖尿病发病有关。我们在此基础上,结合多年的临床胰岛移植工作,直接在人胚胎观察了 IL-6 与胰岛素分泌的关系,现将结果报告如下。
材料和方法
一、标本的采取及胰岛的分离培养
实验所用标本为了生2小时以内的水囊引产胎儿。常规消毒,无菌取出胰腺,去除结缔组织,Hanks 液洗涤2次,剪成约0.5~1mm3的组织块,加入 0.5mg/ml胶酶 V 型(Sigma 公司产品,510U/mg)消化液 38℃水浴逐级消化,每次10~15分钟,直至消化完全,用冷 Hanks 液终止消化,离心洗涤3次后,将胰岛沉淀再悬浮于20%胎牛血清(FCS)完全培养液中,37℃、5%CO2培养。
, 百拇医药
二、IL-6生物活性检测
IL-6生物活性的短期增殖试验,参照文献[3],rIL-6 标准品和 IL-6 依赖细胞株 MH60*BSF2均由日本大阪大学细胞工学中心惠赠。IL-6生物活性的长期传代培养,参照文献[4],培养上清分别为20%、10%、5%、1%4个浓度,每24 小时进行一次活细胞计数。
三、胚胎胰岛 IL-6 RNA 斑点杂交
1.IL-6 cDNA 探针的制备参照文献[5]。
2.胚胎胰岛 RNA 的提取:采用异硫氰酸胍方法〔6〕略加改动。将胶原酶 V 消化获取的胚胎胰岛加入异硫氰酸胍(GIT)液,水浴5分钟后将匀浆裂解液入一新管,加入2mol/L醋酸钠、饱和酚及 49∶1 氯仿异戊醇混匀,4℃ 10 000×g离心20分钟,取上清后加入异丙醇-20℃作用1小时,4℃ 10 000×g 离心20分钟,取沉淀物,再复溶于 GIT 液中,加入等体积异丙醇后,-20℃再作用1小时,4℃ 12 000×g离心20分钟,75%乙醇沉淀后真空抽干备用。
, 百拇医药
3.探针标记:IL-6 cDNA 探针采用生物素切口平移标记技术〔7〕,稍有改动。将0.5μg IL-6 cDNA 加入 dNTP 混合液(ACG) ,同时加入 Bio-ll-dUTP(北京医科大学药物研究所提供)及 DNA 酶I、DNA 多聚酶、10×切口平移缓冲液,消毒三蒸水加至50μl,混匀,14℃水浴 2 小时后加入0.5mol/L乙二胺四醋酸(EDTA)终止反应,Sephadex-G50离心小柱分离法收获标记的探针。
4.RNA 斑点杂交参照文献[8]。
四、IL-6对胰岛分泌胰岛素的调控效应
1.IL-6对胚胎胰岛 24 小时胰岛素释放量的影响:将浓度为1×106/ml胰岛悬液接种于16孔板中,共4孔,2孔加入50μl/mlIL-6,2孔作为对照,每24小时收集1次上清,连续5天,-20℃保存,待测胰岛素含量。
, 百拇医药
2.不同浓度IL-6对胚胎胰岛分泌功能的影响:将浓度为5×105/ml的胰岛悬液接种于16孔板,各孔分别加入rhIL-6,浓度为每毫升100、75、50、25、12、6、3及1U,设2孔作对照,培养 48 小时收获全部上清,-20℃保存,待测胰岛素含量。
五、胰岛素的测定
采用北京原子能研究的提供的胰岛素放射免疫测定试剂盒进行测定。
结 果
一、胰岛的培养及生长特征
经消化的胚胎胰腺组织可获得分散较好的胰岛,成活率在90%以上,平均每毫克胚胎胰腺组织可获约5 000个胰岛,培养48小时胰岛即开始贴壁,5~7天后形成形态较均一的单层细胞,隔天换液一次,体外培养可存活20天以上。
, 百拇医药
二、胰岛培养上清中IL-6生物活性及其与胰岛素分泌的关系
1.胚胎胰岛体外培养每24小时胰岛素和IL-6的分泌量(表1):结果表明,各组上清均有IL-6活性,以第1天分泌量为最高,胰岛素的分泌与IL-6的分泌相一致,均随着离体时间延长,分泌量降低。
表1 胚胎胰岛体外培养中每24小时胰岛素和IL-6分泌量(n=4) 周泌周期
胰岛素含量(μU/ml)
IL-6含量(U/ml)
1
9050±496
1559.7±99.8
2
, 百拇医药
5575±403
528.1±40.0
3
2001±189
324.9±13.3
4
807±54
57.5±4.8
5
525±28
21.8±1.7
2.胚胎胰岛体外培养1~9天胰岛素和IL-6的分泌量(表2):结果表明,IL-6的分泌量在1~5天内波动不大,第7天下降明显,而胰岛素的分泌也以第1天为最高,以后逐渐下降,但较24小时分泌周期下降为慢,说明胚胎胰岛体外培养中随着时间延长,IL-6和胰岛素均有一定的消耗和降解,但IL-6的消耗和降解较胰岛素慢。
, 百拇医药
表2 胚胎胰岛体外培养中胰岛素和IL-6分泌量(n=4) 培养时间(天)
胰岛素含量(μU/ml)
IL-6含量(U/ml)
1
8140±414
683±34
2
6879±328
606±29
3
5903±302
606±28
, 百拇医药
5
4914±284
654±34
7
3791±300
429±31
9
2492±110
200±11
3.MH60.BSF2 细胞在胰岛培养上清中长期培养的增殖情况(表3):结果表明,MH60.BSF2细胞在含有不同浓度的胰岛上清的培养液中均有明显的增殖。培养120小时后,20%、10%浓度组细胞增殖均超过了含有200U/ml rhIL-6的阳性对照,细胞增殖了50倍,结果再次证明胰岛培养上清中含有IL-6。
, http://www.100md.com
表3 IL-6依赖细胞株在不同浓度胰岛培养上清中的倍增状况 培养时间(h)
细胞培养液
IL-6(10U/ml)
MH60.BSF2细胞浓度(×104/ml)
20*
10*
5*
1*
0
1.00
, http://www.100md.com
1.0
1.0
1.0
1.0
1.0
24
0.75
2.5
2.0
3.3
2.5
2.5
48
, 百拇医药
0.00
4.5
4.3
4.5
3.5
3.5
72
0.00
11.5
12.5
14.5
9.5
8.5
, 百拇医药
96
0.00
23.5
29.3
28.5
21.0
19.5
120
0.00
46.8
50.0
50.0
37.8
, 百拇医药
32.5
*20、10、5、1为胰岛培养上清浓度(%,V/V)
三、IL-6 cDNA 探针斑点杂交(图1)

A:IL-6 cDNA:50ng,5ng,0.5ng,50pg,5pg,0.5pg
B:人胚胎胰岛 RNA:3.75μg,3μg,2.25μg,1.50μg,0.75μg,0.1μg
C:λDNA:500ng,50ng,5ng,0.5ng,50pg,5pg
图1 生物素标记的IL-6 cDNA 探针与胰岛细胞 RNA 的班点杂交结果
, http://www.100md.com
生物素标记的IL-6 cDNA 探针与胰岛 RNA 的斑点杂交结果显示胰岛 RNA 中含有高浓度的IL-6mRNA,分设的RNA点样量6个浓度斑点均出现了阳性反应,亲合素——碱性磷酸酶显色反应出现了剂量依赖关系,说明在无任何刺激情况下胰岛细胞转录IL-6mRNA。
四、IL-6对胰岛分泌胰岛素的调控效应
1.IL-6 对胚胎胰岛 24小时胰岛素释放量的促进效应:将每24小时收集1次的IL-6组和对照组的上清进行胰岛素释放量的测定,如图2所示,IL-6组24小时胰岛素释放量明显高于对照组,两组有显著差异(t=31.97,P<0.001)。

培养时间(天)
图2 IL-6对胚胎胰岛24小时胰岛素释放量的促进效应
, 百拇医药
2.不同浓度IL-6对胰岛分泌功能的影响(图3):将不同浓度IL-6 刺激后的胰岛分泌上清测定其胰岛素含量,由图3所示,IL-6对胰岛分泌功能具有促进效应,并且在一定范围内存在明显的剂量依赖关系。在IL-6含量为 75U/ml时,胰岛素释放量最高,随着IL-6 的剂量减少,分泌胰岛素的能力逐渐下降,在 IL-6 含量为 1U/ml时,其分泌胰岛素的量与对照组基本一致。

图3 不同浓度IL-6作用48小时后胚胎胰岛素释放量
讨 论
上述结果表明,人胚胎胰岛在无任何刺激情况下即有 IL-6 mRNA 表达而自发分泌IL-6,并且证明了IL-6可以促进胰岛分泌胰岛素,从而使人类对胚胎胰岛分泌功能有了新的认识,尽管全面分析这种现象的生理学意义还为时尚早,但以下两个方面的推测将有利于胚胎胰岛移植工作和糖尿病免疫病理学病因的探讨。
, 百拇医药
一、IL-6 可能作为胰岛分泌胰岛素的促进或调节因子
现已发现,IL-6 可以促进神经母细胞向神经元分化,该作用与神经生长因子相仿〔4,9〕。IL-6还可以促进肝脏细胞处于应激状态而大量分泌急性期蛋〔10〕,因此IL-6被誉为当代“细胞因子家族的核心成员”〔11〕。鉴于IL-6 与胰岛素分泌具有时相有类同性,我们推测 IL-6 可能对胰岛分泌胰岛素具有促进或调节效应,我们的实验中已观察到 IL-6 纯品可以促进胰岛分泌胰岛素,并在一定范围内存在剂量依赖关系。如果该项结论得到完全证实,将为进一步增 IL-6 的临床用途和增强胰岛移植的疗效奠定理论基础。
二、IL-6 可能与胰岛素依赖性糖尿病(IDDM)的免疫病理学病因有关
IDDM的免疫病理学研究一直是目前解释糖尿病的一个重要学说。但自从发现 IL-6 以后,人们已发现糖尿病小鼠中 IL-6 基因表达量增加,推测可引起自身免疫反应而导致病理过程,其机理主要是促进 B 淋巴细胞分化而过量表达 IgG 基因和促进杀伤性 T 淋巴细胞克隆的过度激活。如果该假设得到验证,那么阻断 IL-6 基因表达也许为治疗糖尿病提供新的途径。
, 百拇医药
上述两个假设相互矛盾,前者认为 IL-6 是胰岛行使功能的促进因子,后者则认为是损伤因子,二者之间的真正关系有待事实来验证,也许 IL-6 的适量表达才是胰岛正常分泌胰岛素的基础,揭示这种关系必将对糖尿病的治疗有重要意义。
参考文献
1 Kishimotot T. The biology of interleukin-6.Blood,1989,74∶1.
2 Vampbell IL,Cutri A, Wilson A,et al.Evidence for IL-6 production by and effects on the pancreatic beta cell. JImmunol,1989,143∶1188.=4 孙 汭,田志刚,张 捷,等.原代培养的人胎脑胶质细胞可自发分泌IL-6.中华微生物与免疫学杂志,1991,11∶255.
, 百拇医药
5 田志刚,李登华,孙 汭,等.用改良的双二价阳离子质粒转染法构建人 IL-6cDNA 扩增体系.上海免疫学杂志,1990,10∶302.
6 Promega Corporation.Extraction of total RNA.Protocol and application.Madison:Promega,1990.11-17.
7 Dillon JAR,Nasim A,Nestmann ER.Non-redioactive probe (biotin-avidin). recombinant DNA methodology. New York: Wilew, 1985∶76-79.
8 Sambrook J,Fritsch EF,Maniatis T,eds.Dot and slot hybridization.Molecular cloning-a laboratory manual. Vol 2.2nd ed. New York:Cold Spring Harbor Laboratory Press,1989∶753-758.
, 百拇医药
9 Satoh T,Nakamura S,Taga T,et al.Induction fo neural differentiation in PC12 cell by B cell stimulatory factor 2/ interleukin-6.Mol Cell Biol,1988,8∶3546.
10 Gauldie J,Richards C,Harnish D,et al.Interferon B-2/ B-cell stimulatory factor type 2 shares identity with monocyte-derived hepatocyte-stimulating factor and regulates the major acute phase protein in liver cell. Proc Natl Acad Sci USA,1987,84∶7251.
11 Wolvekamp MC,Marquet RL.Interleukin-6:historical background genetics and biological significance. Immunol Lett,1990,24∶1.
(收稿:1992-08-15 修回:1993-05-17), 百拇医药