利福平及其蛋白偶联物致敏兔和利福平特IgG的检测
作者:李林峰 黄 萍 张孙曦 李世荫
单位:100083北京医科大学第三医院(李林峰、李世荫),北京医科大学生物物理教研室(黄 平、张纱曦)
关键词:利福平;变态反应和免疫学;模型,生物学
中华医学杂志931111 摘要 用利福平及两种利福平蛋白偶联物免疫新西兰白兔,用ELISA方法证明了抗血清中利福平特异IgG抗体的存在。单纯用利福平免疫,特异抗体效价为1∶10~1∶100;而用人工抗原,效价可达1∶1000以上。直接用利福平致敏动物,较用3-甲酰利福霉素SV致敏动物更能全面反映利福平的抗原性。为利福平变态反应的研究建立了可靠的实验模型。
利福平(Pifampicim,RFP)是一疗效优异的抗结核药,但临床应用后可发生皮疹、丙氨酸转氨酶升高等多种不良反应,有些反应(如剥脱性皮炎)甚至危及生命。虽有大量临床现象提示某些RFP不良反应可能是变态反应〔1,2〕,但缺乏确切实验证明,至今甚至对RFP能否使机体致敏尚存争议〔3〕。虽有致敏豚鼠的报告,但由于仅作了皮肤试验,尚不足以说明致敏成功〔4〕。利福霉毒-蛋白偶联物虽可致敏动物,但利福霉素不含RFP侧链结构,用其研究RFP致敏状态尚存不足〔3,5〕。
, http://www.100md.com
我们曾成功地制备了RFP-牛血清白蛋白结合物(RFP-BSA),并以其为抗原检测结核患者血清中RFP特异IgG、IgM获得成功〔6〕。本研究的目的在于用RFP及两种不同的RFP蛋白偶联物(RFP-BSA及RFP-兔血清白蛋白结合物,RFP-RSA)免疫兔,以进一步单明RFP致敏机体的可能性,并为RFP变态反应及其抗原决定基的进一步研究打基础。
材料与方法
一、动物
雄性新西兰白兔20只,重1.5~2kg,购自军事医学科学院实验动物部。将动物随机分4组:(1)RFP-BSA致敏组,共6只,致敏原为RFP-BSA;(2)RFP-RSA致敏组,共5只,致敏原为RFP-RSA;(3)RFP致敏组,共4只,致敏原为RFP;(4)对照组不予致敏,共5只。
二、试剂与仪器
, http://www.100md.com
RFP:纯度99.07%~99.55%,购于北京生物制品和药品检验所;BSA:纯度95%,中国医药公司北京采购供应站经销;RSA:硫酸铵盐析法制备,见文献〔7〕;CFA,IFA:美国Sigma公司产品;羊抗兔IgG-HRP:军事医学科学院流行病研究所产品;酶标板:华美生物工程公司产品;酶标仪:Dynatech II型,美国产。
三、方法
1.人工抗原制备:(1)RFP-BSA:RFP、BSA各取0.2g于5ml0.1mol/L碳酸盐缓冲液中,pH9.0,4℃持续搅拌72~96小时,取少量反应物Sephadex G-25凝胶层析,若见两条色带,可终止反应。此时反应混合物呈紫色,4℃下用生理盐水持续透析至析液吸光度值(190nm~500nm)接近0,所得产物经过滤除菌、冷冻干燥,4℃保存备用。紫外光谱分析证实偶联成功,偶联比RFP∶BSA约为3.1∶1。(2)RFP-RSA:碳二亚胺法,首先用琥珀酸酐法使RFP与琥珀酸连结,制备琥珀酰RFP,再用碳二亚胺法使之与RSA偶联,紫外光谱分析证实偶联成功,偶联比RFP∶RSA约为20.8∶1〔8〕。
, http://www.100md.com
2.动物免疫:皮下多点注射法〔9〕。所用致敏原量,RFP-BSA为2mg/只;RFP-RSA为0.5mg/只;RFP为250μg/只。免疫前均抽血5ml留血清作对照。初次免疫后每3~4次,于未次加强后10~14天采血测抗体效价。
3.抗血清的检测:(1)兔抗体抗原特异IgG的效价测定:间接ELISA法〔10〕。RFP-BSA包被抗原浓度为50μg/ml,用以检测RFP-BSA致敏组;RFP-RSA为5μg/ml用以检测RFP-RSA致敏组、RFP-BSAEY RFP-RSA致敏组动物抗血清中,预先分别加入不同浓度的BSA或RSA,室温共育12小时中和血清中抗载体抗体后,再按上述方法测吸光度值。抗血清的稀释度为1∶100。(3)RFP特异IgG的检测:间接ELISA方法〔10〕。包被抗原为5μg/ml RFP-RSA。在RFP-BSA及RFP-RSA致敏组抗血清中分别加入足以中和血清中抗BSA或抗RSA抗体的BSA或RSA室温共育12小时后,再加入酶标板,按文献方法测利福平特异IgG效价。
, http://www.100md.com
4.利福平特异IgG的特异性分析:在上述致敏动物的抗血清中预先加入不同浓度的利福平,室温共育12小时后,加入酶标板,同上述3的方法测吸光度值。血清稀释度1∶10。在RFP-BSA及RFP-RSA致敏组动物的抗血清中,同时加入足以消除抗载体抗体影响的BSA或RSA,本实验均选10mg/ml.
结 果
一、兔抗全抗原特异IgG的效价
由附表可见,RFP-RSA致敏组抗体效价在1∶10000以上,RFP-RSA致敏组效价为1∶1000左右,而RFP致敏组,效价为1∶100左右。
附表 兔抗全抗原特异IgG的效价( +S) 组别
+S) 组别
兔数
, 百拇医药
A值
1:10
1:100
1:1000
1:10000
RFP-BSA致敏组
6
2.20±0.25
2.0±0.15
1.98±0.08
1.74±0.05
RFP-BSA致敏组
, http://www.100md.com
5
1.61±0.02
0.62±0.12
0.09±0.02
0.00
RFP致敏组
4
0.46±0.08
0.12±0.02
0.00
0.00
未免疫组
, http://www.100md.com 5
0.02±0.03
0.00
0.00
0.00
二、载体蛋白对抗血清的作用
在1∶100的抗血清中,RFP-蛋白偶联物致敏组抗血清中加入不同浓度相应载体蛋白后,所测吸光度值的变化见图1。可见随载体蛋白浓度增加,抗血清吸光度值逐渐下降,但蛋白浓度高于0.05mg/ml后下降不明显,基本不再变化。
载体蛋白浓度(mg/kg)
图1 载体蛋白对抗血清的中和作用
, 百拇医药
三、4组动物血清RFP特异IgG的效价
由图2可见RFP-BSA致敏动物血清抗RFP特异IgG的效价为1∶1000以上;RFP-RSA致敏组为1∶100~1∶1000,RFP致敏为1∶10~1∶100。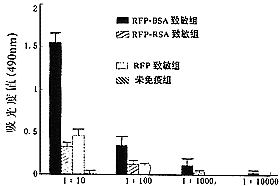
血清稀度
图2 兔抗REF特异IgG的效价
四、抗血清的特异性分析
3组致敏动物血清,加入不同浓度RFP对抗血清吸光度值的影响见图3。加入RFP Rook〔3〕用上述偶联物作抗原,用ELISA方法检测了239例服用利福平的麻风病人血清,未检出任何抗体。Mistrello〔5〕用3-甲酰利福霉素SV免疫兔未获成功,提示利福平能否在人体及实验动物体内经上述途径致敏机体,值得杯疑。更重要的是,3-甲酰利福霉素SV不含利福平侧链结构,故不能完全说明利福平的抗原性。
, 百拇医药
REF浓度(×10-3mol/L)
图3 REP对抗血清的中和作用
本实验用RFP及2种RFP人工抗原免疫动物,其中RFP-BSA及RFP-RSA致敏组同时产生了高效价抗载体抗体。对抗载体抗本,本实验均采用相应载体蛋白进行吸收。吸收后该2组动物利福平特IgG的效价仍在1∶1000左右。三种抗血清预先与利福平室温共育后,抗血清的吸光度值可明显降低,说明抗血清可以与利福平特异结合,说明致敏是成功的。
利福平直接致敏的成功,说明利福平确可在动物体内与大分子物质结合成偶联物致敏动物,证实了RFP在一定条件下确有可能引起变态反应。但具体致敏途径,目前还不清楚。本实验所用的RFP-BSA及RFP-RSA的结构是不同的(偶联部位不同),但用RFP-RSA为抗原可同时检测RFP致敏及RFP-BSA致敏组的RFP特异抗体,说明本实验中RFP的抗原决定基是相对独立的,并未与载体蛋白形成新的抗原决定基。这就为临床上用上述某种RFP-蛋白偶联物或RFP检测RFP变态反应提供了依据。我们用RFP-BSA为抗原,用ELISA检测结核病患者血清中RFP特异IgG、IgM获得成功,并发现与RFP不良反应有关〔8〕,说明RFP-BSA确可在一定程度上反映RFP在人体内的抗原结构;有意义的是,用RFP-BSA为抗原检出的RFP特异抗体可与RFP-RSA很好地结合,进一步提示两者有相似的抗原决定部位,所以弄清RFP-BSA及RFP-RSA的结构对推断RFP致敏原的形成会有所帮助。总之,RFP致敏动物的成功,为RFP变态反应的研究提供了可靠的实验模型,对于研究RFP的免疫原性,RFP变态反应的发生、发展、检测及防治有重大意义。
, 百拇医药
参考文献
1 中华结核和呼吸杂志编辑委员会。抗结核药物引起的副作用综合报告中。中华结核和呼吸杂志,1981,4∶71。
2 中华结核和呼吸杂志编辑委员会。抗结核药物引起的副作用综合报告。中华结核和呼吸杂志,1986,9∶168。
3 Rook GAW.Absence from sera from normal individuals or from Rifampicin treated Leprosy Patients(THELEPTrials)of antibody to Rifamycin-protein or Rifamycin-membrane Conjugates.Int J Iepr Other MycrobatDis,1985,53∶22.
4 Dukor P,Schumann G,Dietrich FM.Immunological studies with rifampicin.Scand J Respir Dis,1973,〔suppl84〕∶73
, http://www.100md.com
5 Mistrello G,Cricchio R,Bolzoni G,et al.Immunogenicity of rifamycins.Mol Immunol,1979,16∶665.
6 Li Lin-feng,Zhang Sun-xi,Li Shi yin.Am improved ELISA for the detection of rifampicin specific IgG/IgM and its clinical evaluation.Acta Dermatologica Kyoto,1993,in press.
7 杨景山。医学细胞化学与细胞生物技术。北京:北京医科大学中国协和医科大学联合出版社,1990∶81-82。
8 李林峰,李世荫,崔秀巧,等。琥珀酸酐碳二亚胺法制备高结合比利福平人工抗原。北京医科大学学报1993,25。
9 夏宗勤,朱 桐,肖祥熊,等。实验核医学与核药学。上海:同济大学出版社,1989:200-203。
10 Voller A,Heterogeneous enzyme-immunoassays and their applications.In:Maggio ET,ed.Enzyme-Immunoassay.Florida:CRCPress,1980,181-186.
(收稿:1992-11-16 修回:1993-07-10), http://www.100md.com
单位:100083北京医科大学第三医院(李林峰、李世荫),北京医科大学生物物理教研室(黄 平、张纱曦)
关键词:利福平;变态反应和免疫学;模型,生物学
中华医学杂志931111 摘要 用利福平及两种利福平蛋白偶联物免疫新西兰白兔,用ELISA方法证明了抗血清中利福平特异IgG抗体的存在。单纯用利福平免疫,特异抗体效价为1∶10~1∶100;而用人工抗原,效价可达1∶1000以上。直接用利福平致敏动物,较用3-甲酰利福霉素SV致敏动物更能全面反映利福平的抗原性。为利福平变态反应的研究建立了可靠的实验模型。
利福平(Pifampicim,RFP)是一疗效优异的抗结核药,但临床应用后可发生皮疹、丙氨酸转氨酶升高等多种不良反应,有些反应(如剥脱性皮炎)甚至危及生命。虽有大量临床现象提示某些RFP不良反应可能是变态反应〔1,2〕,但缺乏确切实验证明,至今甚至对RFP能否使机体致敏尚存争议〔3〕。虽有致敏豚鼠的报告,但由于仅作了皮肤试验,尚不足以说明致敏成功〔4〕。利福霉毒-蛋白偶联物虽可致敏动物,但利福霉素不含RFP侧链结构,用其研究RFP致敏状态尚存不足〔3,5〕。
, http://www.100md.com
我们曾成功地制备了RFP-牛血清白蛋白结合物(RFP-BSA),并以其为抗原检测结核患者血清中RFP特异IgG、IgM获得成功〔6〕。本研究的目的在于用RFP及两种不同的RFP蛋白偶联物(RFP-BSA及RFP-兔血清白蛋白结合物,RFP-RSA)免疫兔,以进一步单明RFP致敏机体的可能性,并为RFP变态反应及其抗原决定基的进一步研究打基础。
材料与方法
一、动物
雄性新西兰白兔20只,重1.5~2kg,购自军事医学科学院实验动物部。将动物随机分4组:(1)RFP-BSA致敏组,共6只,致敏原为RFP-BSA;(2)RFP-RSA致敏组,共5只,致敏原为RFP-RSA;(3)RFP致敏组,共4只,致敏原为RFP;(4)对照组不予致敏,共5只。
二、试剂与仪器
, http://www.100md.com
RFP:纯度99.07%~99.55%,购于北京生物制品和药品检验所;BSA:纯度95%,中国医药公司北京采购供应站经销;RSA:硫酸铵盐析法制备,见文献〔7〕;CFA,IFA:美国Sigma公司产品;羊抗兔IgG-HRP:军事医学科学院流行病研究所产品;酶标板:华美生物工程公司产品;酶标仪:Dynatech II型,美国产。
三、方法
1.人工抗原制备:(1)RFP-BSA:RFP、BSA各取0.2g于5ml0.1mol/L碳酸盐缓冲液中,pH9.0,4℃持续搅拌72~96小时,取少量反应物Sephadex G-25凝胶层析,若见两条色带,可终止反应。此时反应混合物呈紫色,4℃下用生理盐水持续透析至析液吸光度值(190nm~500nm)接近0,所得产物经过滤除菌、冷冻干燥,4℃保存备用。紫外光谱分析证实偶联成功,偶联比RFP∶BSA约为3.1∶1。(2)RFP-RSA:碳二亚胺法,首先用琥珀酸酐法使RFP与琥珀酸连结,制备琥珀酰RFP,再用碳二亚胺法使之与RSA偶联,紫外光谱分析证实偶联成功,偶联比RFP∶RSA约为20.8∶1〔8〕。
, http://www.100md.com
2.动物免疫:皮下多点注射法〔9〕。所用致敏原量,RFP-BSA为2mg/只;RFP-RSA为0.5mg/只;RFP为250μg/只。免疫前均抽血5ml留血清作对照。初次免疫后每3~4次,于未次加强后10~14天采血测抗体效价。
3.抗血清的检测:(1)兔抗体抗原特异IgG的效价测定:间接ELISA法〔10〕。RFP-BSA包被抗原浓度为50μg/ml,用以检测RFP-BSA致敏组;RFP-RSA为5μg/ml用以检测RFP-RSA致敏组、RFP-BSAEY RFP-RSA致敏组动物抗血清中,预先分别加入不同浓度的BSA或RSA,室温共育12小时中和血清中抗载体抗体后,再按上述方法测吸光度值。抗血清的稀释度为1∶100。(3)RFP特异IgG的检测:间接ELISA方法〔10〕。包被抗原为5μg/ml RFP-RSA。在RFP-BSA及RFP-RSA致敏组抗血清中分别加入足以中和血清中抗BSA或抗RSA抗体的BSA或RSA室温共育12小时后,再加入酶标板,按文献方法测利福平特异IgG效价。
, http://www.100md.com
4.利福平特异IgG的特异性分析:在上述致敏动物的抗血清中预先加入不同浓度的利福平,室温共育12小时后,加入酶标板,同上述3的方法测吸光度值。血清稀释度1∶10。在RFP-BSA及RFP-RSA致敏组动物的抗血清中,同时加入足以消除抗载体抗体影响的BSA或RSA,本实验均选10mg/ml.
结 果
一、兔抗全抗原特异IgG的效价
由附表可见,RFP-RSA致敏组抗体效价在1∶10000以上,RFP-RSA致敏组效价为1∶1000左右,而RFP致敏组,效价为1∶100左右。
附表 兔抗全抗原特异IgG的效价(
 +S) 组别
+S) 组别兔数
, 百拇医药
A值
1:10
1:100
1:1000
1:10000
RFP-BSA致敏组
6
2.20±0.25
2.0±0.15
1.98±0.08
1.74±0.05
RFP-BSA致敏组
, http://www.100md.com
5
1.61±0.02
0.62±0.12
0.09±0.02
0.00
RFP致敏组
4
0.46±0.08
0.12±0.02
0.00
0.00
未免疫组
, http://www.100md.com 5
0.02±0.03
0.00
0.00
0.00
二、载体蛋白对抗血清的作用
在1∶100的抗血清中,RFP-蛋白偶联物致敏组抗血清中加入不同浓度相应载体蛋白后,所测吸光度值的变化见图1。可见随载体蛋白浓度增加,抗血清吸光度值逐渐下降,但蛋白浓度高于0.05mg/ml后下降不明显,基本不再变化。

载体蛋白浓度(mg/kg)
图1 载体蛋白对抗血清的中和作用
, 百拇医药
三、4组动物血清RFP特异IgG的效价
由图2可见RFP-BSA致敏动物血清抗RFP特异IgG的效价为1∶1000以上;RFP-RSA致敏组为1∶100~1∶1000,RFP致敏为1∶10~1∶100。

血清稀度
图2 兔抗REF特异IgG的效价
四、抗血清的特异性分析
3组致敏动物血清,加入不同浓度RFP对抗血清吸光度值的影响见图3。加入RFP Rook〔3〕用上述偶联物作抗原,用ELISA方法检测了239例服用利福平的麻风病人血清,未检出任何抗体。Mistrello〔5〕用3-甲酰利福霉素SV免疫兔未获成功,提示利福平能否在人体及实验动物体内经上述途径致敏机体,值得杯疑。更重要的是,3-甲酰利福霉素SV不含利福平侧链结构,故不能完全说明利福平的抗原性。

, 百拇医药
REF浓度(×10-3mol/L)
图3 REP对抗血清的中和作用
本实验用RFP及2种RFP人工抗原免疫动物,其中RFP-BSA及RFP-RSA致敏组同时产生了高效价抗载体抗体。对抗载体抗本,本实验均采用相应载体蛋白进行吸收。吸收后该2组动物利福平特IgG的效价仍在1∶1000左右。三种抗血清预先与利福平室温共育后,抗血清的吸光度值可明显降低,说明抗血清可以与利福平特异结合,说明致敏是成功的。
利福平直接致敏的成功,说明利福平确可在动物体内与大分子物质结合成偶联物致敏动物,证实了RFP在一定条件下确有可能引起变态反应。但具体致敏途径,目前还不清楚。本实验所用的RFP-BSA及RFP-RSA的结构是不同的(偶联部位不同),但用RFP-RSA为抗原可同时检测RFP致敏及RFP-BSA致敏组的RFP特异抗体,说明本实验中RFP的抗原决定基是相对独立的,并未与载体蛋白形成新的抗原决定基。这就为临床上用上述某种RFP-蛋白偶联物或RFP检测RFP变态反应提供了依据。我们用RFP-BSA为抗原,用ELISA检测结核病患者血清中RFP特异IgG、IgM获得成功,并发现与RFP不良反应有关〔8〕,说明RFP-BSA确可在一定程度上反映RFP在人体内的抗原结构;有意义的是,用RFP-BSA为抗原检出的RFP特异抗体可与RFP-RSA很好地结合,进一步提示两者有相似的抗原决定部位,所以弄清RFP-BSA及RFP-RSA的结构对推断RFP致敏原的形成会有所帮助。总之,RFP致敏动物的成功,为RFP变态反应的研究提供了可靠的实验模型,对于研究RFP的免疫原性,RFP变态反应的发生、发展、检测及防治有重大意义。
, 百拇医药
参考文献
1 中华结核和呼吸杂志编辑委员会。抗结核药物引起的副作用综合报告中。中华结核和呼吸杂志,1981,4∶71。
2 中华结核和呼吸杂志编辑委员会。抗结核药物引起的副作用综合报告。中华结核和呼吸杂志,1986,9∶168。
3 Rook GAW.Absence from sera from normal individuals or from Rifampicin treated Leprosy Patients(THELEPTrials)of antibody to Rifamycin-protein or Rifamycin-membrane Conjugates.Int J Iepr Other MycrobatDis,1985,53∶22.
4 Dukor P,Schumann G,Dietrich FM.Immunological studies with rifampicin.Scand J Respir Dis,1973,〔suppl84〕∶73
, http://www.100md.com
5 Mistrello G,Cricchio R,Bolzoni G,et al.Immunogenicity of rifamycins.Mol Immunol,1979,16∶665.
6 Li Lin-feng,Zhang Sun-xi,Li Shi yin.Am improved ELISA for the detection of rifampicin specific IgG/IgM and its clinical evaluation.Acta Dermatologica Kyoto,1993,in press.
7 杨景山。医学细胞化学与细胞生物技术。北京:北京医科大学中国协和医科大学联合出版社,1990∶81-82。
8 李林峰,李世荫,崔秀巧,等。琥珀酸酐碳二亚胺法制备高结合比利福平人工抗原。北京医科大学学报1993,25。
9 夏宗勤,朱 桐,肖祥熊,等。实验核医学与核药学。上海:同济大学出版社,1989:200-203。
10 Voller A,Heterogeneous enzyme-immunoassays and their applications.In:Maggio ET,ed.Enzyme-Immunoassay.Florida:CRCPress,1980,181-186.
(收稿:1992-11-16 修回:1993-07-10), http://www.100md.com