抗乙型肝炎病毒X蛋白单克隆抗体导向治疗肝癌
作者:李君 汤钊猷 刘康达 戴尊严
单位:
关键词:乙型肝炎病毒;抗体,单克隆;肝肿瘤
中华医学杂志960410
目的 探讨抗乙型肝炎病毒X蛋白(抗HBx蛋白)单克隆抗体(单抗)作为原发性肝癌(HCC)导向治疗载体的可能性。方法 用分子量为17 000乙型肝炎病毒X蛋白免疫Balb/c小鼠,制备HBx单克隆抗体(单抗)。该单抗经大量制备、纯化、鉴定、放射性核素标记后,分别在荷人肝癌裸鼠模型和2例原发性肝细胞癌病人中进行实验和临床研究。裸鼠用18.5MBq(1mCi=37MBq)131I-抗HBx腹腔给药。2例病人通过肝动脉导管给药,1个疗程2次,共药药1387.5MBq。结果 在动物实验中,裸鼠生存期明显延长,肿瘤生长明显抑制。在临床试验中,2例患者经治疗后症状明显改善,甲胎蛋白(αFP)明显下降,B超及CT显示肿瘤显著缩小。1例患者因而获得二步手术切除。切除标本除边缘尚存少量癌细胞外,其余部分均呈干酷样坏死。结论 抗HBx单抗在肝癌导向治疗中有良好的应用前景,具有一定的理论及实际意义。
, 百拇医药
Application of radiolabled anti-HBx monoclonal antibody for HCC targeting therapy Li Jun, Tang Zhaoyou, Liu Kangda, et al. Liver CAncer Institute, Shanghai Medical University, Shanghai 200032
Objective To explore the possibility of anti-HBx McAb as a carrier of HCC targeting therapy after we prepared successfully the anti-HBx monoclonal antibody by immunizing BALB/C mice with 17KD hepatitis B virus X protein. Methods The antibody was prepared, purified, identified, radiolabled and used in nude mice bearing human HCC and two HCC patients respectively for experimental and clinical trials. In the experimental study, 0.5mCi 131I-anti-HBx was injected peritoneally. In the clinical trial, the patients were treated with 131I-anti-HBx by injectin into the hepatic artery. After the treatment for one course, a total dose of 37.5 mCi was administerated. REults The survival periods of the mice were prolonged and the tumors were suppressed significantly. The symptoms of the patients were improved significantly with decreased titre of AFP. The B-ultrasonic and CT scanning showed that the tumors became smaller. For these reasons, one of the two patients was neoperated. The tumor was removed and necrosis of the whole tumor was noted except few living tumor cells on the edge of tumor specimen Conclusions It is possible to use the anti-HBx monoclonal antibody as a carrier for human HCC targeting therapy.
, http://www.100md.com
Key words Hepatits B virus Antibodies, monoclonal Liver neoplasms, experimental
(Natl Med J China, 1996, 76:271-274)
乙型肝炎病毒(HBV)X蛋白(HBxAg)同原发性肝癌(HCC)密切相关。在HCC的发生、发展过程中起着极为重要的作用[1,2]。研究证实HBV X基因是一个调控基因,可广泛激活病毒与细胞基因起动子及多种癌基因、抑癌基因,且同表皮生长因子基因关系密切[3~5]。肝内HBxAg的表达可单独诱发HCC,同癌细胞生物学特性关系密切。因此,有文献[6]认为HBV X基因可能是病毒癌基因。免疫组织化学研究显示,HBxAg在HCC组织内表达活跃,阳性部位位于胞浆胞核[7]。在放射免疫显像研究中,发现131I-抗HBx单抗对HCC组织有较强的特异性亲和力,瘤/肝比较高,提示抗HBx单抗有成为HCC导向治疗载体的可能[8]。
, 百拇医药
我们同德国癌症中心合作,以基因工程技术制备的HBxAg免疫动物,成功地制备了抗HBx单克隆抗体。以此抗体为载体,标记放射性核素后应用于裸鼠人肝癌模型和人HCC的导向治疗研究,希望从另一角度探讨HBxAg及抗HBx单抗在肝癌诊断及治疗中的价值及意义。
材料和方法
一、单克隆抗体的制备
分子量17 000的X蛋白由德国癌症中心采用基因工程技术制备。单抗的制备见文献[9]。采用腹水瘤技术大量制备抗体,腹水抗体效价达10-6(酶联免疫吸附法),经鉴定抗体为IgG2a亚型。腹水经饱和硫酸铵粗提,及二乙氨乙基纤维素柱层析法提纯至IgG水平后,用于下述实验。
二、核素标记抗HBx单抗
氧化剂Iodogen由本校放射医学研究所提供。经二氯甲烷溶解后取200µg置于试管内,氮气吹干,使其均匀分布于试管底部。按0.2mg/37MBq(1mCi=37MBq)的比例,131I(中国原子能研究院提供)及抗体或小鼠无关IgG置于试管内,冰俗,振荡10分钟后吸出反应液,过Sephadex G-25层析分离游离碘,标记抗体经酶链免疫吸附法测定证实活性无明显改变后,用于下述实验。
, 百拇医药
三、动物模型
本所建立、连续传代的甲胎蛋白(αFP)阳性,皮下可移植人肝癌裸鼠模型LTNM4,将肝癌组织注入裸鼠皮下,4~6周后用于本实验。动物随机分组,设空白对照、131I、抗HBx单抗、131I-抗HBx单抗4组,每组6只。
四、动物实验疗效判定
1.荷瘤裸鼠生存期观察:实验组经腹腔组药,剂量18.5MBq/只,抗HBx单抗组给予同等剂量,观察给药后生存期。
2.抑瘤率观察:给药后每周测定瘤体三维最大径,计算瘤体积(V)生长情况,计算瘤体积增长率及肿瘤生长抑制率(抑瘤率)。
3.病理观察:第20天切取肿瘤组织,以1%甲醛液固定,常规石蜡切片,HE染色,观察病理改变。
, 百拇医药
五、临床试验研究(经上海医科大学中山医院药物试验委员会批准备案)
1.临床资料:2例病人为本所住院病人,男女各1例,分别为50岁和65岁。经全面检查后诊断明确,因自身因素肿瘤无法手术切除。
2.给药及途径:经肝动脉插管给药,首次注入131I-抗HBx单抗925MBq,间隔1周后再次给药462.5MBq,2次为一疗程。
3.指标观察:全身情况的改变、每周测定甲胎蛋白(αFP)、定期复查B超及CT,以评价疗效。同时监测肝、肾功能。
结果
一、花瘤裸鼠生存期观察
空白对照、131I、抗-HBx单抗、131I-抗HBx单抗4组平均生存天数分别为30.0、24.3、27.5及41.3天,131I-抗HBx单抗组生存期明显延长,同对照组相比有显著性差异(P<0.05),131I组同对照组相比生存期明显缩短(P<0.05,表1)
, 百拇医药
表1 各组裸鼠生存期观察(天) 组别
裸鼠编号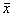 ±s
±s
1
2
3
4
5
6
空白对照
22
26
30
, 百拇医药
32
34
36
30.0±4.8
131I组
22
22
23
25
26
28
24.3±2.2
抗-HBx单抗组
, 百拇医药
21
22
25
27
34
36
27.5±5.7
131I-抗-HBx单抗组
29
38
28
46
38
, 百拇医药
49
41.3±7.1
二、花瘤裸鼠肿瘤生长情况观察
第3周,对照组,I31组、抗-HBx单抗组、131I-抗HBx单抗组瘤体积分别为17.3、7.5、12、3.8cm3(表2),各实验组抑瘤率分别为40.0%、16.7%、72.7%,131I-抗HBx单抗组同对照组相比差异有非常显著意义(P<0.01)。131I组抑瘤率同对照组相比差异也有显著意义(P<0.05)。
表2 各组裸鼠瘤体大小观察(cm3,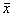 ±s) 组别
±s) 组别
鼠数
, http://www.100md.com
给药后时间(d)
1
2
3
4
空白对照组
6
3.6±1.5
9.5±3.0
18.0±11.4
17.3±9.6
131I组
6
, 百拇医药
2.6±1.1
4.1±2.6
6.0±3.8
7.5±4.6
抗-HBx单抗组
6
3.0±2.3
5.1±4.3
8.0±6.6
12.0±8.7
131I-抗-HBx单抗组
6
, 百拇医药
2.9±0.7
3.4±0.8
3.4±0.8
3.8±1.3
三、病理观察结果
对照鼠癌组织中心部分可见片状坏死,周边细胞规整,结构致密。131I-抗HBx单抗组中心坏死范围巨大,肿瘤边缘组织也可见小片状坏死。
四、临床疗效
经2个疗程治疗后,患者一般情况明显改善,无明显不良反应,肝肾功能未见明显影响,αFP水平下降明显(图1)。B超及CT复查(图2,3)显示肿瘤明显缩小。1例因此而行二步切除。手术标本大体及镜下可见肿瘤大片坏死,除边缘个别区域尚残存少量肿瘤细胞外,均呈干酪样改变。另1例因一般情况较着而无法再次手术,但治疗后患者存活8个月。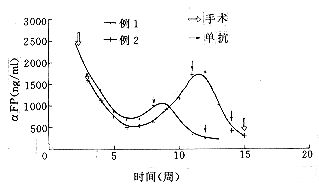
, 百拇医药
图1 2例原发性肝癌患者经用131I-HBx单抗导向治疗后,血清AFP变化曲线
图2 肝癌术前CT图像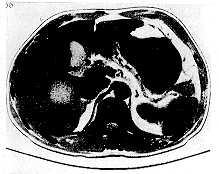
图3 经导向治疗后肿瘤明显缩小
讨论
随着新技术的广泛应用及研究的不断深入,HBxAg诱发HCC的确切机制将逐步得到认识。目前,HBV X基因的研究热点为HBxAg的致癌机制。以HBV X为靶基因进行的研究,将会使肝炎、肝癌的诊断、防治跃上一个新台阶[10,11]。
免疫组织化学检测曾显示BHBxAg在肝癌组织中表达异常活跃。在裸鼠放射免疫显像研究中,肿瘤获得了清晰显像,瘤/肝比达4.5。上述结果,为进一步开展动物实验及临床治疗奠定了基础。本研究应用131I-抗HBx单抗进行了裸鼠人肝癌模型的放射免疫治疗实验。空白对照、131I组生存期明显缩短,131I-抗HBx单抗组明显延长,后组与前两组比较,差异均有显著意义(P<0.05)。第3周时,4组肿瘤体积大小分别为17.3、7.5、12.0、3.8cm3,131I、抗HBx单抗、131I-抗HBx单抗抑瘤率分别为40%、16.7%、72.7%。131I组同对照组相比差异有显著意义(P<0.05)。131I-抗HBx单抗组与对照组相比,差异有非常显著意义(P<0.01)。结果显示,经腹腔注入131I后,裸鼠生存期明显缩短,肿瘤生长抑制明显;注入131I-抗HBx单抗后,裸鼠生存期明显延长,第3周时肿瘤抑制率达72.7%,生长明显抑制。抗-HBx单抗组的裸鼠生存期及肿瘤抑制率同对照组相比,差异均无显著意义(P>0.05),提示131I-抗HBx单抗在裸鼠人肝癌模型治疗实验中疗效显著。
, 百拇医药
在动物实验基础上,我们尚进行了少量临床研究。1例不切除的肝癌患者经131I-抗HBx单抗治疗后,因αFP降至正常,肿瘤明显缩小而获得了二步切除。切除标本大体及镜下观察均显示肿瘤基本坏死。另1例用药后αFP降至正常,患者已带瘤存活8个月,初步显示了良好的应用前景。此研究将抗HBx单抗用于肝癌的导向治疗,且取得了一定疗效。结果表明,在目前尚未发现肿瘤特异抗原的情况下,尽可能寻求肿瘤高亲和力物质为载体,运用于导向治疗具有一定的价值。
志谢 本研究所用基因工程产品HBxAg蛋白由德国癌症中心C.H.Schroder 先生惠赠,特致谢意。
参考文献
1 Beasley RP. Hepatitis B virus: the major etiology of hepato-cellular carrcinoma. Cancer, 1988, 61: 1942.
, http://www.100md.com
2 Wollersheim M, Debelka U, Hofschneicder PH. A trans-activation function encoded in the hepatitis B virus X gene is conserved in integrated state. Oncogene, 1988, 3: 545.
3 Twu JS, Lai MY, Chen DS, et al. Activation of protooncogene by the X protein of hepatitis B virus. Virology, 1993, 192: 346.
4 Wang XW, Forrester K, Yeh H, et al. Hepoatitis B virus X protein inhibits p53 sequence-specific DNA binding, transcriptional activity, and association with transcription factor ERCC3. Proc Natl Acad Sci USA, 1994, 91: 2230.
, 百拇医药
5 Menzo S, Clementi M, Alfani B, et al. Trans activation of epidermal growth factor receptor gene by the hepatitis B virus-gene product. Virology, 1993, 196: 878.
6 Shirakata Y, Kawada M, fujiki Y, et al. The X gene of hepatitis B virus induced growth stimulation and tumorigenic transformation of mouse NIH 3T3 cells. Jpn J Cancer Res, 1989, 80: 617.
7 Wang WL, London WY , Feitelson MA. Hepatitis B X antigen in hepatitis B virus carrier patients with liver cancer. Cancer Res, 1991, 51: 4971.
, 百拇医药
8 李君,汤钊猷,刘康达,等。放射标记抗HBx单克隆抗体在茶人肝癌裸鼠模型中的放射免疫定位研究。中华肿瘤杂志,1994,16:11。
9 Kohler G, Milstein g. Continuous culture of fused cells selecting antibody of predefined specificity. Nature, 1975, 256: 495.
10 Natoli G, Avantaggiati ML, Chirllo P, et al. Induction of the DNA-binding activity of c-fos heterodimers by the hepatitis B virus transactivation pX. Mol Cell Biol, 1994, 14: 989.
11 Muakami S, Cheong J, Ohno S, et al, Transactivation of human hepatitis B virus X protein, HBx, operates tjhrough a mechanism distinct from protein kinase C and okadaic acid activation pathways. Virology, 1994, 199:243.
(收稿:1995-06-29 修回:1995-12-12), http://www.100md.com
单位:
关键词:乙型肝炎病毒;抗体,单克隆;肝肿瘤
中华医学杂志960410
目的 探讨抗乙型肝炎病毒X蛋白(抗HBx蛋白)单克隆抗体(单抗)作为原发性肝癌(HCC)导向治疗载体的可能性。方法 用分子量为17 000乙型肝炎病毒X蛋白免疫Balb/c小鼠,制备HBx单克隆抗体(单抗)。该单抗经大量制备、纯化、鉴定、放射性核素标记后,分别在荷人肝癌裸鼠模型和2例原发性肝细胞癌病人中进行实验和临床研究。裸鼠用18.5MBq(1mCi=37MBq)131I-抗HBx腹腔给药。2例病人通过肝动脉导管给药,1个疗程2次,共药药1387.5MBq。结果 在动物实验中,裸鼠生存期明显延长,肿瘤生长明显抑制。在临床试验中,2例患者经治疗后症状明显改善,甲胎蛋白(αFP)明显下降,B超及CT显示肿瘤显著缩小。1例患者因而获得二步手术切除。切除标本除边缘尚存少量癌细胞外,其余部分均呈干酷样坏死。结论 抗HBx单抗在肝癌导向治疗中有良好的应用前景,具有一定的理论及实际意义。
, 百拇医药
Application of radiolabled anti-HBx monoclonal antibody for HCC targeting therapy Li Jun, Tang Zhaoyou, Liu Kangda, et al. Liver CAncer Institute, Shanghai Medical University, Shanghai 200032
Objective To explore the possibility of anti-HBx McAb as a carrier of HCC targeting therapy after we prepared successfully the anti-HBx monoclonal antibody by immunizing BALB/C mice with 17KD hepatitis B virus X protein. Methods The antibody was prepared, purified, identified, radiolabled and used in nude mice bearing human HCC and two HCC patients respectively for experimental and clinical trials. In the experimental study, 0.5mCi 131I-anti-HBx was injected peritoneally. In the clinical trial, the patients were treated with 131I-anti-HBx by injectin into the hepatic artery. After the treatment for one course, a total dose of 37.5 mCi was administerated. REults The survival periods of the mice were prolonged and the tumors were suppressed significantly. The symptoms of the patients were improved significantly with decreased titre of AFP. The B-ultrasonic and CT scanning showed that the tumors became smaller. For these reasons, one of the two patients was neoperated. The tumor was removed and necrosis of the whole tumor was noted except few living tumor cells on the edge of tumor specimen Conclusions It is possible to use the anti-HBx monoclonal antibody as a carrier for human HCC targeting therapy.
, http://www.100md.com
Key words Hepatits B virus Antibodies, monoclonal Liver neoplasms, experimental
(Natl Med J China, 1996, 76:271-274)
乙型肝炎病毒(HBV)X蛋白(HBxAg)同原发性肝癌(HCC)密切相关。在HCC的发生、发展过程中起着极为重要的作用[1,2]。研究证实HBV X基因是一个调控基因,可广泛激活病毒与细胞基因起动子及多种癌基因、抑癌基因,且同表皮生长因子基因关系密切[3~5]。肝内HBxAg的表达可单独诱发HCC,同癌细胞生物学特性关系密切。因此,有文献[6]认为HBV X基因可能是病毒癌基因。免疫组织化学研究显示,HBxAg在HCC组织内表达活跃,阳性部位位于胞浆胞核[7]。在放射免疫显像研究中,发现131I-抗HBx单抗对HCC组织有较强的特异性亲和力,瘤/肝比较高,提示抗HBx单抗有成为HCC导向治疗载体的可能[8]。
, 百拇医药
我们同德国癌症中心合作,以基因工程技术制备的HBxAg免疫动物,成功地制备了抗HBx单克隆抗体。以此抗体为载体,标记放射性核素后应用于裸鼠人肝癌模型和人HCC的导向治疗研究,希望从另一角度探讨HBxAg及抗HBx单抗在肝癌诊断及治疗中的价值及意义。
材料和方法
一、单克隆抗体的制备
分子量17 000的X蛋白由德国癌症中心采用基因工程技术制备。单抗的制备见文献[9]。采用腹水瘤技术大量制备抗体,腹水抗体效价达10-6(酶联免疫吸附法),经鉴定抗体为IgG2a亚型。腹水经饱和硫酸铵粗提,及二乙氨乙基纤维素柱层析法提纯至IgG水平后,用于下述实验。
二、核素标记抗HBx单抗
氧化剂Iodogen由本校放射医学研究所提供。经二氯甲烷溶解后取200µg置于试管内,氮气吹干,使其均匀分布于试管底部。按0.2mg/37MBq(1mCi=37MBq)的比例,131I(中国原子能研究院提供)及抗体或小鼠无关IgG置于试管内,冰俗,振荡10分钟后吸出反应液,过Sephadex G-25层析分离游离碘,标记抗体经酶链免疫吸附法测定证实活性无明显改变后,用于下述实验。
, 百拇医药
三、动物模型
本所建立、连续传代的甲胎蛋白(αFP)阳性,皮下可移植人肝癌裸鼠模型LTNM4,将肝癌组织注入裸鼠皮下,4~6周后用于本实验。动物随机分组,设空白对照、131I、抗HBx单抗、131I-抗HBx单抗4组,每组6只。
四、动物实验疗效判定
1.荷瘤裸鼠生存期观察:实验组经腹腔组药,剂量18.5MBq/只,抗HBx单抗组给予同等剂量,观察给药后生存期。
2.抑瘤率观察:给药后每周测定瘤体三维最大径,计算瘤体积(V)生长情况,计算瘤体积增长率及肿瘤生长抑制率(抑瘤率)。

3.病理观察:第20天切取肿瘤组织,以1%甲醛液固定,常规石蜡切片,HE染色,观察病理改变。
, 百拇医药
五、临床试验研究(经上海医科大学中山医院药物试验委员会批准备案)
1.临床资料:2例病人为本所住院病人,男女各1例,分别为50岁和65岁。经全面检查后诊断明确,因自身因素肿瘤无法手术切除。
2.给药及途径:经肝动脉插管给药,首次注入131I-抗HBx单抗925MBq,间隔1周后再次给药462.5MBq,2次为一疗程。
3.指标观察:全身情况的改变、每周测定甲胎蛋白(αFP)、定期复查B超及CT,以评价疗效。同时监测肝、肾功能。
结果
一、花瘤裸鼠生存期观察
空白对照、131I、抗-HBx单抗、131I-抗HBx单抗4组平均生存天数分别为30.0、24.3、27.5及41.3天,131I-抗HBx单抗组生存期明显延长,同对照组相比有显著性差异(P<0.05),131I组同对照组相比生存期明显缩短(P<0.05,表1)
, 百拇医药
表1 各组裸鼠生存期观察(天) 组别
裸鼠编号
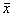 ±s
±s1
2
3
4
5
6
空白对照
22
26
30
, 百拇医药
32
34
36
30.0±4.8
131I组
22
22
23
25
26
28
24.3±2.2
抗-HBx单抗组
, 百拇医药
21
22
25
27
34
36
27.5±5.7
131I-抗-HBx单抗组
29
38
28
46
38
, 百拇医药
49
41.3±7.1
二、花瘤裸鼠肿瘤生长情况观察
第3周,对照组,I31组、抗-HBx单抗组、131I-抗HBx单抗组瘤体积分别为17.3、7.5、12、3.8cm3(表2),各实验组抑瘤率分别为40.0%、16.7%、72.7%,131I-抗HBx单抗组同对照组相比差异有非常显著意义(P<0.01)。131I组抑瘤率同对照组相比差异也有显著意义(P<0.05)。
表2 各组裸鼠瘤体大小观察(cm3,
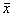 ±s) 组别
±s) 组别鼠数
, http://www.100md.com
给药后时间(d)
1
2
3
4
空白对照组
6
3.6±1.5
9.5±3.0
18.0±11.4
17.3±9.6
131I组
6
, 百拇医药
2.6±1.1
4.1±2.6
6.0±3.8
7.5±4.6
抗-HBx单抗组
6
3.0±2.3
5.1±4.3
8.0±6.6
12.0±8.7
131I-抗-HBx单抗组
6
, 百拇医药
2.9±0.7
3.4±0.8
3.4±0.8
3.8±1.3
三、病理观察结果
对照鼠癌组织中心部分可见片状坏死,周边细胞规整,结构致密。131I-抗HBx单抗组中心坏死范围巨大,肿瘤边缘组织也可见小片状坏死。
四、临床疗效
经2个疗程治疗后,患者一般情况明显改善,无明显不良反应,肝肾功能未见明显影响,αFP水平下降明显(图1)。B超及CT复查(图2,3)显示肿瘤明显缩小。1例因此而行二步切除。手术标本大体及镜下可见肿瘤大片坏死,除边缘个别区域尚残存少量肿瘤细胞外,均呈干酪样改变。另1例因一般情况较着而无法再次手术,但治疗后患者存活8个月。

, 百拇医药
图1 2例原发性肝癌患者经用131I-HBx单抗导向治疗后,血清AFP变化曲线

图2 肝癌术前CT图像

图3 经导向治疗后肿瘤明显缩小
讨论
随着新技术的广泛应用及研究的不断深入,HBxAg诱发HCC的确切机制将逐步得到认识。目前,HBV X基因的研究热点为HBxAg的致癌机制。以HBV X为靶基因进行的研究,将会使肝炎、肝癌的诊断、防治跃上一个新台阶[10,11]。
免疫组织化学检测曾显示BHBxAg在肝癌组织中表达异常活跃。在裸鼠放射免疫显像研究中,肿瘤获得了清晰显像,瘤/肝比达4.5。上述结果,为进一步开展动物实验及临床治疗奠定了基础。本研究应用131I-抗HBx单抗进行了裸鼠人肝癌模型的放射免疫治疗实验。空白对照、131I组生存期明显缩短,131I-抗HBx单抗组明显延长,后组与前两组比较,差异均有显著意义(P<0.05)。第3周时,4组肿瘤体积大小分别为17.3、7.5、12.0、3.8cm3,131I、抗HBx单抗、131I-抗HBx单抗抑瘤率分别为40%、16.7%、72.7%。131I组同对照组相比差异有显著意义(P<0.05)。131I-抗HBx单抗组与对照组相比,差异有非常显著意义(P<0.01)。结果显示,经腹腔注入131I后,裸鼠生存期明显缩短,肿瘤生长抑制明显;注入131I-抗HBx单抗后,裸鼠生存期明显延长,第3周时肿瘤抑制率达72.7%,生长明显抑制。抗-HBx单抗组的裸鼠生存期及肿瘤抑制率同对照组相比,差异均无显著意义(P>0.05),提示131I-抗HBx单抗在裸鼠人肝癌模型治疗实验中疗效显著。
, 百拇医药
在动物实验基础上,我们尚进行了少量临床研究。1例不切除的肝癌患者经131I-抗HBx单抗治疗后,因αFP降至正常,肿瘤明显缩小而获得了二步切除。切除标本大体及镜下观察均显示肿瘤基本坏死。另1例用药后αFP降至正常,患者已带瘤存活8个月,初步显示了良好的应用前景。此研究将抗HBx单抗用于肝癌的导向治疗,且取得了一定疗效。结果表明,在目前尚未发现肿瘤特异抗原的情况下,尽可能寻求肿瘤高亲和力物质为载体,运用于导向治疗具有一定的价值。
志谢 本研究所用基因工程产品HBxAg蛋白由德国癌症中心C.H.Schroder 先生惠赠,特致谢意。
参考文献
1 Beasley RP. Hepatitis B virus: the major etiology of hepato-cellular carrcinoma. Cancer, 1988, 61: 1942.
, http://www.100md.com
2 Wollersheim M, Debelka U, Hofschneicder PH. A trans-activation function encoded in the hepatitis B virus X gene is conserved in integrated state. Oncogene, 1988, 3: 545.
3 Twu JS, Lai MY, Chen DS, et al. Activation of protooncogene by the X protein of hepatitis B virus. Virology, 1993, 192: 346.
4 Wang XW, Forrester K, Yeh H, et al. Hepoatitis B virus X protein inhibits p53 sequence-specific DNA binding, transcriptional activity, and association with transcription factor ERCC3. Proc Natl Acad Sci USA, 1994, 91: 2230.
, 百拇医药
5 Menzo S, Clementi M, Alfani B, et al. Trans activation of epidermal growth factor receptor gene by the hepatitis B virus-gene product. Virology, 1993, 196: 878.
6 Shirakata Y, Kawada M, fujiki Y, et al. The X gene of hepatitis B virus induced growth stimulation and tumorigenic transformation of mouse NIH 3T3 cells. Jpn J Cancer Res, 1989, 80: 617.
7 Wang WL, London WY , Feitelson MA. Hepatitis B X antigen in hepatitis B virus carrier patients with liver cancer. Cancer Res, 1991, 51: 4971.
, 百拇医药
8 李君,汤钊猷,刘康达,等。放射标记抗HBx单克隆抗体在茶人肝癌裸鼠模型中的放射免疫定位研究。中华肿瘤杂志,1994,16:11。
9 Kohler G, Milstein g. Continuous culture of fused cells selecting antibody of predefined specificity. Nature, 1975, 256: 495.
10 Natoli G, Avantaggiati ML, Chirllo P, et al. Induction of the DNA-binding activity of c-fos heterodimers by the hepatitis B virus transactivation pX. Mol Cell Biol, 1994, 14: 989.
11 Muakami S, Cheong J, Ohno S, et al, Transactivation of human hepatitis B virus X protein, HBx, operates tjhrough a mechanism distinct from protein kinase C and okadaic acid activation pathways. Virology, 1994, 199:243.
(收稿:1995-06-29 修回:1995-12-12), http://www.100md.com