糖基化终末产物对肾小球系膜细胞表达纤溶酶原激活物抑制物1的影响
作者:邓义斌 陈香美 叶一舟 李 才 王 凡
单位:100853 北京,解放军总医院肾病科、解放军肾病中心(邓义斌、陈香美、叶一舟);白求恩医科大学应用基础医学研究所(李 才、王 凡)
关键词:纤溶酶原激活物抑制物1;肾小球;系膜细胞
中华医学杂志970911 目的 探讨非酶促糖基化终末产物是否影响肾小球系膜细胞降解肾小球细胞外基质的丝氨酸蛋白酶-纤溶酶原激活物抑制物1(PAI-1)基因表达和生物学活性。方法 用体外制备的非酶促糖基化牛血清白蛋白(AGE-BSA)作用人肾小球系膜细胞24小时和48小时,观察对细胞增殖、纤维连接蛋白分泌、PAI-1基因表达和生物学活性的作用。结果 AGE-BSA抑制肾小球系膜细胞增殖,促进纤维连接蛋白分泌,上调PAI-1生物学活性。AGE-BSA作用系膜细胞24小时后,PAI-1基因表达显著增加(0.65%±0.08%,对照0.45%±0.06%,P<0.05);48小时后PAI-1基因表达增加更趋显著(0.92%±0.10%,对照0.51±0.08,P<0.01)。结论 非酶促糖基化终末产物增加肾小球系膜细胞PAI-1基因表达和生物学活性,参与了肾小球细胞外基质积聚和肾小球硬化的病理生理过程。
, 百拇医药
Effects of glycated protein on the expression of plasminogen activator inhibitor-1 of cultured human mesangial cells Deng Yibin, Chen Xiangmei, Ye Yizhou, et al. Department of Nephrology, General Hospital of P.L.A, Kidney Center of P.L.A, Beijing 100853
Objective To investigate whether nonenzymatic glycated end products (AGEs) have effects on the expression and bioactivity of plasminogen activator inhibitor-1 (PAI-1), one of the seripin proteinases, which lead to extracellular matrix (ECM) degradation in cultured human mesangial cells. Methods Human mesangial cells (HMC) were cultured. Cell proliferation, fibronectin production, mRNA expression and bioactivity of PAI-1 were determined after exposure to AGE-BSA for 24 hours and 48 hours in vitro. Results HMC stimulated by AGE-BSA exhibited inhibition in HMC proliferation, increase in fibronectin production, and PAI-1 bioactivity. These changes were pronounced with prolongation of experimental time. PAI-1 mRNA expression increased significantly at 24hr (0.45%±0.06% vs 0.65%±0.08%, P<0.05), however more marked increase of PAI-1 mRNA expression at 48hr (0.51±0.08% vs 0.92±0.10%, P<0.01). Conclusions Increase of mRNA expression and bioactivity of PAI-1 induced by AGEs decreased ECM degradation and play an important role in the pathogenesis of ECM accumulation and glomerulosclerosis.
, 百拇医药
Key words Plasminogen activator inhibitor-1 Kidney glomerulus mesangial cell
(Natl Med J China, 1997,77:672-675)
近年研究证实,肾小球细胞外基质合成与降解的平衡,是决定肾小球细胞外基质集聚和肾小球硬化的重要环节[1]。纤溶酶原/纤溶酶(plasminogen/plasmin,PA)系统不仅参与机体凝血和纤溶系统的功能,而且是降解肾小球细胞外基质的主要丝氨酸蛋白酶类,纤溶酶原激活物抑制物(plasminogen activator inhibitor-1,PAI-1)是该中心环节的特异性生理调节因子,PAI-1的变化可能在肾小球硬化发生和进程中起着重要作用[2]。非酶促糖基化终末产物(advanced glycation end products,AGEs)诱导糖尿病性肾病的病理生理改变已得到证实[3]。肾小球系膜细胞是肾小球固有细胞合成细胞外基质最强的细胞,是导致肾小球硬化的特殊间质效应细胞。因此,研究AGEs是否影响肾小球系膜细胞PAI-1基因表达和生物学活性,而导致细胞外基质降解障碍和细胞外基质积聚,为从细胞外基质降解角度阐明糖尿病性肾病的发病机理和防治糖尿病性肾病提供新的理论依据。有关AGEs影响肾小球系膜细胞PAI-1基因表达或/和生物学活性的研究,迄今国内外尚少报道。
, 百拇医药
材料和方法
一、人肾小球系膜细胞分离、培养及鉴定
无菌取移植配型不合的成人肾脏,按照本室已建立的方法[4]进行细胞分离、培养和鉴定。本实验用第4~8代细胞。
二、牛血清白蛋白非酶促糖基化终末产物(AGE-BSA)制备
AGE-BSA制备参阅文献[5]进行。牛血清蛋白10mg/ml与500mg/L D-葡萄糖,在含有蛋白酶抑制剂和抗生素反应体系中,于37℃孵育6周,以等浓度的BSA加入不含葡萄糖的同样反应体系为对照。AGE-BSA经快速蛋白液相分离仪(FPLC),凝胶分子筛纯化,去除混杂成份。Hitachi 850荧光分光光度计于激发波长370 nm和发射波长440 nm测定AGE-BSA的荧光值,用以表示AGE含量。AGE-BSA为39.5,对照牛血清白蛋白(BSA)为3.15。蛋白质含量用考马斯亮蓝法测定。
, 百拇医药
三、AGE-BSA对人肾小球系膜细胞(HMC)增殖和纤维连接蛋白的影响
HMC以5×103细胞/孔种植于96孔培养板。24小时后,换无血清的RPMI 1640培养液,使细胞同步24小时,然后换含AGE-BSA(5 μg/cm2)的完全培养液(含10%胎牛血清,FCS美国GIBCO公司),继续培养24小时和48小时,以BSA为实验对照。细胞增殖测定采用改良的MTT法。实验结束时,收集相应HMC培养上清,于-70℃冻存备用,ELISA法测定培养上清纤维连接蛋白。
四、PAI-1生物学活性测定
培养上清与等量尿激酶型纤溶酶原激活物(u-PA)混合(0.031 U),25℃反应30分钟后,取样品加入纤维蛋白测定板,检测u-PA的残留生物学活性,以抑制u-PA的百分率表示PAI-1的生物学活性。
, 百拇医药
五、RNA提取及Northern杂交
人肾小球系膜细胞培养于75 cm2培养瓶,24小时后,换含无血清培养液,使细胞同步24小时后,换含AGE-BSA(5 μg/cm2)的完全培养液(含10% FCS),继续培养24小时和48小时,以BSA为对照组。实验结束时,用无钙镁的磷酸盐缓冲液洗细胞3次,RNAzolTMB提取细胞总RNA,紫外分光光度计和电泳分析RNA含量和质量。10 μg总RNA经15%甲醛变性处理的1%琼脂糖凝胶电泳后,转移至尼龙膜,短波紫外固定,预杂交液60℃预杂交4小时。PAI-1探针为质粒pUC19-PAI-1 EcoRI/BamHI酶切产物(本室构建),是克隆的人肾小球系膜细胞编码区全部序列,并经序列分析证实,长约1.2 kb。酶切产物经Geneclean纯化,用32P-dCTP随机引物法标记。65℃杂交12小时,洗膜,-70℃压片72小时,显影。凝胶图像分析仪进行密度扫描分析PAI-1杂交带(2.2 kb和3.0 kb)的密度并进行比较,人三磷酸甘油醛脱氢酶(GAPDH)为内参照,校正RNA取样量。
, 百拇医药
六、统计学分析
采用组间t检验,数据以 ±s表示。
±s表示。
结果
一、AGE-BSA对人肾小球系膜细胞增殖和纤维连接蛋白的影响
同对照组BSA相比,实验组AGE-BSA显著抑制肾小球系膜细胞增殖,增加培养上清纤维连接蛋白含量,这种变化随实验时期延长更趋明显(附表)。
二、AGE-BSA对PAI-1生物学活性的作用
AGE-BSA刺激肾小球系膜细胞24小时后,PAI-1活性为129%±4%,对照组100%±2%,48小时PAI-1活性为144%±4%,对照组100%±3%(图1)。
, 百拇医药
附表 AGE-BSA对肾小球系膜细胞增殖和纤维连接蛋白的影响( ±s) 组别
±s) 组别
标本数
24小时
48小时
细胞
增殖(A)
纤维连接蛋
白(pg/cell)
细胞
增殖(A)
纤维连接蛋白(pg/cell)
, 百拇医药
对照
6
0.28±0.05
124±16
0.36±0.06
112±20
实验
6
0.19±0.03*
159±27
0.21±0.02*
170±12*
, 百拇医药
* P<0.01,与对照组比较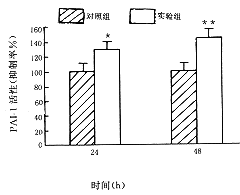
注:与对照组比较:24小时* P<0.05;48小时**P<0.01.
图1 AGE-BSA对PAI-1生物学活性的影响
1.24h对照;2.24h实验组 3.48h对照;4.48h实验组
图2 肾小球系膜细胞PAI-1Northern-blot结果
三、AGE-BSA对PAI-1基因表达的影响
, http://www.100md.com
Northern杂交显示PAI-1 mRNA表现为两条杂交带,即2.2 kb和3.0 kb(图2)。肾小球系膜细胞内参照GAPDH基因表达如图3所示。对3.0 kb和2.2 kb两种类型PAI-1 mRNA表达的密度比值定量分析表明:AGE-BSA作用系膜细胞24小时后,对照组和实验组分别为2.10±0.30和0.90±0.15;作用48小时后,对照组和实验组分别为1.98±0.25和0.86±0.10,结果表明AGE-BSA显著刺激2.2 kb PAI-1 mRNA表达。AGE-BSA刺激系膜细胞24小时后,PAI-1 mRNA(2.2 kb和3.0 kb)表达显著增加(0.65±0.08,P<0.05);48小时后PAI-1基因表达增加更趋显著(0.92±0.10,P<0.05)(图4)。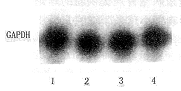
1.24h对照;2.24h实验组;3.48h对照;4.48h实验组
, 百拇医药
图3 肾小球系膜细胞GAPDH Northern-blot结果(图2所用膜)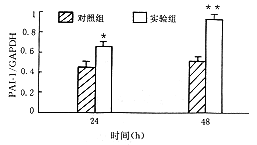
注:与对照组比较:24小时P<0.05;48小时P<0.01.
图4 肾小球系膜细胞PAI-I Northern-blot密度扫描分析结果
讨论
肾小球细胞外基质合成与降解的平衡,是决定肾小球细胞外基质积聚和肾小球硬化的重要环节。高糖和高糖与蛋白质大分子物质的赖氨酸残基等发生非酶促糖基化反应,形成具有高度反应特性的蛋白质AGEs,促进系膜细胞细胞外基质如Ⅳ型胶原,层粘连蛋白(Laminin,LM)和纤维连接蛋白等基因表达和蛋白质合成增加及其机制已有较深入研究,但关于AGEs是否影响肾小球细胞外基质降解,目前尚缺乏深入研究[6,7]。
, http://www.100md.com
我们及其他研究者的实验已证实:肾脏细胞外基质中AGEs积聚;AGEs导致肾小球系膜细胞外基质产生增加,基底膜增厚和肾小球毛细血管通透性增加[8,3]。
纤溶酶原/纤溶酶系统最近被证实为肾小球细胞外基质降解的主要丝氨酸蛋白酶系统。组织型纤溶酶原激活物(t-PA)和尿激酶型u-PA,促使纤溶酶原转变成纤溶酶,纤溶酶不仅降解肾小球细胞外基质而且激活肾小球降解细胞外基质的另一类蛋白酶系统-基质金属蛋白酶(MMPs),而t-PA和u-PA的生物学活性均能被PAI-1特异性抑制,因此,PAI-1的基因表达和生物学活性变化将导致肾小球细胞外基质降解障碍,参与细胞外基质积聚和肾小球硬化等病变过程[2]。我们的结果显示AGE-BSA刺激后,系膜细胞3.0和2.2 kb PAI-1 mRNA表达显著增强。导致两种类型的mRNA表达,其原因可能与人PAI-1多聚腺苷化信号AATAAA的5’端,有类似AATAAA的核苷酸顺序,如AATAAT,它亦可作为mRNA剪接的信号,从而形成两种类型的PAI-1 mRNA,二者区别仅在于3’端非编码区长度不同(约1.0 kb),但具有相同的氨基酸编码区,均能被翻译成同一种蛋白质[9]。以两杂交带密度值之和进行比较,AGE-BSA作用肾小球系膜细胞24小时,PAI-1 mRNA表达显著增加,作用48小时PAI-1 mRNA表达增加更趋明显。
, 百拇医药
肾小球系膜细胞PAI-1 mRNA表达和生物学活性增加将显著抑制t-PA和u-PA的生物学功能,使纤溶酶原转变为纤溶酶减少,导致肾小球细胞外基质降解障碍[10]。同时,AGE-BSA刺激系膜细胞外基质分泌增加,其最终效应就是过多的肾小球细胞外基质在系膜区积聚,致使肾小球系膜增宽,基底膜增厚,最终进展为肾小球硬化。因此,进一步研究PAI-1在糖尿病肾脏病变的基因和蛋白质表达及其生物学活性改变特点,探讨糖尿病肾脏病变发生过程中肾小球细胞外基质降解酶系统的功能变化,将为防治糖尿病性肾病的进展提出新的科学依据。
本课题为国家自然科学基金、优秀中青年人才基金、军队“九五”重点课题基金资助项目
参考文献
1 Schnaper HW. Balance between matrix synthesis and degradation: a determinant of glomerulosclerosis. Pediatr Nephrol, 1995,9:104.
, 百拇医药
2 Mignatti P. Extracellular matrix remodeling by metalloproteinases and plasminogen activators. Kidney Int, 1995,47(suppl 49):S12.
3 Yang CW, Vlassara H, Peten EP, et al. Advanced glycation end products up-regulate gene expression found in diabetic glomerulardisease. Proc Natl Acad Sci USA, 1994,91:9436.
4 于力方,陈香美,黎磊石.正常人肾小球系膜细胞培养的研究.中华肾脏病杂志,1990,6:70.
5 Doi t, Vlassara H, Kirstein M, et al. Receptor-specific increase in extracellular matrix production in mouse mesangial cells by advanced glycosylation end products is mediated via platelet-derived growth factor. Proc Natl Acad Sci USA, 1992,89:2873.
, http://www.100md.com
6 Ayo SH, Radnik GA, Glass WF, et al. Increased extracellular matrix synthesis and mRNA in mesangial cells grown in high glucose. Am J Physiol, 1991,260:F185.
7 Cohen MP, Ziyadeh FN. Amadori glucose adducts modulate mesangial cell growth and collagen gene expression. Kidney Int, 1994,45:475.
8 黄翠玲,李 才,邓义斌,等.大黄对糖尿病大鼠肾组织非酶促糖基化的影响.中国糖尿病杂志,1996,4:103.
9 Schleef RR, Bevilacque MP, Sawdey M, et al. Cytokine activation of vascular endothelium. J Biol Chem, 1988,263:5797.
10 NY T, Sawdey M, Lawrence D, et al. Cloning and sequence of a cDNA coding for the human beta-migrating endothelial-cell-type plasminogen activator inhibitor. Proc Natl. Acad Sci USA, 1986,83:6776.
(收稿:1996-12-18 修回:1997-06-20), 百拇医药
单位:100853 北京,解放军总医院肾病科、解放军肾病中心(邓义斌、陈香美、叶一舟);白求恩医科大学应用基础医学研究所(李 才、王 凡)
关键词:纤溶酶原激活物抑制物1;肾小球;系膜细胞
中华医学杂志970911 目的 探讨非酶促糖基化终末产物是否影响肾小球系膜细胞降解肾小球细胞外基质的丝氨酸蛋白酶-纤溶酶原激活物抑制物1(PAI-1)基因表达和生物学活性。方法 用体外制备的非酶促糖基化牛血清白蛋白(AGE-BSA)作用人肾小球系膜细胞24小时和48小时,观察对细胞增殖、纤维连接蛋白分泌、PAI-1基因表达和生物学活性的作用。结果 AGE-BSA抑制肾小球系膜细胞增殖,促进纤维连接蛋白分泌,上调PAI-1生物学活性。AGE-BSA作用系膜细胞24小时后,PAI-1基因表达显著增加(0.65%±0.08%,对照0.45%±0.06%,P<0.05);48小时后PAI-1基因表达增加更趋显著(0.92%±0.10%,对照0.51±0.08,P<0.01)。结论 非酶促糖基化终末产物增加肾小球系膜细胞PAI-1基因表达和生物学活性,参与了肾小球细胞外基质积聚和肾小球硬化的病理生理过程。
, 百拇医药
Effects of glycated protein on the expression of plasminogen activator inhibitor-1 of cultured human mesangial cells Deng Yibin, Chen Xiangmei, Ye Yizhou, et al. Department of Nephrology, General Hospital of P.L.A, Kidney Center of P.L.A, Beijing 100853
Objective To investigate whether nonenzymatic glycated end products (AGEs) have effects on the expression and bioactivity of plasminogen activator inhibitor-1 (PAI-1), one of the seripin proteinases, which lead to extracellular matrix (ECM) degradation in cultured human mesangial cells. Methods Human mesangial cells (HMC) were cultured. Cell proliferation, fibronectin production, mRNA expression and bioactivity of PAI-1 were determined after exposure to AGE-BSA for 24 hours and 48 hours in vitro. Results HMC stimulated by AGE-BSA exhibited inhibition in HMC proliferation, increase in fibronectin production, and PAI-1 bioactivity. These changes were pronounced with prolongation of experimental time. PAI-1 mRNA expression increased significantly at 24hr (0.45%±0.06% vs 0.65%±0.08%, P<0.05), however more marked increase of PAI-1 mRNA expression at 48hr (0.51±0.08% vs 0.92±0.10%, P<0.01). Conclusions Increase of mRNA expression and bioactivity of PAI-1 induced by AGEs decreased ECM degradation and play an important role in the pathogenesis of ECM accumulation and glomerulosclerosis.
, 百拇医药
Key words Plasminogen activator inhibitor-1 Kidney glomerulus mesangial cell
(Natl Med J China, 1997,77:672-675)
近年研究证实,肾小球细胞外基质合成与降解的平衡,是决定肾小球细胞外基质集聚和肾小球硬化的重要环节[1]。纤溶酶原/纤溶酶(plasminogen/plasmin,PA)系统不仅参与机体凝血和纤溶系统的功能,而且是降解肾小球细胞外基质的主要丝氨酸蛋白酶类,纤溶酶原激活物抑制物(plasminogen activator inhibitor-1,PAI-1)是该中心环节的特异性生理调节因子,PAI-1的变化可能在肾小球硬化发生和进程中起着重要作用[2]。非酶促糖基化终末产物(advanced glycation end products,AGEs)诱导糖尿病性肾病的病理生理改变已得到证实[3]。肾小球系膜细胞是肾小球固有细胞合成细胞外基质最强的细胞,是导致肾小球硬化的特殊间质效应细胞。因此,研究AGEs是否影响肾小球系膜细胞PAI-1基因表达和生物学活性,而导致细胞外基质降解障碍和细胞外基质积聚,为从细胞外基质降解角度阐明糖尿病性肾病的发病机理和防治糖尿病性肾病提供新的理论依据。有关AGEs影响肾小球系膜细胞PAI-1基因表达或/和生物学活性的研究,迄今国内外尚少报道。
, 百拇医药
材料和方法
一、人肾小球系膜细胞分离、培养及鉴定
无菌取移植配型不合的成人肾脏,按照本室已建立的方法[4]进行细胞分离、培养和鉴定。本实验用第4~8代细胞。
二、牛血清白蛋白非酶促糖基化终末产物(AGE-BSA)制备
AGE-BSA制备参阅文献[5]进行。牛血清蛋白10mg/ml与500mg/L D-葡萄糖,在含有蛋白酶抑制剂和抗生素反应体系中,于37℃孵育6周,以等浓度的BSA加入不含葡萄糖的同样反应体系为对照。AGE-BSA经快速蛋白液相分离仪(FPLC),凝胶分子筛纯化,去除混杂成份。Hitachi 850荧光分光光度计于激发波长370 nm和发射波长440 nm测定AGE-BSA的荧光值,用以表示AGE含量。AGE-BSA为39.5,对照牛血清白蛋白(BSA)为3.15。蛋白质含量用考马斯亮蓝法测定。
, 百拇医药
三、AGE-BSA对人肾小球系膜细胞(HMC)增殖和纤维连接蛋白的影响
HMC以5×103细胞/孔种植于96孔培养板。24小时后,换无血清的RPMI 1640培养液,使细胞同步24小时,然后换含AGE-BSA(5 μg/cm2)的完全培养液(含10%胎牛血清,FCS美国GIBCO公司),继续培养24小时和48小时,以BSA为实验对照。细胞增殖测定采用改良的MTT法。实验结束时,收集相应HMC培养上清,于-70℃冻存备用,ELISA法测定培养上清纤维连接蛋白。
四、PAI-1生物学活性测定
培养上清与等量尿激酶型纤溶酶原激活物(u-PA)混合(0.031 U),25℃反应30分钟后,取样品加入纤维蛋白测定板,检测u-PA的残留生物学活性,以抑制u-PA的百分率表示PAI-1的生物学活性。
, 百拇医药
五、RNA提取及Northern杂交
人肾小球系膜细胞培养于75 cm2培养瓶,24小时后,换含无血清培养液,使细胞同步24小时后,换含AGE-BSA(5 μg/cm2)的完全培养液(含10% FCS),继续培养24小时和48小时,以BSA为对照组。实验结束时,用无钙镁的磷酸盐缓冲液洗细胞3次,RNAzolTMB提取细胞总RNA,紫外分光光度计和电泳分析RNA含量和质量。10 μg总RNA经15%甲醛变性处理的1%琼脂糖凝胶电泳后,转移至尼龙膜,短波紫外固定,预杂交液60℃预杂交4小时。PAI-1探针为质粒pUC19-PAI-1 EcoRI/BamHI酶切产物(本室构建),是克隆的人肾小球系膜细胞编码区全部序列,并经序列分析证实,长约1.2 kb。酶切产物经Geneclean纯化,用32P-dCTP随机引物法标记。65℃杂交12小时,洗膜,-70℃压片72小时,显影。凝胶图像分析仪进行密度扫描分析PAI-1杂交带(2.2 kb和3.0 kb)的密度并进行比较,人三磷酸甘油醛脱氢酶(GAPDH)为内参照,校正RNA取样量。
, 百拇医药
六、统计学分析
采用组间t检验,数据以
 ±s表示。
±s表示。结果
一、AGE-BSA对人肾小球系膜细胞增殖和纤维连接蛋白的影响
同对照组BSA相比,实验组AGE-BSA显著抑制肾小球系膜细胞增殖,增加培养上清纤维连接蛋白含量,这种变化随实验时期延长更趋明显(附表)。
二、AGE-BSA对PAI-1生物学活性的作用
AGE-BSA刺激肾小球系膜细胞24小时后,PAI-1活性为129%±4%,对照组100%±2%,48小时PAI-1活性为144%±4%,对照组100%±3%(图1)。
, 百拇医药
附表 AGE-BSA对肾小球系膜细胞增殖和纤维连接蛋白的影响(
 ±s) 组别
±s) 组别标本数
24小时
48小时
细胞
增殖(A)
纤维连接蛋
白(pg/cell)
细胞
增殖(A)
纤维连接蛋白(pg/cell)
, 百拇医药
对照
6
0.28±0.05
124±16
0.36±0.06
112±20
实验
6
0.19±0.03*
159±27
0.21±0.02*
170±12*
, 百拇医药
* P<0.01,与对照组比较

注:与对照组比较:24小时* P<0.05;48小时**P<0.01.
图1 AGE-BSA对PAI-1生物学活性的影响

1.24h对照;2.24h实验组 3.48h对照;4.48h实验组
图2 肾小球系膜细胞PAI-1Northern-blot结果
三、AGE-BSA对PAI-1基因表达的影响
, http://www.100md.com
Northern杂交显示PAI-1 mRNA表现为两条杂交带,即2.2 kb和3.0 kb(图2)。肾小球系膜细胞内参照GAPDH基因表达如图3所示。对3.0 kb和2.2 kb两种类型PAI-1 mRNA表达的密度比值定量分析表明:AGE-BSA作用系膜细胞24小时后,对照组和实验组分别为2.10±0.30和0.90±0.15;作用48小时后,对照组和实验组分别为1.98±0.25和0.86±0.10,结果表明AGE-BSA显著刺激2.2 kb PAI-1 mRNA表达。AGE-BSA刺激系膜细胞24小时后,PAI-1 mRNA(2.2 kb和3.0 kb)表达显著增加(0.65±0.08,P<0.05);48小时后PAI-1基因表达增加更趋显著(0.92±0.10,P<0.05)(图4)。

1.24h对照;2.24h实验组;3.48h对照;4.48h实验组
, 百拇医药
图3 肾小球系膜细胞GAPDH Northern-blot结果(图2所用膜)

注:与对照组比较:24小时P<0.05;48小时P<0.01.
图4 肾小球系膜细胞PAI-I Northern-blot密度扫描分析结果
讨论
肾小球细胞外基质合成与降解的平衡,是决定肾小球细胞外基质积聚和肾小球硬化的重要环节。高糖和高糖与蛋白质大分子物质的赖氨酸残基等发生非酶促糖基化反应,形成具有高度反应特性的蛋白质AGEs,促进系膜细胞细胞外基质如Ⅳ型胶原,层粘连蛋白(Laminin,LM)和纤维连接蛋白等基因表达和蛋白质合成增加及其机制已有较深入研究,但关于AGEs是否影响肾小球细胞外基质降解,目前尚缺乏深入研究[6,7]。
, http://www.100md.com
我们及其他研究者的实验已证实:肾脏细胞外基质中AGEs积聚;AGEs导致肾小球系膜细胞外基质产生增加,基底膜增厚和肾小球毛细血管通透性增加[8,3]。
纤溶酶原/纤溶酶系统最近被证实为肾小球细胞外基质降解的主要丝氨酸蛋白酶系统。组织型纤溶酶原激活物(t-PA)和尿激酶型u-PA,促使纤溶酶原转变成纤溶酶,纤溶酶不仅降解肾小球细胞外基质而且激活肾小球降解细胞外基质的另一类蛋白酶系统-基质金属蛋白酶(MMPs),而t-PA和u-PA的生物学活性均能被PAI-1特异性抑制,因此,PAI-1的基因表达和生物学活性变化将导致肾小球细胞外基质降解障碍,参与细胞外基质积聚和肾小球硬化等病变过程[2]。我们的结果显示AGE-BSA刺激后,系膜细胞3.0和2.2 kb PAI-1 mRNA表达显著增强。导致两种类型的mRNA表达,其原因可能与人PAI-1多聚腺苷化信号AATAAA的5’端,有类似AATAAA的核苷酸顺序,如AATAAT,它亦可作为mRNA剪接的信号,从而形成两种类型的PAI-1 mRNA,二者区别仅在于3’端非编码区长度不同(约1.0 kb),但具有相同的氨基酸编码区,均能被翻译成同一种蛋白质[9]。以两杂交带密度值之和进行比较,AGE-BSA作用肾小球系膜细胞24小时,PAI-1 mRNA表达显著增加,作用48小时PAI-1 mRNA表达增加更趋明显。
, 百拇医药
肾小球系膜细胞PAI-1 mRNA表达和生物学活性增加将显著抑制t-PA和u-PA的生物学功能,使纤溶酶原转变为纤溶酶减少,导致肾小球细胞外基质降解障碍[10]。同时,AGE-BSA刺激系膜细胞外基质分泌增加,其最终效应就是过多的肾小球细胞外基质在系膜区积聚,致使肾小球系膜增宽,基底膜增厚,最终进展为肾小球硬化。因此,进一步研究PAI-1在糖尿病肾脏病变的基因和蛋白质表达及其生物学活性改变特点,探讨糖尿病肾脏病变发生过程中肾小球细胞外基质降解酶系统的功能变化,将为防治糖尿病性肾病的进展提出新的科学依据。
本课题为国家自然科学基金、优秀中青年人才基金、军队“九五”重点课题基金资助项目
参考文献
1 Schnaper HW. Balance between matrix synthesis and degradation: a determinant of glomerulosclerosis. Pediatr Nephrol, 1995,9:104.
, 百拇医药
2 Mignatti P. Extracellular matrix remodeling by metalloproteinases and plasminogen activators. Kidney Int, 1995,47(suppl 49):S12.
3 Yang CW, Vlassara H, Peten EP, et al. Advanced glycation end products up-regulate gene expression found in diabetic glomerulardisease. Proc Natl Acad Sci USA, 1994,91:9436.
4 于力方,陈香美,黎磊石.正常人肾小球系膜细胞培养的研究.中华肾脏病杂志,1990,6:70.
5 Doi t, Vlassara H, Kirstein M, et al. Receptor-specific increase in extracellular matrix production in mouse mesangial cells by advanced glycosylation end products is mediated via platelet-derived growth factor. Proc Natl Acad Sci USA, 1992,89:2873.
, http://www.100md.com
6 Ayo SH, Radnik GA, Glass WF, et al. Increased extracellular matrix synthesis and mRNA in mesangial cells grown in high glucose. Am J Physiol, 1991,260:F185.
7 Cohen MP, Ziyadeh FN. Amadori glucose adducts modulate mesangial cell growth and collagen gene expression. Kidney Int, 1994,45:475.
8 黄翠玲,李 才,邓义斌,等.大黄对糖尿病大鼠肾组织非酶促糖基化的影响.中国糖尿病杂志,1996,4:103.
9 Schleef RR, Bevilacque MP, Sawdey M, et al. Cytokine activation of vascular endothelium. J Biol Chem, 1988,263:5797.
10 NY T, Sawdey M, Lawrence D, et al. Cloning and sequence of a cDNA coding for the human beta-migrating endothelial-cell-type plasminogen activator inhibitor. Proc Natl. Acad Sci USA, 1986,83:6776.
(收稿:1996-12-18 修回:1997-06-20), 百拇医药