肿瘤坏死因子突变体TNF60的研究
作者:周 凯 娄永华 焦炳华
单位:
关键词:肿瘤坏死因子;基因缺失;聚合酶链反应
摘要 目的摘要 目的:寻找具有更强抗肿瘤活性及增强或抑制TNFα生物学活性的TNFα突变蛋白。方法和结果:应用PCR技术对rhTNFα进行大片段缺失突变,构建了rhTNFα分子N端缺失59个氨基酸的突变体TNF60的编码基因,插入pBV220载体并在蛋白酶缺陷的大肠杆菌SG1117中获得较高表达,表达量为20.4%。重组蛋白经变性、复性和纯化,纯度>97%。TNF60对L929,Hep-2,U937三株细胞均丧失了细胞毒性,但都表现出增强rhTNFα细胞毒性的作用。结论:rhTNFα大片段缺失突变体TNF60具有增强rhTNFα细胞毒性的作用。
中国图书资料分类法分类号 R 735.51
, 百拇医药
A study of a novel TNFα mutant TNF60
Zhou Kai, Lou Yonghua,Jiao Binghua (Department of Microbiology, Department of Basic Medicine, Second Military Medical University, Shanghai, 200433)
Abstract Objective: To investigate TNFα mutant with a high cytotoxicity or agonistic/antagonistic activity to NTFα. Methods and Results: Amino terminal deletion mutant of TNFα was prepared by protein engineering techniques. Encoding gene of mutant TNF60 with deletion of 59 amino acids at N-terminal of TNFα was constructed by PCR, which was cloned into pBV220 vector, and expressed in a protease-defective E.coli SG1117. The recombinant protein accumulated as inclusion bodies was denatured, refolded and purified. Mutant TNF60 exhibited an enhancement of rhTNFα cytotoxicity against some cell lines such as L929, Hep-2 and U937, though it had no cytotoxic activity itself. Conclusion: Mutant TNF60 has an augment of rhTNFα cytotoxic activity.
, 百拇医药
Key words tumor necrosis factor; gene deletion; polymerase chain reaction
肿瘤坏死因子α(TNFα)是由激活的单核巨噬细胞产生的多功能细胞因子。国内外对重组人TNFα(rhTNFα)的基础及临床研究结果表明,rhTNFα在发挥其抗肿瘤作用的同时,表现出较明显的全身毒副作用[1]。因此,人们希望通过蛋白质工程技术改造TNFα分子,以获得高效低毒的TNFα突变体。对TNFα的蛋白质改造,主要通过缺失突变和定点突变,对分子的N端、C端和分子中部的某个或某些氨基酸进行置换、缺失或增加,基本不改变其分子的空间结构[2,3]。Creasey等[4]研究了TNFα N端缺失2,4,7,8,10个氨基酸的突变体,其中缺失7个氨基酸,细胞毒活性增加2~3倍;缺失10个氨基酸,活性明显下降;缺失12个氨基酸,活性完全丧失。关于N端12位以后氨基酸的缺失突变则没有报道。我们设想对TNFα分子N端作较大片段的缺失突变,从更广泛的范围寻找具有更强抗肿瘤活性及增强或抑制TNFα生物学活性的突变蛋白。根据TNFα的X-衍射分析,其分子内的二硫键连接两个β片层,对维持TNFα空间结构及其与受体相互作用具有重要意义。我们设计了保留TNFα分子的Cys69~Cys101二硫键、N端缺失59个氨基酸的突变体TNF60,对其进行了表达、纯化及生物学功能研究。
, 百拇医药
1 材料和方法1.1 试剂与细菌 大肠杆菌JM103,SG1117为本室冻存,限制性内切酶、连接酶购自Promega公司,表达载体pBV220购自中国科学院病毒学研究所,低分子量PCR marker及标准蛋白marker分别购自Gibco及上海东风生物技术公司,其他试剂均为进口及国产分析纯。
1.2 质粒DNA的抽提、酶切、片段回收、连接、转化及重组子鉴定 参照文献[5]有关方法进行。
1.3 PCR扩增 突变引物由生工生物工程公司用固相亚磷酰胺法合成并纯化。引物1:5′ AAA GAA TTC ATG TCC CAG GTC CTC TTC AAG GGC CAA GGC 3′,在起始密码子后是rhTNFα 60位以后的氨基酸编码序列,含EcoRⅠ酶切位点;引物2:5′ TTT GGA TCC TTA CAG GGC AAT GAT CCC AAA GTA 3′,为天然hTNFα分子3′端(C端)编码序列的互补序列,含终止密码子及BamHⅠ酶切位点。以含有rhTNFα基因cDNA质粒为模板,在PE2400 PCR仪上进行扩增。
, 百拇医药
1.4 DNA序列测定 采用Sanger双脱氧末端终止法,按照Pharmacia公司T7DNA测序试剂盒说明进行。
1.5 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE) 采用Laemmli方法。
1.6 TNF60重组蛋白的纯化 工程菌活化后进行诱导表达。菌体超声破碎,用8 mol/L盐酸胍抽提包涵体,经Sephacryl S-200(Pharmacia产品)凝胶过滤,收集相对分子质量为1.05万的组分进行复性,用Sephadex G-25(Pharmacia产品)脱盐,经Superdex 75在Pharmacia 快速蛋白液相色谱系统上进一步纯化。采用Lowry法测定蛋白质浓度。
1.7 生物学活性测定 分别以细胞毒法和MTT法检测TNF60对L929(德国马普免疫生物学研究所惠赠)、Hep-2(中国科学院细胞学研究所)和U937细胞(本室冻存)的细胞毒性/细胞生长抑制活性,及与 rhTNFα联合作用的生物学活性,百分细胞数活性计算参照文献[6]。
, 百拇医药
1.8 统计学方法 采用配对t检验法。
2 结 果2.1 TNF60基因的PCR扩增及序列分析 以rhTNFα质粒为模板,引物1、引物2与模板退火,在TaqDNA聚合酶作用下按上述方法扩增TNF60 cDNA片段。2.0%琼脂糖凝胶电泳结果提示,PCR扩增产物为均一条带,大小约312 bp(图1)。该片段编码的氨基酸序列与原型rhTNFα分子相比,在N端缺失了59个氨基酸,全长98个氨基酸。扩增产物以EcoRⅠ和BamHⅠ双酶切,连接到同样双酶切的pUC19载体,转化大肠杆菌JM103,抽提质粒DNA并进行酶切鉴定,酶切产物为2.7 kb和312 bp两片段(结果未显示)。以双脱氧法进行DNA序列分析(图2)表明,在EcoRⅠ酶 切 位 点 之 后 是 rhTNFα 59位氨基酸以后的编码序列,与预期设计
, 百拇医药
图1 TNF60 PCR扩增产物的琼脂糖凝胶电泳
Fig 1 Electrophoresis of PCR products of mutant TNF60
A: Ready-load φ×174 RF DNA/Hae Ⅲ fragments;
B: PCR product (312 bp); C: pUC19
图2 突变体TNF60编码序列的测定
Fig 2 DNA sequencing of mutant TNF60
, 百拇医药
完全一致。
2.2 TNF60表达质粒的构建及鉴定 图3为pBV-TNF60表达质粒构建示意图。将DNA序列分析正确的pUC-TNF60质粒以EcoRⅠ和Bam HⅠ双酶切,连接到同样双酶切的pBV220载体,转化大肠杆菌JM103,挑选可疑重组子,并抽提质粒DNA后酶切鉴定,酶切产物为312 bp和3.66 kb两条带(图4)。
2.3 TNF60在大肠杆菌中的表达及纯化 TNF60表达菌株在42℃诱导表达后超声破碎。SDS-PAGE分析表明,TNF60以包涵体形式表达,表达量为20.4%, 重组蛋白相对分子质量为1.05万,与根据氨基酸推测分子质量接近。 工程菌发酵后, 经包涵体抽提、变性、复性及凝胶过滤等一系列处理, 获得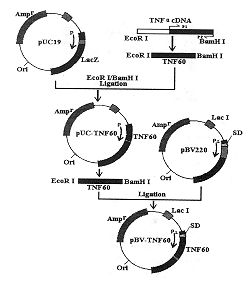
, 百拇医药
图3 pBV-TNF60表达质粒的构建
Fig 3 Construction of expression plasmid pBV-TNF60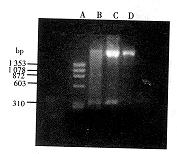
图4 pBV-TNF60的酶切鉴定
Fig 4 Characterization of recombinant
plasmid pBV-TNF60
A: Ready-load φ×174 RF DNA/Hae Ⅲ fragments; B,C: TNF60 digested with EcoRⅠ and BamHⅠ (clone 1 and 2); D: pBV220
, http://www.100md.com
vector digested with EcoRⅠ and BamHⅠ
TNF60重组蛋白, 纯度>97%, 纯化过程的SDS-PAGE如图5。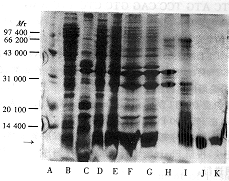
图5 TNF60蛋白表达及纯化的SDS-PAGE
Fig 5 SDS-PAGE of purified TNF60 protein
A: Protein MW marker; B: Vector; C: Supernatant after ultrasonication; D:Precipitate after ultrasonication; E:Precipitate after PBS; F: Precipitate after A solution; G: Precipitate after B solution; H: 1st peak on Sephacryl S-200 chromatogram; I: 2nd peak on Sepha- cryl S-200 chromatogram; J: Purified TNF60 on Sephacryl S-200
, 百拇医药
chromatogram;K: Purified TNF60 on Superdex 75 chromatogram
2.4 TNF60的生物学活性测定 TNF60对鼠成纤维细胞L929、人喉癌细胞Hep-2和人白血病细胞U937的细胞毒活性,及与rhTNFα联合作用的生物学活性测定结果表明,150μg/ml TNF60在这3株细胞上均丧失了细胞毒活性。但TNF60和rhTNFα联合作用组与rhTNFα标准品组间百分细胞数活性相差显著(P<0.01),说明TNF60对3株不同来源的细胞具有不同程度地增强rhTNFα细胞毒作用的活性,增强作用分别为5.10倍、4.27倍和7.56倍(表1)。
3 讨 论
近年来,在TNFα分子结构与功能相互关系研
表1 TNF60对rhTNFα细胞毒活性的增强作用
, 百拇医药
Tab 1 Effects of TNF60 on rhTNFα′s cytotoxicity/cytostasis(n=3,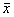 ±s)
±s)
Proteins
Specific activity/(λB / U*ml-1)
L929
Hep-2
U937
TNF60
<10
, 百拇医药
<10
<10
rhTNFα
(3.33±0.18)×104
(2.93±0.30)×104
(1.63±0.23)×104
rhTNFα+TNF60
(1.68±0.29)×105
(1.25±0.29)×105
(1.23±0.25)×105
, 百拇医药
究基础上,国内外学者以提高TNFα活性,降低其毒性为目的,应用蛋白质工程技术对TNFα分子进行修饰和改造,获得了大量TNFα突变体。分析关于TNFα分子改造途径以及TNFα突变体研究成果具有如下特点:大体上不改变TNFα分子的空间结构,在分子的N端最多缺失到12位氨基酸;以筛选高活性突变体为目的,对于细胞毒活性丧失的突变体没有研究其他的生物学功能;仅研究以可溶形式表达的突变蛋白的生物学活性,对以包涵体表达的突变体则没有深入研究[7~9]。本研究首先尝试了对TNFα分子作较大片段的缺失突变,应用PCR技术扩增了TNF60编码基因,并在蛋白酶缺陷的大肠杆菌SG1117中得到较高表达,获得了保留TNFα分子内二硫键,N端缺失59个氨基酸的突变体TNF60蛋白。TNF60作为TNFα分子大片段缺失的突变体蛋白,表现出增强rhTNFα细胞毒活性的作用,这一点在3株不同来源的细胞均得到证实,但其增强作用机制尚有待进一步研究。有关TNF60的体内试验结果另文报道。在TNFα的蛋白质改造中,对TNFα分子进行更广泛的修饰,产生一些具有拮抗或协同等新的生物学活性的突变体,以增强TNFα的抗肿瘤活性,拮抗其毒副作用,是TNFα分子改造的另一条值得尝试的途径。
, http://www.100md.com
参 考 文 献
1 Tracey KS, Cerami A. Tumor necrosis factor: a pleitropic cytokine and therapeutic target. Annu Rev Med, 1994, 45(5): 491
2 Nakamura S, Kato A, Masegi T, et al. A novel recombinant tumor necrosis factor α mutant with increased antitumor activity and lower toxicity. Int J Cancer,1991, 48(5):744
3 Masegi T, Kato A, Kitai K, et al. Characterization of a novel human tumor necrosis factor-α mutant with increased cytotoxic activity. Jpn J Cancer Res, 1995, 86(2): 72
, 百拇医药
4 Creasey AA, Doyle LV, Reynolds MT, et al. Biological effects of recombinant human tumor necrosis factor and its novel muteins on tumor and normal cell lines. Cancer Res, 1987,47(1):145
5 李尹雄. 基因克隆技术. 见:卢圣栋主编. 现代分子生物学实验技术. 北京:高等教育出版社,1993. 264~301
6 余伟明. TNF的活性检测. 见: 余伟明, 焦炳华主编. 肿瘤坏死因子及相关细胞毒素. 上海: 上海科学技术出版社, 1990. 64~70
7 van Ostade X, Vandenageele P, Tavernier J, et al. Human tumor necrosis factor mutants with preferential binding to and activity on either the R55 or R75 receptor. Eur J Biochem, 1994, 220(3): 771
, 百拇医药
8 Shikama H, Miyata K, Sakae N, et al. Novel mutein of tumor necrosis factor alpha(F4614) with reduced hypotensive effect. J Interferon Cytokine Res, 1995, 15(8):677
9 Xi T, Shi X, Guo D, et al. Biological activities of human tumor necrosis factor-alpha and its novel mutants. Biochem Mol Biol Int, 1996,38(6):1183
(1997-11-12收稿,1998-02-16修回), http://www.100md.com
单位:
关键词:肿瘤坏死因子;基因缺失;聚合酶链反应
摘要 目的摘要 目的:寻找具有更强抗肿瘤活性及增强或抑制TNFα生物学活性的TNFα突变蛋白。方法和结果:应用PCR技术对rhTNFα进行大片段缺失突变,构建了rhTNFα分子N端缺失59个氨基酸的突变体TNF60的编码基因,插入pBV220载体并在蛋白酶缺陷的大肠杆菌SG1117中获得较高表达,表达量为20.4%。重组蛋白经变性、复性和纯化,纯度>97%。TNF60对L929,Hep-2,U937三株细胞均丧失了细胞毒性,但都表现出增强rhTNFα细胞毒性的作用。结论:rhTNFα大片段缺失突变体TNF60具有增强rhTNFα细胞毒性的作用。
中国图书资料分类法分类号 R 735.51
, 百拇医药
A study of a novel TNFα mutant TNF60
Zhou Kai, Lou Yonghua,Jiao Binghua (Department of Microbiology, Department of Basic Medicine, Second Military Medical University, Shanghai, 200433)
Abstract Objective: To investigate TNFα mutant with a high cytotoxicity or agonistic/antagonistic activity to NTFα. Methods and Results: Amino terminal deletion mutant of TNFα was prepared by protein engineering techniques. Encoding gene of mutant TNF60 with deletion of 59 amino acids at N-terminal of TNFα was constructed by PCR, which was cloned into pBV220 vector, and expressed in a protease-defective E.coli SG1117. The recombinant protein accumulated as inclusion bodies was denatured, refolded and purified. Mutant TNF60 exhibited an enhancement of rhTNFα cytotoxicity against some cell lines such as L929, Hep-2 and U937, though it had no cytotoxic activity itself. Conclusion: Mutant TNF60 has an augment of rhTNFα cytotoxic activity.
, 百拇医药
Key words tumor necrosis factor; gene deletion; polymerase chain reaction
肿瘤坏死因子α(TNFα)是由激活的单核巨噬细胞产生的多功能细胞因子。国内外对重组人TNFα(rhTNFα)的基础及临床研究结果表明,rhTNFα在发挥其抗肿瘤作用的同时,表现出较明显的全身毒副作用[1]。因此,人们希望通过蛋白质工程技术改造TNFα分子,以获得高效低毒的TNFα突变体。对TNFα的蛋白质改造,主要通过缺失突变和定点突变,对分子的N端、C端和分子中部的某个或某些氨基酸进行置换、缺失或增加,基本不改变其分子的空间结构[2,3]。Creasey等[4]研究了TNFα N端缺失2,4,7,8,10个氨基酸的突变体,其中缺失7个氨基酸,细胞毒活性增加2~3倍;缺失10个氨基酸,活性明显下降;缺失12个氨基酸,活性完全丧失。关于N端12位以后氨基酸的缺失突变则没有报道。我们设想对TNFα分子N端作较大片段的缺失突变,从更广泛的范围寻找具有更强抗肿瘤活性及增强或抑制TNFα生物学活性的突变蛋白。根据TNFα的X-衍射分析,其分子内的二硫键连接两个β片层,对维持TNFα空间结构及其与受体相互作用具有重要意义。我们设计了保留TNFα分子的Cys69~Cys101二硫键、N端缺失59个氨基酸的突变体TNF60,对其进行了表达、纯化及生物学功能研究。
, 百拇医药
1 材料和方法1.1 试剂与细菌 大肠杆菌JM103,SG1117为本室冻存,限制性内切酶、连接酶购自Promega公司,表达载体pBV220购自中国科学院病毒学研究所,低分子量PCR marker及标准蛋白marker分别购自Gibco及上海东风生物技术公司,其他试剂均为进口及国产分析纯。
1.2 质粒DNA的抽提、酶切、片段回收、连接、转化及重组子鉴定 参照文献[5]有关方法进行。
1.3 PCR扩增 突变引物由生工生物工程公司用固相亚磷酰胺法合成并纯化。引物1:5′ AAA GAA TTC ATG TCC CAG GTC CTC TTC AAG GGC CAA GGC 3′,在起始密码子后是rhTNFα 60位以后的氨基酸编码序列,含EcoRⅠ酶切位点;引物2:5′ TTT GGA TCC TTA CAG GGC AAT GAT CCC AAA GTA 3′,为天然hTNFα分子3′端(C端)编码序列的互补序列,含终止密码子及BamHⅠ酶切位点。以含有rhTNFα基因cDNA质粒为模板,在PE2400 PCR仪上进行扩增。
, 百拇医药
1.4 DNA序列测定 采用Sanger双脱氧末端终止法,按照Pharmacia公司T7DNA测序试剂盒说明进行。
1.5 十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE) 采用Laemmli方法。
1.6 TNF60重组蛋白的纯化 工程菌活化后进行诱导表达。菌体超声破碎,用8 mol/L盐酸胍抽提包涵体,经Sephacryl S-200(Pharmacia产品)凝胶过滤,收集相对分子质量为1.05万的组分进行复性,用Sephadex G-25(Pharmacia产品)脱盐,经Superdex 75在Pharmacia 快速蛋白液相色谱系统上进一步纯化。采用Lowry法测定蛋白质浓度。
1.7 生物学活性测定 分别以细胞毒法和MTT法检测TNF60对L929(德国马普免疫生物学研究所惠赠)、Hep-2(中国科学院细胞学研究所)和U937细胞(本室冻存)的细胞毒性/细胞生长抑制活性,及与 rhTNFα联合作用的生物学活性,百分细胞数活性计算参照文献[6]。
, 百拇医药
1.8 统计学方法 采用配对t检验法。
2 结 果2.1 TNF60基因的PCR扩增及序列分析 以rhTNFα质粒为模板,引物1、引物2与模板退火,在TaqDNA聚合酶作用下按上述方法扩增TNF60 cDNA片段。2.0%琼脂糖凝胶电泳结果提示,PCR扩增产物为均一条带,大小约312 bp(图1)。该片段编码的氨基酸序列与原型rhTNFα分子相比,在N端缺失了59个氨基酸,全长98个氨基酸。扩增产物以EcoRⅠ和BamHⅠ双酶切,连接到同样双酶切的pUC19载体,转化大肠杆菌JM103,抽提质粒DNA并进行酶切鉴定,酶切产物为2.7 kb和312 bp两片段(结果未显示)。以双脱氧法进行DNA序列分析(图2)表明,在EcoRⅠ酶 切 位 点 之 后 是 rhTNFα 59位氨基酸以后的编码序列,与预期设计

, 百拇医药
图1 TNF60 PCR扩增产物的琼脂糖凝胶电泳
Fig 1 Electrophoresis of PCR products of mutant TNF60
A: Ready-load φ×174 RF DNA/Hae Ⅲ fragments;
B: PCR product (312 bp); C: pUC19

图2 突变体TNF60编码序列的测定
Fig 2 DNA sequencing of mutant TNF60
, 百拇医药
完全一致。
2.2 TNF60表达质粒的构建及鉴定 图3为pBV-TNF60表达质粒构建示意图。将DNA序列分析正确的pUC-TNF60质粒以EcoRⅠ和Bam HⅠ双酶切,连接到同样双酶切的pBV220载体,转化大肠杆菌JM103,挑选可疑重组子,并抽提质粒DNA后酶切鉴定,酶切产物为312 bp和3.66 kb两条带(图4)。
2.3 TNF60在大肠杆菌中的表达及纯化 TNF60表达菌株在42℃诱导表达后超声破碎。SDS-PAGE分析表明,TNF60以包涵体形式表达,表达量为20.4%, 重组蛋白相对分子质量为1.05万,与根据氨基酸推测分子质量接近。 工程菌发酵后, 经包涵体抽提、变性、复性及凝胶过滤等一系列处理, 获得

, 百拇医药
图3 pBV-TNF60表达质粒的构建
Fig 3 Construction of expression plasmid pBV-TNF60

图4 pBV-TNF60的酶切鉴定
Fig 4 Characterization of recombinant
plasmid pBV-TNF60
A: Ready-load φ×174 RF DNA/Hae Ⅲ fragments; B,C: TNF60 digested with EcoRⅠ and BamHⅠ (clone 1 and 2); D: pBV220
, http://www.100md.com
vector digested with EcoRⅠ and BamHⅠ
TNF60重组蛋白, 纯度>97%, 纯化过程的SDS-PAGE如图5。

图5 TNF60蛋白表达及纯化的SDS-PAGE
Fig 5 SDS-PAGE of purified TNF60 protein
A: Protein MW marker; B: Vector; C: Supernatant after ultrasonication; D:Precipitate after ultrasonication; E:Precipitate after PBS; F: Precipitate after A solution; G: Precipitate after B solution; H: 1st peak on Sephacryl S-200 chromatogram; I: 2nd peak on Sepha- cryl S-200 chromatogram; J: Purified TNF60 on Sephacryl S-200
, 百拇医药
chromatogram;K: Purified TNF60 on Superdex 75 chromatogram
2.4 TNF60的生物学活性测定 TNF60对鼠成纤维细胞L929、人喉癌细胞Hep-2和人白血病细胞U937的细胞毒活性,及与rhTNFα联合作用的生物学活性测定结果表明,150μg/ml TNF60在这3株细胞上均丧失了细胞毒活性。但TNF60和rhTNFα联合作用组与rhTNFα标准品组间百分细胞数活性相差显著(P<0.01),说明TNF60对3株不同来源的细胞具有不同程度地增强rhTNFα细胞毒作用的活性,增强作用分别为5.10倍、4.27倍和7.56倍(表1)。
3 讨 论
近年来,在TNFα分子结构与功能相互关系研
表1 TNF60对rhTNFα细胞毒活性的增强作用
, 百拇医药
Tab 1 Effects of TNF60 on rhTNFα′s cytotoxicity/cytostasis(n=3,
Proteins
Specific activity/(λB / U*ml-1)
L929
Hep-2
U937
TNF60
<10
, 百拇医药
<10
<10
rhTNFα
(3.33±0.18)×104
(2.93±0.30)×104
(1.63±0.23)×104
rhTNFα+TNF60
(1.68±0.29)×105
(1.25±0.29)×105
(1.23±0.25)×105
, 百拇医药
究基础上,国内外学者以提高TNFα活性,降低其毒性为目的,应用蛋白质工程技术对TNFα分子进行修饰和改造,获得了大量TNFα突变体。分析关于TNFα分子改造途径以及TNFα突变体研究成果具有如下特点:大体上不改变TNFα分子的空间结构,在分子的N端最多缺失到12位氨基酸;以筛选高活性突变体为目的,对于细胞毒活性丧失的突变体没有研究其他的生物学功能;仅研究以可溶形式表达的突变蛋白的生物学活性,对以包涵体表达的突变体则没有深入研究[7~9]。本研究首先尝试了对TNFα分子作较大片段的缺失突变,应用PCR技术扩增了TNF60编码基因,并在蛋白酶缺陷的大肠杆菌SG1117中得到较高表达,获得了保留TNFα分子内二硫键,N端缺失59个氨基酸的突变体TNF60蛋白。TNF60作为TNFα分子大片段缺失的突变体蛋白,表现出增强rhTNFα细胞毒活性的作用,这一点在3株不同来源的细胞均得到证实,但其增强作用机制尚有待进一步研究。有关TNF60的体内试验结果另文报道。在TNFα的蛋白质改造中,对TNFα分子进行更广泛的修饰,产生一些具有拮抗或协同等新的生物学活性的突变体,以增强TNFα的抗肿瘤活性,拮抗其毒副作用,是TNFα分子改造的另一条值得尝试的途径。
, http://www.100md.com
参 考 文 献
1 Tracey KS, Cerami A. Tumor necrosis factor: a pleitropic cytokine and therapeutic target. Annu Rev Med, 1994, 45(5): 491
2 Nakamura S, Kato A, Masegi T, et al. A novel recombinant tumor necrosis factor α mutant with increased antitumor activity and lower toxicity. Int J Cancer,1991, 48(5):744
3 Masegi T, Kato A, Kitai K, et al. Characterization of a novel human tumor necrosis factor-α mutant with increased cytotoxic activity. Jpn J Cancer Res, 1995, 86(2): 72
, 百拇医药
4 Creasey AA, Doyle LV, Reynolds MT, et al. Biological effects of recombinant human tumor necrosis factor and its novel muteins on tumor and normal cell lines. Cancer Res, 1987,47(1):145
5 李尹雄. 基因克隆技术. 见:卢圣栋主编. 现代分子生物学实验技术. 北京:高等教育出版社,1993. 264~301
6 余伟明. TNF的活性检测. 见: 余伟明, 焦炳华主编. 肿瘤坏死因子及相关细胞毒素. 上海: 上海科学技术出版社, 1990. 64~70
7 van Ostade X, Vandenageele P, Tavernier J, et al. Human tumor necrosis factor mutants with preferential binding to and activity on either the R55 or R75 receptor. Eur J Biochem, 1994, 220(3): 771
, 百拇医药
8 Shikama H, Miyata K, Sakae N, et al. Novel mutein of tumor necrosis factor alpha(F4614) with reduced hypotensive effect. J Interferon Cytokine Res, 1995, 15(8):677
9 Xi T, Shi X, Guo D, et al. Biological activities of human tumor necrosis factor-alpha and its novel mutants. Biochem Mol Biol Int, 1996,38(6):1183
(1997-11-12收稿,1998-02-16修回), http://www.100md.com