冷冻保存胎兔颅骨骨膜修复关节软骨缺损的实验研究
作者:蔡善保1 胡汝麒1 王海燕2 周建生1 潘功平1
单位:1 蚌埠医学院附属医院骨科(安徽蚌埠,233004);2 ICU病房
关键词:低温保存;颅骨骨膜;胎兔;同种异体移植
中国修复重建外科杂志980215 摘 要 为探讨关节软骨缺损的修复方法,采用家兔30只,平均分成两组。在每个动物的双侧髌股关节股骨关节面作4 mm×7 mm全层软骨缺损。将经二步冷冻法保存的胎兔颅骨骨膜移植于一组动物一侧后肢作为实验组,另一侧用自体骨膜移植作为自体对照组。在另一组动物的一侧后肢用新鲜胎兔颅骨骨膜移植作为新鲜对照组,另一侧关节软骨缺损不修复作为空白对照组。术后肢体不作外固定。16周后取材,经大体观察、组织学观察及氨基酸成分分析。结果发现,经冷冻保存的胎兔颅骨骨膜移植后能形成透明样软骨,与自体对照组无显著性差异(P>0.05),与新鲜对照组及空白对照组主要指标有显著性差异(P<0.05)。氨基酸分析示实验组新生物接近纤维软骨(P>0.05)。认为,冷冻胎兔颅骨骨膜移植为关节软骨缺损的修复提供了实验依据。
, 百拇医药
REPAIR OF CARTILAGE DEFECT IN JOINT WITH TRANSPLANTATION OF CRYOPRESERVED HOMOLOGOUS EMBRYONIC PERIOSFEUM OF RABBITS/Cai Shanbao, Hu Rugi, Wang Haiyan, et al. Affiliated Hospital of Bangbu Medical College, Bangbu, Anhui, P. R. China 233004
Abstract In order to repair cartilage defect in joint with transplantation of cryopreserved homologous embryonic periosteum, 30 rabbits were used and divided into two groups. A 4 mm×7 mm whole thickness cartilage defect was made in the patellar groove of femur of each rabbit. The homologous embryonic rabbit skull periosteum (ERSP), preserved in two-step freezing schedule, was transplanted onto the cartilage defect of joints of one group and autogenous periosteal graft was done in the joint defect of the other group. The knees were not immobilized, following operation and 16 weeks later, the newly formed tissue in the defects were assessed by gross observation, histochemical examination and biochemical analysis. The results showed that new hyaline-like cartilage was formed in the cryopreserved ERSP grafted knee, and had no significant difference from that of the knee receiving autogenous periosteal graft, but had significant difference from that of the fresh ERSP grafted knee and the non-grafted knee. Furthermore, the new hyaline-like cartilage had the biochemical characteristics of a fibrous cartilage. The conclusion was that this method might be feasible to repair articular cartilage defects.
, 百拇医药
Key words Cryopreservation Embryonic rabbit Skull periosteum Homotransplantation
关节软骨缺损的生物学修复是骨科临床中的难题。迄今虽在实验及临床研究上取得了一些进展,然而大多数研究都着重于自体骨膜、软骨膜移植,经常遇到供区有限和不适于自体移植等情况。基于自体骨膜及软骨膜移植修复关节软骨缺损已在实验与临床应用上取得了成功[1,2];二步冷冻已成功地保存游离软骨细胞[3];胚胎组织不仅抗原性弱而且有强的衍生能力。因此,我们设想用冷冻保存的胎兔颅骨骨膜同种异体移植修复关节软骨缺损,旨在明确其在关节环境中的演变与转归,为临床应用提供实验依据。
1 材料与方法
将孕龄26天~28天健康孕兔无菌下剖腹取出活胎兔30只,处死后5分钟内锐性切取胎兔颅骨骨膜。15只材料不经冷冻直接作移植用,另15只材料用4℃磷酸缓冲液冲洗,移植于盛有4℃含7.5% 二甲基亚砜Hanks液冻存管中,保存30分钟,然后移入深低温冰箱(Sanyo MDF 291 AT型)中,以-1℃/min速率降至-40℃并维持30分钟,再移入-196℃液氮中保存24小时。用时取出用37℃水浴快速复温,Hanks液冲洗3遍。取健康家兔30只,雌雄不拘,体重(2.5±0.25) kg。以每组15只分成两组,在双侧髌股关节的股骨关节面作4 mm×7 mm深达软骨下松质骨(以出血为度)全层软骨缺损。将经冷冻复温处理的胎兔颅骨骨膜及自体骨膜(取同侧胫骨内面)移植于第一组双后肢,左侧为冷冻胎兔颅骨膜(以下称实验组),右侧为自体骨膜(以下称自体对照组);将未经冷冻的新鲜胎兔颅骨膜移植于第二组动物左后肢(以下称为新鲜对照组),右后肢缺损空置(以下称空白对照组)。所有移植物均用6/0无损伤尼龙针线固定于缺损处,术后双膝关节不固定,16周后处死动物。参照Shawn法[4]分别作大体观察及组织学观察;参照Johnson法[5],将实验组与自体对照组新生物作氨基酸分析,并与正常透明软骨(股骨髁软骨)及纤维软骨(半月板)作比较。形态学观察各指标出现阳性率,用四格表确切概率法处理,氨基酸分析结果用方差分析及q检验处理。
, 百拇医药
2 结果
2.1 大体观察
实验组软骨缺损区与自体对照组一样被软骨样组织填充,表面光滑,与周围软骨接合牢固,无裂痕存在,关节面塑形好,恢复到原来关节面轮廓,周围软骨无缺损。但实验组新生软骨为乳白色,而自体对照组为半透明,与周围关节软骨颜色更接近。空白对照组缺损区不修复,即使有新生组织填充,其颜色灰暗,表面高低不平,关节面塑形差,周围软骨出现磨损,关节粘连增加。新鲜对照组缺损区部份软骨下骨质裸露,部份被淡红色肉芽组织填充,与周围软骨及缺损基底部结合不牢,易于剥离,关节软骨有磨损,粘连增多(图1)。经统计学分析实验组与自体对照组无显著差异(P>0.05),实验组与空白对照组及新鲜对照组有显著差异(P<0.05),见表1。
2.2 组织学观察
实验组及自体对照组新生组织表面平滑完整,与周边正常软骨及缺损基底部连接完全。两者新生组织都为软骨组织,PAS染色光镜下基质均红染,软骨细胞形态典型,位于软骨陷窝内。空白对照组新生物由纤维组织和幼稚软骨组成。新鲜对照组部份由纤维肉芽组织充填,未见软骨细胞(图2)。统计学比较实验组与自体对照组各指标均无显著差异(P>0.05),而与空白对照组及新鲜对照组主要指标均有显著差异(表2)。
, 百拇医药
2.3 氨基酸分析
实验组新生组织,自体对照组新生组织,透明软骨及纤维软骨的羟赖氨酸与羟脯氨酸比值统计学比较见表3。结果显示,实验组与纤维软骨无显著差异(P>0.05),与自体对照组有显著差异(P<0.01)。自体对照组比值介于透明软骨与纤维软骨两者之间,并与两者均有显著差异(P<0.01)。
图1 16周关节及新生物大体外观
a、b分别为自体对照组及实验组,缺损被透明样软骨修复,但前者半透明,接近周围软骨颜色,后者为乳白色 c、d分别为空白对照组及新鲜对照组,前者缺损未修复,后者缺损被肉芽组织充填
表1 16周各组大体观察结果(n=15)
实验组
, 百拇医药
自体对照组
空白对照组
新鲜对照组
关节粘连
有
4
3
8
12**
无
11
12
7
, 百拇医药
3**
新生组织
光滑
11
12
3**
0**
粗糙
4
3
12**
15**
, 百拇医药
修复缺损
完全
11
13
3**
0**
部份
4
2
6
6*
关节塑形
不修复
, 百拇医药
0
0
6
9**
完全
9
12
1**
0**
部份
3
3
2
, 百拇医药
0
无
3
0
12**
15**
关节磨损
无
9
9
3
3*
有
, http://www.100md.com
6
6
12
12*
注:四格表确切概率法,与实验组比较 *P值<0.05,**P值<0.01
表2 16周各组镜下观察结果(n=15)
实验组
自体对照组
空白对照组
新鲜对照组
优势组织性质
透明样软骨
, 百拇医药
8
9
1*
0**
幼稚软骨
4
3
3
0
纤维组织或骨
3
3
11**
, http://www.100md.com
15**
表面特性
平滑完整
6
9
3
0*
小裂隙
3
3
1
0
严重破坏
, 百拇医药
6
3
11
15**
结构完整性
正常
8
9
0**
0**
轻度异形性
3
4
, 百拇医药
6
3
严重异形性
4
2
9
12**
与正常软骨连接
完全连接
3
6
0
0
, 百拇医药
部份连接
9
6
6
0**
无连接
3
3
9
15**
新生组织水平
平
9
, 百拇医药
12
2*
0**
低
6
3
13*
15**
注:四格表确切概率法,与实验组比较 *P值<0.05,**P值<0.01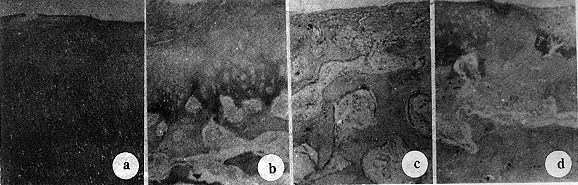
图2 缺损修复的组织学特点(×200)
, 百拇医药
a、b分别为自体对照组和实验组,缺损被透明样软骨组织修复,PAS染色下基质红染,软骨陷窝内软骨细胞形态典型 c、d分别为空白对照组及新鲜对照组,前者缺损未修复,后者为肉芽组织
3 讨论
我们实验中采用的胎兔颅骨膜冷冻保存条件借鉴于冷冻保存游离软骨细胞的经验。虽然组织一般较细胞更难在低温下保存,但鉴于骨膜生发层具有分化能力的原始间质细胞可能与其分化来的软骨细胞具有某些共同特性。当冷冻完整的软骨时,由于软骨基质的阻挡作用使软骨不能形成均匀一致的冷冻,冷冻后软骨细胞成活力低[6]。而胎兔颅骨膜只有几层(图3),且DMSO的细胞内渗透性强[7],因此均匀一致的冷冻是可以获得的。我们将冷冻后的胎兔颅骨膜行透射电镜观察,发现其生发层细胞超微结构未见明显破坏性改变[8]。冷冻复温处理的胎兔颅骨膜移植到关节内能生成透明样软骨,也说明其具有活性。Kreder等[9]应用同位素扫描及放射性自显影测量。冷冻后骨膜细胞在培养过程中摄取放射性硫35及氚标记胸苷能力。结果显示细胞活性良好。他们所采用实验条件与我们冷冻保存胎兔颅骨膜条件非常相似。由此可见,本实验借鉴的冷冻方法保存胎兔颅骨膜是切实可行的,冷冻后的骨膜具有活性。
, http://www.100md.com
表3 羟赖氨酸与羟脯氨酸比值(n=10, ±s) 组 别
±s) 组 别
羟赖氨酸/羟脯氨酸
透明软骨
0.4847±0.0152
纤维软骨
0.2880±0.0123
自体对照组新生物
0.3733±0.0090
实验组新生物
0.2779±0.0089
, 百拇医药
F值
676.45
P值
<0.01
Ms组内
0.0001
图3 胚胎兔颅骨膜(HE×50)
是由生发层及纤维层组成,而生发层细胞只有几层
骨膜具有成骨和成软骨能力。胚胎发育中骨膜从软骨膜衍化而来,两者生发层都含有未分化间叶细胞。本实验在16周内全面观察不同移植物在关节内演变与转归。结果证明,冷冻胎兔颅骨膜与自体骨膜一样能再生成熟并具有活力的透明样软骨。两种再生的软骨在形态学上无显著统计学差异,但用未经冷冻胎兔颅骨膜修复关节软骨缺损,修复效果则差。我们对实验组及自体对照组关节面缺损区新生的软骨中粘多糖用PAS染色定性反应,对其中胶原类型用羟赖氨酸和羟脯氨酸比值来反应,有实验证明两者的比值能推断再生软骨胶原类型[10]。氨基酸分析结果证明,实验组再生关节软骨与纤维软骨无差异(P>0.05),主要含Ⅰ型胶原,自体骨膜再生软骨介于透明软骨与纤维软骨之间,含Ⅰ、Ⅱ型胶原,与冷冻胎兔颅骨膜移植物再生软骨有明显区别(P<0.01),这与韩一生等[10]自体骨膜移植实验结果相一致。
, 百拇医药
骨膜和软骨膜再生软骨是一组织化生的动态过程,在此衍变过程中,不仅有软骨细胞衍化,还有中性粘多糖和胶原蛋白逐渐具有透明软骨基质特征的改变,而且需要一定的环境和时间。我们实验移植冷冻的胎兔颅骨膜修复关节软骨缺损,16周后形成纤维软骨,但随着时间延长能否进一步衍化成透明软骨,有待进一步研究。
冷冻胎兔颅骨膜移植属于同种异体移植,移植16周后能生成纤维软骨且新生组织中及其周围未见明显免疫细胞浸润现象,即未见明显免疫排斥反应,这可能与以下因素有关:①实验中所用移植物为胎龄26天~28天胚胎兔颅骨膜,其抗原分化尚不成熟。②移植到关节缺损处的冷冻颅骨膜生发层朝向关节腔,直接处于关节滑液营养环境中,能很快增生分化为成熟的软骨细胞并分泌基质将其包埋,阻挡宿主免疫细胞与移植物细胞接触以及抗体进入移植物内,起到类似软骨组织移植的抗排斥作用[11]。③受区的关节滑液中具有免疫反应功能的细胞相对较少[11]。因此,即使有异体组织相容性抗原存在时,也不能将其及时识别,并递呈相应免疫细胞,引起细胞或体液免疫反应。④经冷冻法保存的胚胎颅骨膜可能降低抗原性,正如冷冻能降低软骨的抗原性[12]。
, 百拇医药
以往对关节软骨软损的修复只限于自体骨膜及软骨膜移植。我们的实验首次应用冷冻保存的同种异体胎兔颅骨膜修复关节软骨缺损,通过16周的动态观察,生成纤维软骨修复缺损区。其优越性在于移植体来源广泛。减少患者痛苦,缩短手术时间,以及避免自体骨膜移植给供区带来各种并发症等,因而在修复关节面软骨缺损中具有一定意义,为临床修复关节软骨缺损提供新的途径。
4 参考文献
1 Engkvist O, Johansson SH. Perichondrial arthroplasty, a clinical study in twenty-six patients. J Plast Reconstr Surg, 1980;1(1):71
2 Korkala O, Kuokkanen H. Autogenous osteoperiosteal grafts in the reconstruction of full-thickness joint surface defects. Int Orthop, 1991;15(3):233
, http://www.100md.com
3 Tomford WW, Fredericks GR, Mankin HJ. Studies on cryopreservation of articular cartilage chondrocytes. J Bone Joint Surg(Am), 1984;66(3):253
4 Shawn W, ODriscoll, Keeley FW et al. The chondrogenic potential of free autogenous periosteal grafts for biological resurfacing of major full-thickness defects in joint surfaces under the influence of continuous passive motion. J Bone Joint Surg(Am), 1986;68(7):1017
5 Johnson RG, Stollery J, Keeley FW et al. Biochemical analysis of rabbit articular cartilage using an amino acid analyzer. Clin Orthop, 1980;146(3):282
, 百拇医药
6 Schachar NS, McGann LE. Investigation of low-temperature storage of articular cartilage for transplantation. Clin Orthop, 1986;208(2):146
7 Tomford WW, Duff GP, Maskin HJ. Experimental freeze preservation of chondrocytes. Clin Orthop, 1985;197(1):11
8 蔡善保,潘功平,周新社等.冷冻保存胎兔颅骨骨膜超微结构观察.蚌埠医学院学报,1997;22(2):81
9 Kreder HJ, Keeley FW, Salter R. Cryopreservation of periosteum for transplantation. Cryobiology, 1993;30(2):107
, http://www.100md.com
10 韩一生,陆裕朴,胡蕴玉.自体骨膜和软骨膜游离移植修复关节面软骨缺损的实验比较.中华骨科杂志,1991;11(1):25
11 Langer F, Gross AE. Immunogenicity of allograft articular cartilage. J Bone Joint Surg(Am), 1974;56(3):297
12 Czitrom AA, Fred L, Nancy M et al. Bone and cartilage allotransplantation. Clin Orthop, 1986;208(2):141
(收稿:1996-09-25修回:1997-05-04), 百拇医药
单位:1 蚌埠医学院附属医院骨科(安徽蚌埠,233004);2 ICU病房
关键词:低温保存;颅骨骨膜;胎兔;同种异体移植
中国修复重建外科杂志980215 摘 要 为探讨关节软骨缺损的修复方法,采用家兔30只,平均分成两组。在每个动物的双侧髌股关节股骨关节面作4 mm×7 mm全层软骨缺损。将经二步冷冻法保存的胎兔颅骨骨膜移植于一组动物一侧后肢作为实验组,另一侧用自体骨膜移植作为自体对照组。在另一组动物的一侧后肢用新鲜胎兔颅骨骨膜移植作为新鲜对照组,另一侧关节软骨缺损不修复作为空白对照组。术后肢体不作外固定。16周后取材,经大体观察、组织学观察及氨基酸成分分析。结果发现,经冷冻保存的胎兔颅骨骨膜移植后能形成透明样软骨,与自体对照组无显著性差异(P>0.05),与新鲜对照组及空白对照组主要指标有显著性差异(P<0.05)。氨基酸分析示实验组新生物接近纤维软骨(P>0.05)。认为,冷冻胎兔颅骨骨膜移植为关节软骨缺损的修复提供了实验依据。
, 百拇医药
REPAIR OF CARTILAGE DEFECT IN JOINT WITH TRANSPLANTATION OF CRYOPRESERVED HOMOLOGOUS EMBRYONIC PERIOSFEUM OF RABBITS/Cai Shanbao, Hu Rugi, Wang Haiyan, et al. Affiliated Hospital of Bangbu Medical College, Bangbu, Anhui, P. R. China 233004
Abstract In order to repair cartilage defect in joint with transplantation of cryopreserved homologous embryonic periosteum, 30 rabbits were used and divided into two groups. A 4 mm×7 mm whole thickness cartilage defect was made in the patellar groove of femur of each rabbit. The homologous embryonic rabbit skull periosteum (ERSP), preserved in two-step freezing schedule, was transplanted onto the cartilage defect of joints of one group and autogenous periosteal graft was done in the joint defect of the other group. The knees were not immobilized, following operation and 16 weeks later, the newly formed tissue in the defects were assessed by gross observation, histochemical examination and biochemical analysis. The results showed that new hyaline-like cartilage was formed in the cryopreserved ERSP grafted knee, and had no significant difference from that of the knee receiving autogenous periosteal graft, but had significant difference from that of the fresh ERSP grafted knee and the non-grafted knee. Furthermore, the new hyaline-like cartilage had the biochemical characteristics of a fibrous cartilage. The conclusion was that this method might be feasible to repair articular cartilage defects.
, 百拇医药
Key words Cryopreservation Embryonic rabbit Skull periosteum Homotransplantation
关节软骨缺损的生物学修复是骨科临床中的难题。迄今虽在实验及临床研究上取得了一些进展,然而大多数研究都着重于自体骨膜、软骨膜移植,经常遇到供区有限和不适于自体移植等情况。基于自体骨膜及软骨膜移植修复关节软骨缺损已在实验与临床应用上取得了成功[1,2];二步冷冻已成功地保存游离软骨细胞[3];胚胎组织不仅抗原性弱而且有强的衍生能力。因此,我们设想用冷冻保存的胎兔颅骨骨膜同种异体移植修复关节软骨缺损,旨在明确其在关节环境中的演变与转归,为临床应用提供实验依据。
1 材料与方法
将孕龄26天~28天健康孕兔无菌下剖腹取出活胎兔30只,处死后5分钟内锐性切取胎兔颅骨骨膜。15只材料不经冷冻直接作移植用,另15只材料用4℃磷酸缓冲液冲洗,移植于盛有4℃含7.5% 二甲基亚砜Hanks液冻存管中,保存30分钟,然后移入深低温冰箱(Sanyo MDF 291 AT型)中,以-1℃/min速率降至-40℃并维持30分钟,再移入-196℃液氮中保存24小时。用时取出用37℃水浴快速复温,Hanks液冲洗3遍。取健康家兔30只,雌雄不拘,体重(2.5±0.25) kg。以每组15只分成两组,在双侧髌股关节的股骨关节面作4 mm×7 mm深达软骨下松质骨(以出血为度)全层软骨缺损。将经冷冻复温处理的胎兔颅骨骨膜及自体骨膜(取同侧胫骨内面)移植于第一组双后肢,左侧为冷冻胎兔颅骨膜(以下称实验组),右侧为自体骨膜(以下称自体对照组);将未经冷冻的新鲜胎兔颅骨膜移植于第二组动物左后肢(以下称为新鲜对照组),右后肢缺损空置(以下称空白对照组)。所有移植物均用6/0无损伤尼龙针线固定于缺损处,术后双膝关节不固定,16周后处死动物。参照Shawn法[4]分别作大体观察及组织学观察;参照Johnson法[5],将实验组与自体对照组新生物作氨基酸分析,并与正常透明软骨(股骨髁软骨)及纤维软骨(半月板)作比较。形态学观察各指标出现阳性率,用四格表确切概率法处理,氨基酸分析结果用方差分析及q检验处理。
, 百拇医药
2 结果
2.1 大体观察
实验组软骨缺损区与自体对照组一样被软骨样组织填充,表面光滑,与周围软骨接合牢固,无裂痕存在,关节面塑形好,恢复到原来关节面轮廓,周围软骨无缺损。但实验组新生软骨为乳白色,而自体对照组为半透明,与周围关节软骨颜色更接近。空白对照组缺损区不修复,即使有新生组织填充,其颜色灰暗,表面高低不平,关节面塑形差,周围软骨出现磨损,关节粘连增加。新鲜对照组缺损区部份软骨下骨质裸露,部份被淡红色肉芽组织填充,与周围软骨及缺损基底部结合不牢,易于剥离,关节软骨有磨损,粘连增多(图1)。经统计学分析实验组与自体对照组无显著差异(P>0.05),实验组与空白对照组及新鲜对照组有显著差异(P<0.05),见表1。
2.2 组织学观察
实验组及自体对照组新生组织表面平滑完整,与周边正常软骨及缺损基底部连接完全。两者新生组织都为软骨组织,PAS染色光镜下基质均红染,软骨细胞形态典型,位于软骨陷窝内。空白对照组新生物由纤维组织和幼稚软骨组成。新鲜对照组部份由纤维肉芽组织充填,未见软骨细胞(图2)。统计学比较实验组与自体对照组各指标均无显著差异(P>0.05),而与空白对照组及新鲜对照组主要指标均有显著差异(表2)。
, 百拇医药
2.3 氨基酸分析
实验组新生组织,自体对照组新生组织,透明软骨及纤维软骨的羟赖氨酸与羟脯氨酸比值统计学比较见表3。结果显示,实验组与纤维软骨无显著差异(P>0.05),与自体对照组有显著差异(P<0.01)。自体对照组比值介于透明软骨与纤维软骨两者之间,并与两者均有显著差异(P<0.01)。

图1 16周关节及新生物大体外观
a、b分别为自体对照组及实验组,缺损被透明样软骨修复,但前者半透明,接近周围软骨颜色,后者为乳白色 c、d分别为空白对照组及新鲜对照组,前者缺损未修复,后者缺损被肉芽组织充填
表1 16周各组大体观察结果(n=15)
实验组
, 百拇医药
自体对照组
空白对照组
新鲜对照组
关节粘连
有
4
3
8
12**
无
11
12
7
, 百拇医药
3**
新生组织
光滑
11
12
3**
0**
粗糙
4
3
12**
15**
, 百拇医药
修复缺损
完全
11
13
3**
0**
部份
4
2
6
6*
关节塑形
不修复
, 百拇医药
0
0
6
9**
完全
9
12
1**
0**
部份
3
3
2
, 百拇医药
0
无
3
0
12**
15**
关节磨损
无
9
9
3
3*
有
, http://www.100md.com
6
6
12
12*
注:四格表确切概率法,与实验组比较 *P值<0.05,**P值<0.01
表2 16周各组镜下观察结果(n=15)
实验组
自体对照组
空白对照组
新鲜对照组
优势组织性质
透明样软骨
, 百拇医药
8
9
1*
0**
幼稚软骨
4
3
3
0
纤维组织或骨
3
3
11**
, http://www.100md.com
15**
表面特性
平滑完整
6
9
3
0*
小裂隙
3
3
1
0
严重破坏
, 百拇医药
6
3
11
15**
结构完整性
正常
8
9
0**
0**
轻度异形性
3
4
, 百拇医药
6
3
严重异形性
4
2
9
12**
与正常软骨连接
完全连接
3
6
0
0
, 百拇医药
部份连接
9
6
6
0**
无连接
3
3
9
15**
新生组织水平
平
9
, 百拇医药
12
2*
0**
低
6
3
13*
15**
注:四格表确切概率法,与实验组比较 *P值<0.05,**P值<0.01

图2 缺损修复的组织学特点(×200)
, 百拇医药
a、b分别为自体对照组和实验组,缺损被透明样软骨组织修复,PAS染色下基质红染,软骨陷窝内软骨细胞形态典型 c、d分别为空白对照组及新鲜对照组,前者缺损未修复,后者为肉芽组织
3 讨论
我们实验中采用的胎兔颅骨膜冷冻保存条件借鉴于冷冻保存游离软骨细胞的经验。虽然组织一般较细胞更难在低温下保存,但鉴于骨膜生发层具有分化能力的原始间质细胞可能与其分化来的软骨细胞具有某些共同特性。当冷冻完整的软骨时,由于软骨基质的阻挡作用使软骨不能形成均匀一致的冷冻,冷冻后软骨细胞成活力低[6]。而胎兔颅骨膜只有几层(图3),且DMSO的细胞内渗透性强[7],因此均匀一致的冷冻是可以获得的。我们将冷冻后的胎兔颅骨膜行透射电镜观察,发现其生发层细胞超微结构未见明显破坏性改变[8]。冷冻复温处理的胎兔颅骨膜移植到关节内能生成透明样软骨,也说明其具有活性。Kreder等[9]应用同位素扫描及放射性自显影测量。冷冻后骨膜细胞在培养过程中摄取放射性硫35及氚标记胸苷能力。结果显示细胞活性良好。他们所采用实验条件与我们冷冻保存胎兔颅骨膜条件非常相似。由此可见,本实验借鉴的冷冻方法保存胎兔颅骨膜是切实可行的,冷冻后的骨膜具有活性。
, http://www.100md.com
表3 羟赖氨酸与羟脯氨酸比值(n=10,
 ±s) 组 别
±s) 组 别羟赖氨酸/羟脯氨酸
透明软骨
0.4847±0.0152
纤维软骨
0.2880±0.0123
自体对照组新生物
0.3733±0.0090
实验组新生物
0.2779±0.0089
, 百拇医药
F值
676.45
P值
<0.01
Ms组内
0.0001

图3 胚胎兔颅骨膜(HE×50)
是由生发层及纤维层组成,而生发层细胞只有几层
骨膜具有成骨和成软骨能力。胚胎发育中骨膜从软骨膜衍化而来,两者生发层都含有未分化间叶细胞。本实验在16周内全面观察不同移植物在关节内演变与转归。结果证明,冷冻胎兔颅骨膜与自体骨膜一样能再生成熟并具有活力的透明样软骨。两种再生的软骨在形态学上无显著统计学差异,但用未经冷冻胎兔颅骨膜修复关节软骨缺损,修复效果则差。我们对实验组及自体对照组关节面缺损区新生的软骨中粘多糖用PAS染色定性反应,对其中胶原类型用羟赖氨酸和羟脯氨酸比值来反应,有实验证明两者的比值能推断再生软骨胶原类型[10]。氨基酸分析结果证明,实验组再生关节软骨与纤维软骨无差异(P>0.05),主要含Ⅰ型胶原,自体骨膜再生软骨介于透明软骨与纤维软骨之间,含Ⅰ、Ⅱ型胶原,与冷冻胎兔颅骨膜移植物再生软骨有明显区别(P<0.01),这与韩一生等[10]自体骨膜移植实验结果相一致。
, 百拇医药
骨膜和软骨膜再生软骨是一组织化生的动态过程,在此衍变过程中,不仅有软骨细胞衍化,还有中性粘多糖和胶原蛋白逐渐具有透明软骨基质特征的改变,而且需要一定的环境和时间。我们实验移植冷冻的胎兔颅骨膜修复关节软骨缺损,16周后形成纤维软骨,但随着时间延长能否进一步衍化成透明软骨,有待进一步研究。
冷冻胎兔颅骨膜移植属于同种异体移植,移植16周后能生成纤维软骨且新生组织中及其周围未见明显免疫细胞浸润现象,即未见明显免疫排斥反应,这可能与以下因素有关:①实验中所用移植物为胎龄26天~28天胚胎兔颅骨膜,其抗原分化尚不成熟。②移植到关节缺损处的冷冻颅骨膜生发层朝向关节腔,直接处于关节滑液营养环境中,能很快增生分化为成熟的软骨细胞并分泌基质将其包埋,阻挡宿主免疫细胞与移植物细胞接触以及抗体进入移植物内,起到类似软骨组织移植的抗排斥作用[11]。③受区的关节滑液中具有免疫反应功能的细胞相对较少[11]。因此,即使有异体组织相容性抗原存在时,也不能将其及时识别,并递呈相应免疫细胞,引起细胞或体液免疫反应。④经冷冻法保存的胚胎颅骨膜可能降低抗原性,正如冷冻能降低软骨的抗原性[12]。
, 百拇医药
以往对关节软骨软损的修复只限于自体骨膜及软骨膜移植。我们的实验首次应用冷冻保存的同种异体胎兔颅骨膜修复关节软骨缺损,通过16周的动态观察,生成纤维软骨修复缺损区。其优越性在于移植体来源广泛。减少患者痛苦,缩短手术时间,以及避免自体骨膜移植给供区带来各种并发症等,因而在修复关节面软骨缺损中具有一定意义,为临床修复关节软骨缺损提供新的途径。
4 参考文献
1 Engkvist O, Johansson SH. Perichondrial arthroplasty, a clinical study in twenty-six patients. J Plast Reconstr Surg, 1980;1(1):71
2 Korkala O, Kuokkanen H. Autogenous osteoperiosteal grafts in the reconstruction of full-thickness joint surface defects. Int Orthop, 1991;15(3):233
, http://www.100md.com
3 Tomford WW, Fredericks GR, Mankin HJ. Studies on cryopreservation of articular cartilage chondrocytes. J Bone Joint Surg(Am), 1984;66(3):253
4 Shawn W, ODriscoll, Keeley FW et al. The chondrogenic potential of free autogenous periosteal grafts for biological resurfacing of major full-thickness defects in joint surfaces under the influence of continuous passive motion. J Bone Joint Surg(Am), 1986;68(7):1017
5 Johnson RG, Stollery J, Keeley FW et al. Biochemical analysis of rabbit articular cartilage using an amino acid analyzer. Clin Orthop, 1980;146(3):282
, 百拇医药
6 Schachar NS, McGann LE. Investigation of low-temperature storage of articular cartilage for transplantation. Clin Orthop, 1986;208(2):146
7 Tomford WW, Duff GP, Maskin HJ. Experimental freeze preservation of chondrocytes. Clin Orthop, 1985;197(1):11
8 蔡善保,潘功平,周新社等.冷冻保存胎兔颅骨骨膜超微结构观察.蚌埠医学院学报,1997;22(2):81
9 Kreder HJ, Keeley FW, Salter R. Cryopreservation of periosteum for transplantation. Cryobiology, 1993;30(2):107
, http://www.100md.com
10 韩一生,陆裕朴,胡蕴玉.自体骨膜和软骨膜游离移植修复关节面软骨缺损的实验比较.中华骨科杂志,1991;11(1):25
11 Langer F, Gross AE. Immunogenicity of allograft articular cartilage. J Bone Joint Surg(Am), 1974;56(3):297
12 Czitrom AA, Fred L, Nancy M et al. Bone and cartilage allotransplantation. Clin Orthop, 1986;208(2):141
(收稿:1996-09-25修回:1997-05-04), 百拇医药