坐骨神经卡压对腰脊髓神经元的影响△
作者:董 震1 成效敏1 顾玉东1 尹宗生2
单位:1 上海医科大学附属华山医院手外科(上海,200040);2 安徽医科大学附属第一医院骨科
关键词:神经卡压;神经元;超微结构
中国修复重建外科杂志980214 摘 要 为了解神经卡压对神经元的影响,以SD大鼠为研究对象,采用经典坐骨神经慢性卡压模型,研究坐骨神经卡压后,相应节段脊髓前角α运动神经元及神经节细胞数目及超微结构的变化。结果表明,坐骨神经卡压后,脊髓前角α运动神经元及神经节细胞可发生超微结构的改变,甚至死亡,并随卡压时间的延长,卡压程度的加重而加剧。认为,对于神经卡压,应尽可能早的解除卡压,以减少或消除神经元结构的改变和死亡,提高疗效。
EFFECT OF CRUSHING OF SCIATIC NERVE ON NEURON OF LUMBAR SPINAL CORD/Dong Zhen, Cheng Xiaomin, Gu Yudong, et al. Department of Hand Surgery, Huashan Hospital, Shanghai Medical University, Shanghai P. R. China 200040
, http://www.100md.com
Abstract In order to investigate the effect of nerve compression on neurons, the commonly used model of chronic nerve compression was produced in forth-eight SD rats. The rats were sacrificed in 1, 2, 3, 4, 5 and 6 months after compression, respectively. The number of neuron and ultrashruchure of α-motor neurons and ganglion cells of the corresponding spinal segment were examined. The results showed as following: After the sciatic nerve were crushed, the number of neuron and ultrastructure of α-motor neurons and ganglion cells might undergo ultrastructural changes, and even the death might occur. These changes might be aggravated as the time of crushing was prolonged and the compression force was increased. It was concluded that for nerve compression, decompression should be done as early as possible in order to avoid or minimize the ultructural changes of the neuron.
, http://www.100md.com
Key words Nerve compression Neuron Ultrastructure
采用经典的大鼠坐骨神经慢性卡压模型[1,2],研究坐骨神经卡压后,腰脊髓前角α运动神经元和神经节细胞数量和超微结构的变化。
1 材料与方法
1.1 实验动物
选用成年健康SD大鼠,雄性。体重200 g~250 g,共48只。
1.2 实验分组
1.2.1 光镜组 取SD大鼠36只,按术后取材时间不同,随机分成1,2,3,4,5和6个月时间组,每组6只。
1.2.2 电镜组 取SD大鼠6只,按术后取材时间不同,随机分成1,2,3,4,5和6个月时间组,每组1只。
, http://www.100md.com
1.3 实验模型
用1%戊巴比妥纳按0.4 ml/100 g腹腔麻醉,以右侧为实验侧,左侧为对照侧。在实验侧,显露大腿后侧坐骨神经,用长10 mm,内径1.5 mm的硅胶管包裹坐骨神经,造成一慢性卡压模型。硅胶管在使用前先纵形剖开,待包裹神经后,再用8/0的无损伤缝线缝合管壁3针。对照侧不作任何处理。
1.4 取材方法
1.4.1 光镜组 于术后不同时间再次麻醉。切开左侧股静脉置管,先用肝素生理盐水(浓度为25 U/100 ml)200 ml滴注,切开颈外静脉放血,至流出液体为无色时改用10%甲醛溶液150 ml滴注, 总滴注时间为40分钟~50分钟[3]。后入路暴露腰段脊髓,取L4~L6脊髓及L5神经节,置于10%甲醛液中固定,然后行连续切片(脊髓标本用横切面,神经节标本用纵形切面)。脊髓标本每隔20张留取一张切片,神经节标本每隔5张留取一张切片。每个标本各留取5张切片,行HE染色。
, http://www.100md.com
1.4.2 电镜组 按上述方法取出L4~L6脊髓及L5神经节后,在手术显微镜下取出脊髓灰质前角组织5块,体积小于1 mm3,连同神经节迅速置入2.5%戊二醛溶液中固定。固定后用LKB超薄切片机制片,铅染色,用透析电镜观察。
1.5 检测项目
1.5.1 光镜 用光学显微镜进行切片观察。目镜安装测微器,计数每个脊髓标本上5张切片左右侧脊髓前角α运动神经元数目及每个神经节标本上5张切片左右侧神经节细胞数目。计算右侧与左侧细胞数目之比(R/L)的均数及标准误。
1.5.2 电镜 电镜下找出α细胞及神经节细胞,每个细胞摄照片一张,每个标本摄照片5张。观察细胞超微结构的变化。
1.6 统计学处理
, 百拇医药
结果采用配对t检验处理。
2 结果
2.1 光镜
2.1.1 脊髓前角α运动神经元数目变化 术后1个月~6个月各组实验侧与对照侧脊髓前角α运动神经元数目之比的均数及标准误见表1。
由表1可知,L4~L6脊髓前角α运动神经元数目在术后1个月,2个月组无明显改变,在3个月~6个月分别减少8.4%,17.2%,20.4%和23.0%。
2.1.2 L5感觉神经节细胞数目变化 术后1个月~6个月各组实验侧与对照侧L5感觉神经节细胞数目之比的均数及标准误见表2。
由表2可知,坐骨神经卡压后1个月~3个月,神经节细胞数量无明显改变,4个月~6个月神经节细胞分别减少5.2%,8.1%和12.4%。
, http://www.100md.com
2.2 电镜
2.2.1 脊髓前角α运动神经元超微结构的变化 术后1个月可见溶酶体减少;2个月~4个月可见线粒体肿大,内质网扩张,程度逐月加重;5个月~6个月可见细胞核空化,细胞器数量明显减少,提示细胞功能退化(图1~4)。
2.2.2 L5感觉神经节细胞超微结构的变化 术后1个月可见溶酶体减少;2个月~3个月可见线粒体轻度肿胀,出现紫褐素;4个月~6个月可见细胞核空化,细胞器数量减少,程度逐月加重,提示细胞功能退化(图5~8)。
图1 正常SD鼠脊髓前角细胞,细胞核、核质均匀,胞质见溶酶体、线粒体和尼氏体(×7 500)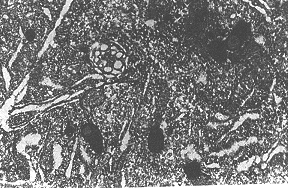
, http://www.100md.com
图2 卡压后2个月,脊髓前角细胞中线粒体肿大,内质网扩张(×7 500)
图3 卡压后4个月,脊髓前角细胞中线粒体肿胀,内质网扩张(×7 500)
图4 卡压后6个月,脊髓前角细胞核空化,线粒体明显肿大,细胞器数量减少(×10K)
表1 腰脊髓前角α运动神经元数目变化(自由度30~1)
1个月
2个月
3个月
4个月
, 百拇医药
5个月
6个月
均数(R/L)
0.992
0.976
0.916
0.828
0.796
0.770
标准误
0.220
0.021
0.259
, 百拇医药
0.015
0.010
0.011
t值
0.726
1.516
3.469*
10.924*
21.066*
17.939*
t0.05(29)=2.042 *表示差别有统计意义
, 百拇医药
表2 L5感觉神经节细胞数量变化(自由度6~1)
1个月
2个月
3个月
4个月
5个月
6个月
均数(R/L)
1.021
1.001
0.981
0.948
, http://www.100md.com
0.919
0.876
标准误
0.024
0.004
0.040
0.009
0.010
0.014
t值
-0.296
-0.134
0.664
, http://www.100md.com
5.304*
5.455*
7.068*
t0.05(5)=2.571 *表示差别有统计意义
图5 正常SD鼠脊髓神经节细胞,细胞核、核质均匀,核仁清楚,胞质见溶酶体、线粒体、核糖体和尼氏体(×5 000)
图6 卡压后2个月,神经节细胞中线粒体轻度肿胀,出现紫褐素(×7 500)
, 百拇医药
图7 卡压后4个月,神经节细胞核空化,细胞器数量减少(×7 500)
图8 卡压后6个月,神经节细胞核空化,细胞器数量减少,出现较多的紫褐素(×7 500)
3 讨论
3.1 神经卡压对神经元的影响
神经纤维内有顺向和逆向二种轴浆流,神经卡压不仅可阻碍顺向轴浆流的顺利通过,还可阻碍逆向轴浆流的通过。逆向轴浆流对神经元有营养作用,神经元必须不断地通过逆向轴浆流从靶器官摄取营养物质供自身代谢的需要,才能维持存活[3~5]。在神经卡压早期,虽然逆向轴浆流受阻,但程度较轻,仍可满足神经元的需求,故神经元并不发生死亡,但在超微结构上可发生一些异常,如溶酶体减少,线粒体肿胀等。随着卡压时间的延长,卡压程度亦加剧,逆向轴浆流受阻不断加重,导致靶器官对神经元的营养作用不断减弱,最终将不能满足神经元代谢的需要,造成神经元死亡逐渐增多。超微结构上亦可见细胞核空化,细胞器数量明显减少等提示细胞功能退化的现象。同时,我们的实验还发现,脊髓前角α运动神经元的减少比感觉神经节细胞的减少出现得早,而且程度亦较严重,这从一定角度解释了我们临床上经常观察到的神经卡压患者感觉恢复较运动恢复满意这一现象。
, 百拇医药
3.2 临床意义
通过实验,我们可观察到神经卡压可造成神经元的超微结构变化,甚至死亡,并随卡压时间的延长、卡压程度的加重而加剧,而神经元又无增殖能力。所以,对于临床上的神经卡压患者,应尽可能早地解除卡压,减少或消除神经元结构的改变和死亡,提高疗效。
4 参考文献
1 Mackinnon SE, Dellon AL, Hudson AR et al. A primate model for chronic nerve compression. J Reconstr Microsurg, 1985;1(3):185
2 O'Brien JP, Mackinnon SE, Maclean AR et al. A model of chronic nerve compression in the rat. Ann Plast Surg, 1987;19(5):430
, http://www.100md.com
3 尹宗生,顾玉东.臂丛根性损伤后脊髓前角α运动神经元数目变化的实验研究.中华显微外科杂志,1993;16(1):41
4 Jan Ygge. Neuronal loss in lumbar dorsal root ganglia after proximal compared to distal sciatic nerve resection: A quantitative study in the rat. Brain Research, 1989;478(1):193
5 Johnson EM, Rich KM, Yop HK. The role of NGF in sensory neurons in vivo. Trends Neurosci, 1986;9(1):33
△ 卫生部科研基金资助项目
(收稿:1997-07-19修回:1997-09-30), 百拇医药
单位:1 上海医科大学附属华山医院手外科(上海,200040);2 安徽医科大学附属第一医院骨科
关键词:神经卡压;神经元;超微结构
中国修复重建外科杂志980214 摘 要 为了解神经卡压对神经元的影响,以SD大鼠为研究对象,采用经典坐骨神经慢性卡压模型,研究坐骨神经卡压后,相应节段脊髓前角α运动神经元及神经节细胞数目及超微结构的变化。结果表明,坐骨神经卡压后,脊髓前角α运动神经元及神经节细胞可发生超微结构的改变,甚至死亡,并随卡压时间的延长,卡压程度的加重而加剧。认为,对于神经卡压,应尽可能早的解除卡压,以减少或消除神经元结构的改变和死亡,提高疗效。
EFFECT OF CRUSHING OF SCIATIC NERVE ON NEURON OF LUMBAR SPINAL CORD/Dong Zhen, Cheng Xiaomin, Gu Yudong, et al. Department of Hand Surgery, Huashan Hospital, Shanghai Medical University, Shanghai P. R. China 200040
, http://www.100md.com
Abstract In order to investigate the effect of nerve compression on neurons, the commonly used model of chronic nerve compression was produced in forth-eight SD rats. The rats were sacrificed in 1, 2, 3, 4, 5 and 6 months after compression, respectively. The number of neuron and ultrashruchure of α-motor neurons and ganglion cells of the corresponding spinal segment were examined. The results showed as following: After the sciatic nerve were crushed, the number of neuron and ultrastructure of α-motor neurons and ganglion cells might undergo ultrastructural changes, and even the death might occur. These changes might be aggravated as the time of crushing was prolonged and the compression force was increased. It was concluded that for nerve compression, decompression should be done as early as possible in order to avoid or minimize the ultructural changes of the neuron.
, http://www.100md.com
Key words Nerve compression Neuron Ultrastructure
采用经典的大鼠坐骨神经慢性卡压模型[1,2],研究坐骨神经卡压后,腰脊髓前角α运动神经元和神经节细胞数量和超微结构的变化。
1 材料与方法
1.1 实验动物
选用成年健康SD大鼠,雄性。体重200 g~250 g,共48只。
1.2 实验分组
1.2.1 光镜组 取SD大鼠36只,按术后取材时间不同,随机分成1,2,3,4,5和6个月时间组,每组6只。
1.2.2 电镜组 取SD大鼠6只,按术后取材时间不同,随机分成1,2,3,4,5和6个月时间组,每组1只。
, http://www.100md.com
1.3 实验模型
用1%戊巴比妥纳按0.4 ml/100 g腹腔麻醉,以右侧为实验侧,左侧为对照侧。在实验侧,显露大腿后侧坐骨神经,用长10 mm,内径1.5 mm的硅胶管包裹坐骨神经,造成一慢性卡压模型。硅胶管在使用前先纵形剖开,待包裹神经后,再用8/0的无损伤缝线缝合管壁3针。对照侧不作任何处理。
1.4 取材方法
1.4.1 光镜组 于术后不同时间再次麻醉。切开左侧股静脉置管,先用肝素生理盐水(浓度为25 U/100 ml)200 ml滴注,切开颈外静脉放血,至流出液体为无色时改用10%甲醛溶液150 ml滴注, 总滴注时间为40分钟~50分钟[3]。后入路暴露腰段脊髓,取L4~L6脊髓及L5神经节,置于10%甲醛液中固定,然后行连续切片(脊髓标本用横切面,神经节标本用纵形切面)。脊髓标本每隔20张留取一张切片,神经节标本每隔5张留取一张切片。每个标本各留取5张切片,行HE染色。
, http://www.100md.com
1.4.2 电镜组 按上述方法取出L4~L6脊髓及L5神经节后,在手术显微镜下取出脊髓灰质前角组织5块,体积小于1 mm3,连同神经节迅速置入2.5%戊二醛溶液中固定。固定后用LKB超薄切片机制片,铅染色,用透析电镜观察。
1.5 检测项目
1.5.1 光镜 用光学显微镜进行切片观察。目镜安装测微器,计数每个脊髓标本上5张切片左右侧脊髓前角α运动神经元数目及每个神经节标本上5张切片左右侧神经节细胞数目。计算右侧与左侧细胞数目之比(R/L)的均数及标准误。
1.5.2 电镜 电镜下找出α细胞及神经节细胞,每个细胞摄照片一张,每个标本摄照片5张。观察细胞超微结构的变化。
1.6 统计学处理
, 百拇医药
结果采用配对t检验处理。
2 结果
2.1 光镜
2.1.1 脊髓前角α运动神经元数目变化 术后1个月~6个月各组实验侧与对照侧脊髓前角α运动神经元数目之比的均数及标准误见表1。
由表1可知,L4~L6脊髓前角α运动神经元数目在术后1个月,2个月组无明显改变,在3个月~6个月分别减少8.4%,17.2%,20.4%和23.0%。
2.1.2 L5感觉神经节细胞数目变化 术后1个月~6个月各组实验侧与对照侧L5感觉神经节细胞数目之比的均数及标准误见表2。
由表2可知,坐骨神经卡压后1个月~3个月,神经节细胞数量无明显改变,4个月~6个月神经节细胞分别减少5.2%,8.1%和12.4%。
, http://www.100md.com
2.2 电镜
2.2.1 脊髓前角α运动神经元超微结构的变化 术后1个月可见溶酶体减少;2个月~4个月可见线粒体肿大,内质网扩张,程度逐月加重;5个月~6个月可见细胞核空化,细胞器数量明显减少,提示细胞功能退化(图1~4)。
2.2.2 L5感觉神经节细胞超微结构的变化 术后1个月可见溶酶体减少;2个月~3个月可见线粒体轻度肿胀,出现紫褐素;4个月~6个月可见细胞核空化,细胞器数量减少,程度逐月加重,提示细胞功能退化(图5~8)。

图1 正常SD鼠脊髓前角细胞,细胞核、核质均匀,胞质见溶酶体、线粒体和尼氏体(×7 500)

, http://www.100md.com
图2 卡压后2个月,脊髓前角细胞中线粒体肿大,内质网扩张(×7 500)

图3 卡压后4个月,脊髓前角细胞中线粒体肿胀,内质网扩张(×7 500)

图4 卡压后6个月,脊髓前角细胞核空化,线粒体明显肿大,细胞器数量减少(×10K)
表1 腰脊髓前角α运动神经元数目变化(自由度30~1)
1个月
2个月
3个月
4个月
, 百拇医药
5个月
6个月
均数(R/L)
0.992
0.976
0.916
0.828
0.796
0.770
标准误
0.220
0.021
0.259
, 百拇医药
0.015
0.010
0.011
t值
0.726
1.516
3.469*
10.924*
21.066*
17.939*
t0.05(29)=2.042 *表示差别有统计意义
, 百拇医药
表2 L5感觉神经节细胞数量变化(自由度6~1)
1个月
2个月
3个月
4个月
5个月
6个月
均数(R/L)
1.021
1.001
0.981
0.948
, http://www.100md.com
0.919
0.876
标准误
0.024
0.004
0.040
0.009
0.010
0.014
t值
-0.296
-0.134
0.664
, http://www.100md.com
5.304*
5.455*
7.068*
t0.05(5)=2.571 *表示差别有统计意义

图5 正常SD鼠脊髓神经节细胞,细胞核、核质均匀,核仁清楚,胞质见溶酶体、线粒体、核糖体和尼氏体(×5 000)

图6 卡压后2个月,神经节细胞中线粒体轻度肿胀,出现紫褐素(×7 500)

, 百拇医药
图7 卡压后4个月,神经节细胞核空化,细胞器数量减少(×7 500)

图8 卡压后6个月,神经节细胞核空化,细胞器数量减少,出现较多的紫褐素(×7 500)
3 讨论
3.1 神经卡压对神经元的影响
神经纤维内有顺向和逆向二种轴浆流,神经卡压不仅可阻碍顺向轴浆流的顺利通过,还可阻碍逆向轴浆流的通过。逆向轴浆流对神经元有营养作用,神经元必须不断地通过逆向轴浆流从靶器官摄取营养物质供自身代谢的需要,才能维持存活[3~5]。在神经卡压早期,虽然逆向轴浆流受阻,但程度较轻,仍可满足神经元的需求,故神经元并不发生死亡,但在超微结构上可发生一些异常,如溶酶体减少,线粒体肿胀等。随着卡压时间的延长,卡压程度亦加剧,逆向轴浆流受阻不断加重,导致靶器官对神经元的营养作用不断减弱,最终将不能满足神经元代谢的需要,造成神经元死亡逐渐增多。超微结构上亦可见细胞核空化,细胞器数量明显减少等提示细胞功能退化的现象。同时,我们的实验还发现,脊髓前角α运动神经元的减少比感觉神经节细胞的减少出现得早,而且程度亦较严重,这从一定角度解释了我们临床上经常观察到的神经卡压患者感觉恢复较运动恢复满意这一现象。
, 百拇医药
3.2 临床意义
通过实验,我们可观察到神经卡压可造成神经元的超微结构变化,甚至死亡,并随卡压时间的延长、卡压程度的加重而加剧,而神经元又无增殖能力。所以,对于临床上的神经卡压患者,应尽可能早地解除卡压,减少或消除神经元结构的改变和死亡,提高疗效。
4 参考文献
1 Mackinnon SE, Dellon AL, Hudson AR et al. A primate model for chronic nerve compression. J Reconstr Microsurg, 1985;1(3):185
2 O'Brien JP, Mackinnon SE, Maclean AR et al. A model of chronic nerve compression in the rat. Ann Plast Surg, 1987;19(5):430
, http://www.100md.com
3 尹宗生,顾玉东.臂丛根性损伤后脊髓前角α运动神经元数目变化的实验研究.中华显微外科杂志,1993;16(1):41
4 Jan Ygge. Neuronal loss in lumbar dorsal root ganglia after proximal compared to distal sciatic nerve resection: A quantitative study in the rat. Brain Research, 1989;478(1):193
5 Johnson EM, Rich KM, Yop HK. The role of NGF in sensory neurons in vivo. Trends Neurosci, 1986;9(1):33
△ 卫生部科研基金资助项目
(收稿:1997-07-19修回:1997-09-30), 百拇医药