我国不同栽培居群红花的组织构造及脂肪酸成分和含量比较
作者:郭美丽 张芝玉 张汉明 苏中武
单位:
关键词:红花;栽培居群;组织构造;脂肪酸
摘要 目的摘要 目的: 分析高钾离子(K+)引起PC12细胞内游离钙离子浓度([Ca2+]i)升高的可能机制。方法: 利用MiraCal Image System 检测[Ca2+]i,Ca2+荧光探针为Fura-2/AM。结果: (1)KCl浓度为30~100 mmol/L时,可剂量依赖性地诱导PC12细胞[Ca2+]i升高;(2)在细胞外无Ca2+时,高K+对PC12细胞[Ca2+]i无影响;(3)L-型电压门控钙通道阻滞剂维拉帕米、地尔硫和硝苯地平的浓度分别为5×10-5, 1×10-4和5×10-3 mol/L时,可完全阻断高K+诱导的PC12细胞[Ca2+]i升高,但N-型电压门控钙通道阻滞剂ω-conotoxin GVIA在浓度为1×10-6 mol/L 时,对高K+诱导的PC12细胞[Ca2+]i升高没有影响;(4) 5×10-5 mol/L维拉帕米对细胞外由无Ca2+到有Ca2+过程引起的[Ca2+]i升高无抑制作用。结论: 高K+引起PC12细胞[Ca2+]i升高以细胞质膜上L-型电压门控Ca2+通道开放为基础,与N-型电压门控Ca2+通道和Ca2+漏流关系不明显。
, 百拇医药
中国图书资料分类法分类号 R329.27
Mechanism of [Ca2+]i rise induced by high concentration of potassium ion in PC12 cells
Lou Shujie, Wang Chenguang, Huang Xiuying, Chen Yizhang (Department of Physiology, Department of Basic Medicine,Second Military Medical University, Shanghai, 200433)
Abstract Objective: To elucidate the mechanism of [Ca2+]i rise induced by high-K+ concentration in PC12 cells. Methods: [Ca2+]i was assayed with MiraCal Image System using Fura-2/AM as Ca2+ fluorescence probe. Results: (1) In PC12 cells KCl at 30~100 mmol/L could induce [Ca2+]i rise in concentration dependent manner. (2) In PC12 cells KCl at 55 mmol/L could not induce [Ca2+]i change in extracellular Ca2+-free condition. (3) It was found that verapamil, diltiazem and nifedipine at 5×10-5, 1×10-4and 5×10-3 mol/L, respectively, could inhibit completely [Ca2+]i rise induced by high-K+. But ω-conotoxin GVIA at 1×10-6mol/L showed no influence on [Ca2+]i rise induced by high-K+. (4) Verapamil at 5×10-5 mol/L was ineffective on [Ca2+]i rise induced by addition of CaCl2 to extracellular Ca2+-free condition. Conclusion: The increase of [Ca2+]i in response to KCl stimulation in PC12 cells was determined by the open of L-type voltage-gated calcium channels, N-type voltage-gated calcium channels and the leak influx of Ca2+ were not involved in [Ca2+]i rise induced by high-K+ in PC12 cells.
, 百拇医药
Key words PC12 cells; high concentration K+; intracellular free Ca2+ concentration
PC12细胞是Green等从大鼠肾上腺髓质瘤中获得的细胞株,其形态和功能类似于大鼠肾上腺髓质嗜铬细胞。高K+可引起PC12细胞细胞内游离钙离子浓度([Ca2+]i)升高。一般认为高K+诱导不同细胞[Ca2+]i升高的主要机制是引起细胞膜电位去极化,开放膜上电压门控钙通道所致。但也有文献报道[1]高K+引起牛嗜铬细胞[Ca2+]i升高既与外钙内流有关,也与内钙释放有关。在PC12细胞的情形又是怎样呢?本实验应用Ca2+通道阻滞剂,在有或无细胞外Ca2+条件下对此问题进行了初步研究。
, http://www.100md.com
1 材料和方法
1.1 仪器、药品和细胞 PC12细胞由日本名古屋大学医学院Kuba教授惠赠。维拉帕米(Verapamil)、地尔硫(Diltiazem)、 硝苯地平(Nifedipine)、ω-conotoxin GVIA和Pluronic F-127皆为 Sigma公司产品,Fura-2/Acetoxymethyl ester(AM)为Calbiochem公司产品,HEPES为Serve公司产品,配制Krebs-HEPES缓冲液的无机盐类为国产分析纯级。MiraCal Image System为英国Life Science Resource Ltd产品。激发波长分别为340,380nm,发射波长为510nm。Fura-2/AM、维拉帕米、地尔硫和硝苯地平使用前先用二甲亚砜(DMSO)或乙醇配制成10~100 mmol/L的储存液,使用时再配至所需浓度。
1.2 方法
1.2.1 利用Fura-2/AM检测[Ca2+]i的原理 Fura-2/AM是一种荧光指示剂,可选择性地与Ca2+结合。AM是一种酯,它与Fura-2偶联后,可因其脂溶性弥散入细胞,进而将Fura-2也带入细胞。Fura-2/AM进入细胞后,AM被细胞内的酯酶分解,因Fura-2是水溶性物质,所以留在细胞内。Fura-2与Ca2+结合后,激发波长发生改变,由未结合Ca2+时的380 nm移至340 nm。因此,分别测量340和380 nm波长时Fura-2-Ca2+和Fura-2的荧光强度,代入公式[2]:
, http://www.100md.com
[Ca2+]i=Kd×(R-Rmin)/(Rmax-R)Sf2/Sb2
式中Kd: Fura-2与Ca2+结合的解离常数,其值为224 nmol/L;R:在340和380 nm处的荧光强度比值;Rmin:[Ca2+]i极低时,在340和380 nm处的荧光强度比值;Rmax: [Ca2+]i极高、Fura-2被Ca2+饱和时,在340和380 nm处的荧光强度比值;Sb2:细胞内Fura-2被Ca2+饱和时,在380 nm处的荧光强度;Sf2:[Ca2+]i极低时,在380 nm处的荧光强度。根据公式便可计算出[Ca2+]i。
, http://www.100md.com
1.2.2 Fura-2/AM负载步骤 首先将培养器内的DMEM弃去,用Krebs-HEPES溶液冲洗3遍后,将细胞从壁上吹起、打匀、转入离心管内,根据细胞悬液的体积,加入Pluronic F-127(一种弱的去垢剂,可促进Fura-2/AM进入细胞)和Fura-2/AM,使其终浓度分别为0.04%和5 μmol/L,放37℃ CO2孵箱30 min,中间摇晃几次。取出后,再用Krebs-HEPES离心洗3次,转速500 r/min,以去除细胞表面和细胞外液中的Fura-2/AM。最后用DMEM悬浮,室温放置备用。
1.2.3 单细胞[Ca2+]i的测定与分析 首先将少许细胞悬液滴到铺有胶原的小圆玻片上, 37℃ 10 min。 令细胞贴壁, 吸去DMEM液体, 将玻片嵌在小室的底部, 固定好后, 向室内加入200 μl DMEM液体, 置小室于显微镜镜头下面。 找到一个细胞分散较均匀的视野, 用于单细胞[Ca2+]i的监测。 图像获取及定量分析由 Life Science Resource Ltd 提供的软件 Miracal Version 2.3完成。 在每一个实验结束后, 系统很快便能给出每一个被监测细胞的[Ca2+]i变化的动态反应曲线, 并计算出每一个细胞在某一时刻的[Ca2+]i数值。 细胞内钙浓度最大净升高值为最大钙浓度值(峰值)减去静息钙浓度值, 文中表示为Δ[Ca2+]i 。 每组实验细胞数用n表示。
, 百拇医药
1.2.4 统计学处理 实验数据以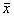 ±s表示,各组之间采用t检验判断显著性。
±s表示,各组之间采用t检验判断显著性。
2 结 果
2.1 不同浓度KCl对PC12细胞[Ca2+]i的影响 将KCl配成25 mol/L高浓度的贮存液,实验时,向反应池中加入一定量的高浓度KCl溶液,使其终浓度分别达到30, 40, 50, 60, 70, 80, 90和100 mmol/L。从图1可以看出,给予细胞高K+刺激后,[Ca2+]i迅速升高,然后又很快下降。KCl浓度为30~100 mmol/L时,其诱导PC12细胞[Ca2+]i升高作用呈现剂量依赖性(图2)。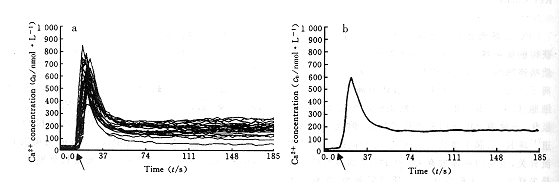
, 百拇医药
图 1 高K+浓度诱导单个PC12细胞[Ca2+]i的变化
Fig 1 Changes in [Ca2+]i in response to high-K+ concentration in single PC12 cell
The arrows indicated the time of addition of 60 mmol/L KCl. One frame represent 3.3s. (a): The 20 cells composite curve, one curve represented the change of [Ca2+]i in one PC12 cell; (b): The average of 20 cells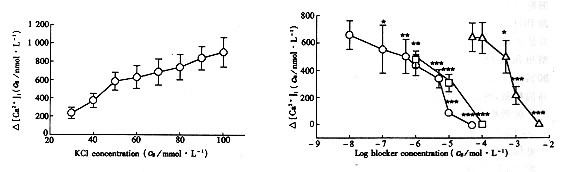
, http://www.100md.com
图 2 KCl诱导单个PC12 细胞[Ca2+]i升高的剂量-效应曲线
Fig 2 The curve of dose-response effect in increasing
[Ca2+]i induced by KCl in single PC12 cell
n=20~40
图 3 维拉帕米、地尔硫和硝苯地平抑制Δ[Ca2+]i的剂量-效应曲线
○) or diltiazem (□) or nifedipine (△) on Δ[Ca2+]i
, http://www.100md.com
The values of Δ[Ca2+]i are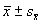 ; *P<0.05, **P<0.01,***P<0.001 vs control; n=20~40
; *P<0.05, **P<0.01,***P<0.001 vs control; n=20~40
2.2 PC12细胞外无Ca2+时KCl对[Ca2+]i的影响
细胞贴壁后用无钙Krebs-HEPES(内含0.1 mmol/L EGTA)洗两遍后,加入无钙Krebs-HEPES,马上用于实验。结果表明:在细胞外无Ca2+时,静息状态下的PC12细胞[Ca2+]i为(11±2)nmol/L(n=20)。当给予55 mmol/L KCl 刺激时,PC12细胞[Ca2+]i 仍为(11±2)nmol/L(n=20),可见在细胞外无Ca2+时,高K+本身不能诱导细胞内Ca2+释放。
, http://www.100md.com
2.3 L-型电压门控钙通道阻滞剂对高K+诱导PC12细胞[Ca2+]i的影响
2.3.1 DMSO和乙醇对高K+诱导PC12细胞[Ca2+]i升高的影响 用0.1% DMSO或0.1%乙醇预处理PC12细胞5 min时(37℃),给予55 mmol/L KCl刺激,结果DMSO组、乙醇组和对照组(单纯给予KCl刺激)的Δ[Ca2+]i分别为(640±129),(634±115)和(626±136)nmol/L(n均为20)。统计结果表明:无论是DMSO还是乙醇,对高K+引起的PC12细胞[Ca2+]i升高没有明显的促进或抑制作用(P>0.05)。
2.3.2 维拉帕米、地尔硫和硝苯地平对高K+诱导PC12细胞[Ca2+]i升高的影响 在维拉帕米、地尔硫和硝苯地平的浓度分别为5×10-5, 1×10-4, 5×10-3 mol/L时,可完全抑制由55 mmol/L KCl诱导的PC12细胞[Ca2+]i升高。随着3种钙通道阻滞剂使用浓度的降低,抑制作用逐渐减弱,它们的作用强度顺序为:维拉帕米>地尔硫>硝苯地平(图3)。
, 百拇医药
2.4 N-型电压门控钙通道阻滞剂对高K+诱导PC12细胞Δ[Ca2+]i的影响 用1×10-6 mol/L N-型电压门控钙通道阻滞剂ω-conotoxin GVIA在37℃预处理PC12细胞5 min时给予55 mmol/L KCl刺激,Δ[Ca2+]i 为(604±115)nmol/L(n=20); 单独用55 mmol/L KCl刺激的对照组的Δ[Ca2+]i为(626±136)nmol/L(n=20)。统计结果表明,1×10-6mol/L ω-conotoxin GVIA对高K+诱导的PC12细胞[Ca2+]i升高没有产生明显的抑制作用。
2.5 维拉帕米对Ca2+诱导PC12细胞Δ[Ca2+]i的影响 在细胞外无钙条件下,向细胞外液中补加3 mmol/L CaCl2,可使 Δ[Ca2+]i 达到(444±110)nmol/L(n=40), 当用5×10-5 mol/L维拉帕米预处理PC12细胞5 min(37℃)时,再补加3 mmol/L CaCl2于细胞外液,Δ[Ca2+]i 为(450±98)nmol/L(n=40)。统计分析表明:在维拉帕米完全抑制高K+诱导PC12细胞[Ca2+]i升高的浓度,其对外钙漏流入PC12细胞没有明显抑制作用。
, 百拇医药
3 讨 论
PC12细胞是研究神经内分泌、神经药理、神经毒理、神经发育等的常用实验模型,Ca2+是神经元内重要的第二信使,在许多生物过程中,起着不可缺少的调节作用。而KCl又是研究Ca2+调节作用常使用的刺激剂。如高K+诱导的PC12细胞外Ca2+内流可使表皮生长因子受体酪氨酸磷酸化,并进一步激活下游的蛋白激酶[3]。Matsuzawa等发现,高K+可诱导PC12细胞释放磷酯酶A2(PLA2)于细胞外液中,因PLA2可调节脱颗粒过程,所以这种释放对PC12细胞分泌儿茶酚胺是必要的[4]。Aletta等用高K+刺激PC12细胞,可快速引起钙调蛋白激酶I磷酸化,并使钙调蛋白激酶I的活性增加7.3倍;而使用L-型电压门控通道阻滞剂可使这种激活作用降低80%[5]。因此,弄清高K+诱导PC12细胞[Ca2+]i升高的机制,就显得特别重要。实验中使用不同浓度KCl刺激细胞,PC12细胞可产生对KCl剂量依赖性的[Ca2+]i升高,可能是不同浓度KCl引起细胞膜电位去极化程度不同所致,因去极化程度越大,膜上电压门控钙通道开放几率越大,宏观电流也越大[6],其结果是使[Ca2+]i越高。
, 百拇医药
当维拉帕米、地尔硫和硝苯地平浓度分别为5×10-5, 1×10-4和5×10-3 mol/L 时,可完全阻断高K+引起的[Ca2+]i升高,表明PC12细胞膜上电压门控钙通道主要为L-型。Sher等报道[7]ω-conotoxin GVIA的浓度在2×10-10 mol/L时,与PC12细胞的结合便达到饱和状态。本实验使用1×10-6 mol/L N-型电压门控钙通道阻滞剂ω-conotoxin GVIA,对高K+诱导PC12细胞[Ca2+]i升高仍然没有明显抑制作用的结果,也进一步证实了上面的结论。与我们的结果相一致是:Toll[8]和Stallcup[9]等通过电生理和药理学方法详细分析了PC12细胞膜上钙通道的分布情况,发现在未用NGF分化的PC12细胞膜上,电压门控钙通道主要为L型,没有或很难确定有N-型钙通道。本实验中,当细胞外无Ca2+时,高K+不能诱导PC12细胞[Ca2+]i发生改变,提示在PC12细胞,高K+本身不能诱导内钙释放。如果高K+引起内钙释放,也是依赖细胞外钙的存在,或者是高K+导致外钙依赖的磷脂酶C(PLC)活化,生成三磷酸肌醇(IP3),从而引起内钙释放或者外钙内流后直接作用于细胞内钙库引起内钙释放所致,即是说以膜上电压门控钙通道开放为基础。而使用5×10-5mol/L维拉帕米对细胞外由无Ca2+到有Ca2+过程引起的[Ca2+]i升高(属漏流形式)没有抑制作用,表明这种形式的[Ca2+]i变化与L-型钙通道无关,同时也表明高K+引起PC12细胞[Ca2+]i升高,主要是通过电压门控钙通道开放引起,与钙漏流无关。所以,膜上L-型电压门控钙通道开放是高K+诱导PC12细胞[Ca2+]i升高的决定因素。
, 百拇医药
参 考 文 献
1 Osullivan AJ, Cheek TR, Moreton RB, et al. Localization and heterogeneity of agonist-induced changes in cytosolic calcium concentration in single bovine adrenal chromaffin cells from video imaging of fura-2. EMBO J, 1989,8(2): 401
2 Grynkiewicz G, Poenie M, Tsien RY. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem, 1985,260(6):3440
, http://www.100md.com
3 Zwick E, Daub H, Aoki N, et al. Critical role of calcium-dependent epidermal growth factor receptor transactivation in PC12 cell membrane depolarization and bradykinin signaling. J Biol Chem, 1997, 272(40): 24767
4 Matsuzawa A, Murakami M, Atsumi G, et al. Release of secretory phospholipase A2 from rat neuronal cells and its possible function in the regulation of catecholamine secretion. Biochem J, 1996,318 (Pt 2): 701
, http://www.100md.com
5 Aletta JM, Selbert MA, Nairn AC, et al. Activation of a calcium-calmodulin-dependent protein kinase I cascade in PC12 cells. J Biol Chem, 1996,271(34):20930
6 Fox AP, Nowycky MC, Tsien RW. Single-channel recording of three types of calcium channels in chick sensory neurons. J Physiol, 1987, 394(2):173
7 Sher E, Pandiella A, Clementi F. ω-Conotoxin binding and effects on calcium channel function in human neuroblastoma and rat pheochromocytoma cell lines. FEBS Lett, 1988, 235(1/2):178
, 百拇医药
8 Toll L. Calcium antagonists: high-affinity binding and inhibition of calcium transport in a clonal cell line. J Biol Chem, 1982, 257(22):13189
9 Stallcup WB. Sodium and calcium fluxes in a clonal nerves cell lines. J Physiol (London), 1979, 286(2): 525
(1997-11-16收稿, 1998-06-16修回)
, 百拇医药
单位:
关键词:红花;栽培居群;组织构造;脂肪酸
摘要 目的摘要 目的: 分析高钾离子(K+)引起PC12细胞内游离钙离子浓度([Ca2+]i)升高的可能机制。方法: 利用MiraCal Image System 检测[Ca2+]i,Ca2+荧光探针为Fura-2/AM。结果: (1)KCl浓度为30~100 mmol/L时,可剂量依赖性地诱导PC12细胞[Ca2+]i升高;(2)在细胞外无Ca2+时,高K+对PC12细胞[Ca2+]i无影响;(3)L-型电压门控钙通道阻滞剂维拉帕米、地尔硫和硝苯地平的浓度分别为5×10-5, 1×10-4和5×10-3 mol/L时,可完全阻断高K+诱导的PC12细胞[Ca2+]i升高,但N-型电压门控钙通道阻滞剂ω-conotoxin GVIA在浓度为1×10-6 mol/L 时,对高K+诱导的PC12细胞[Ca2+]i升高没有影响;(4) 5×10-5 mol/L维拉帕米对细胞外由无Ca2+到有Ca2+过程引起的[Ca2+]i升高无抑制作用。结论: 高K+引起PC12细胞[Ca2+]i升高以细胞质膜上L-型电压门控Ca2+通道开放为基础,与N-型电压门控Ca2+通道和Ca2+漏流关系不明显。
, 百拇医药
中国图书资料分类法分类号 R329.27
Mechanism of [Ca2+]i rise induced by high concentration of potassium ion in PC12 cells
Lou Shujie, Wang Chenguang, Huang Xiuying, Chen Yizhang (Department of Physiology, Department of Basic Medicine,Second Military Medical University, Shanghai, 200433)
Abstract Objective: To elucidate the mechanism of [Ca2+]i rise induced by high-K+ concentration in PC12 cells. Methods: [Ca2+]i was assayed with MiraCal Image System using Fura-2/AM as Ca2+ fluorescence probe. Results: (1) In PC12 cells KCl at 30~100 mmol/L could induce [Ca2+]i rise in concentration dependent manner. (2) In PC12 cells KCl at 55 mmol/L could not induce [Ca2+]i change in extracellular Ca2+-free condition. (3) It was found that verapamil, diltiazem and nifedipine at 5×10-5, 1×10-4and 5×10-3 mol/L, respectively, could inhibit completely [Ca2+]i rise induced by high-K+. But ω-conotoxin GVIA at 1×10-6mol/L showed no influence on [Ca2+]i rise induced by high-K+. (4) Verapamil at 5×10-5 mol/L was ineffective on [Ca2+]i rise induced by addition of CaCl2 to extracellular Ca2+-free condition. Conclusion: The increase of [Ca2+]i in response to KCl stimulation in PC12 cells was determined by the open of L-type voltage-gated calcium channels, N-type voltage-gated calcium channels and the leak influx of Ca2+ were not involved in [Ca2+]i rise induced by high-K+ in PC12 cells.
, 百拇医药
Key words PC12 cells; high concentration K+; intracellular free Ca2+ concentration
PC12细胞是Green等从大鼠肾上腺髓质瘤中获得的细胞株,其形态和功能类似于大鼠肾上腺髓质嗜铬细胞。高K+可引起PC12细胞细胞内游离钙离子浓度([Ca2+]i)升高。一般认为高K+诱导不同细胞[Ca2+]i升高的主要机制是引起细胞膜电位去极化,开放膜上电压门控钙通道所致。但也有文献报道[1]高K+引起牛嗜铬细胞[Ca2+]i升高既与外钙内流有关,也与内钙释放有关。在PC12细胞的情形又是怎样呢?本实验应用Ca2+通道阻滞剂,在有或无细胞外Ca2+条件下对此问题进行了初步研究。
, http://www.100md.com
1 材料和方法
1.1 仪器、药品和细胞 PC12细胞由日本名古屋大学医学院Kuba教授惠赠。维拉帕米(Verapamil)、地尔硫(Diltiazem)、 硝苯地平(Nifedipine)、ω-conotoxin GVIA和Pluronic F-127皆为 Sigma公司产品,Fura-2/Acetoxymethyl ester(AM)为Calbiochem公司产品,HEPES为Serve公司产品,配制Krebs-HEPES缓冲液的无机盐类为国产分析纯级。MiraCal Image System为英国Life Science Resource Ltd产品。激发波长分别为340,380nm,发射波长为510nm。Fura-2/AM、维拉帕米、地尔硫和硝苯地平使用前先用二甲亚砜(DMSO)或乙醇配制成10~100 mmol/L的储存液,使用时再配至所需浓度。
1.2 方法
1.2.1 利用Fura-2/AM检测[Ca2+]i的原理 Fura-2/AM是一种荧光指示剂,可选择性地与Ca2+结合。AM是一种酯,它与Fura-2偶联后,可因其脂溶性弥散入细胞,进而将Fura-2也带入细胞。Fura-2/AM进入细胞后,AM被细胞内的酯酶分解,因Fura-2是水溶性物质,所以留在细胞内。Fura-2与Ca2+结合后,激发波长发生改变,由未结合Ca2+时的380 nm移至340 nm。因此,分别测量340和380 nm波长时Fura-2-Ca2+和Fura-2的荧光强度,代入公式[2]:
, http://www.100md.com
[Ca2+]i=Kd×(R-Rmin)/(Rmax-R)Sf2/Sb2
式中Kd: Fura-2与Ca2+结合的解离常数,其值为224 nmol/L;R:在340和380 nm处的荧光强度比值;Rmin:[Ca2+]i极低时,在340和380 nm处的荧光强度比值;Rmax: [Ca2+]i极高、Fura-2被Ca2+饱和时,在340和380 nm处的荧光强度比值;Sb2:细胞内Fura-2被Ca2+饱和时,在380 nm处的荧光强度;Sf2:[Ca2+]i极低时,在380 nm处的荧光强度。根据公式便可计算出[Ca2+]i。
, http://www.100md.com
1.2.2 Fura-2/AM负载步骤 首先将培养器内的DMEM弃去,用Krebs-HEPES溶液冲洗3遍后,将细胞从壁上吹起、打匀、转入离心管内,根据细胞悬液的体积,加入Pluronic F-127(一种弱的去垢剂,可促进Fura-2/AM进入细胞)和Fura-2/AM,使其终浓度分别为0.04%和5 μmol/L,放37℃ CO2孵箱30 min,中间摇晃几次。取出后,再用Krebs-HEPES离心洗3次,转速500 r/min,以去除细胞表面和细胞外液中的Fura-2/AM。最后用DMEM悬浮,室温放置备用。
1.2.3 单细胞[Ca2+]i的测定与分析 首先将少许细胞悬液滴到铺有胶原的小圆玻片上, 37℃ 10 min。 令细胞贴壁, 吸去DMEM液体, 将玻片嵌在小室的底部, 固定好后, 向室内加入200 μl DMEM液体, 置小室于显微镜镜头下面。 找到一个细胞分散较均匀的视野, 用于单细胞[Ca2+]i的监测。 图像获取及定量分析由 Life Science Resource Ltd 提供的软件 Miracal Version 2.3完成。 在每一个实验结束后, 系统很快便能给出每一个被监测细胞的[Ca2+]i变化的动态反应曲线, 并计算出每一个细胞在某一时刻的[Ca2+]i数值。 细胞内钙浓度最大净升高值为最大钙浓度值(峰值)减去静息钙浓度值, 文中表示为Δ[Ca2+]i 。 每组实验细胞数用n表示。
, 百拇医药
1.2.4 统计学处理 实验数据以
2 结 果
2.1 不同浓度KCl对PC12细胞[Ca2+]i的影响 将KCl配成25 mol/L高浓度的贮存液,实验时,向反应池中加入一定量的高浓度KCl溶液,使其终浓度分别达到30, 40, 50, 60, 70, 80, 90和100 mmol/L。从图1可以看出,给予细胞高K+刺激后,[Ca2+]i迅速升高,然后又很快下降。KCl浓度为30~100 mmol/L时,其诱导PC12细胞[Ca2+]i升高作用呈现剂量依赖性(图2)。

, 百拇医药
图 1 高K+浓度诱导单个PC12细胞[Ca2+]i的变化
Fig 1 Changes in [Ca2+]i in response to high-K+ concentration in single PC12 cell
The arrows indicated the time of addition of 60 mmol/L KCl. One frame represent 3.3s. (a): The 20 cells composite curve, one curve represented the change of [Ca2+]i in one PC12 cell; (b): The average of 20 cells

, http://www.100md.com
图 2 KCl诱导单个PC12 细胞[Ca2+]i升高的剂量-效应曲线
Fig 2 The curve of dose-response effect in increasing
[Ca2+]i induced by KCl in single PC12 cell
n=20~40
图 3 维拉帕米、地尔硫和硝苯地平抑制Δ[Ca2+]i的剂量-效应曲线
○) or diltiazem (□) or nifedipine (△) on Δ[Ca2+]i
, http://www.100md.com
The values of Δ[Ca2+]i are
2.2 PC12细胞外无Ca2+时KCl对[Ca2+]i的影响
细胞贴壁后用无钙Krebs-HEPES(内含0.1 mmol/L EGTA)洗两遍后,加入无钙Krebs-HEPES,马上用于实验。结果表明:在细胞外无Ca2+时,静息状态下的PC12细胞[Ca2+]i为(11±2)nmol/L(n=20)。当给予55 mmol/L KCl 刺激时,PC12细胞[Ca2+]i 仍为(11±2)nmol/L(n=20),可见在细胞外无Ca2+时,高K+本身不能诱导细胞内Ca2+释放。
, http://www.100md.com
2.3 L-型电压门控钙通道阻滞剂对高K+诱导PC12细胞[Ca2+]i的影响
2.3.1 DMSO和乙醇对高K+诱导PC12细胞[Ca2+]i升高的影响 用0.1% DMSO或0.1%乙醇预处理PC12细胞5 min时(37℃),给予55 mmol/L KCl刺激,结果DMSO组、乙醇组和对照组(单纯给予KCl刺激)的Δ[Ca2+]i分别为(640±129),(634±115)和(626±136)nmol/L(n均为20)。统计结果表明:无论是DMSO还是乙醇,对高K+引起的PC12细胞[Ca2+]i升高没有明显的促进或抑制作用(P>0.05)。
2.3.2 维拉帕米、地尔硫和硝苯地平对高K+诱导PC12细胞[Ca2+]i升高的影响 在维拉帕米、地尔硫和硝苯地平的浓度分别为5×10-5, 1×10-4, 5×10-3 mol/L时,可完全抑制由55 mmol/L KCl诱导的PC12细胞[Ca2+]i升高。随着3种钙通道阻滞剂使用浓度的降低,抑制作用逐渐减弱,它们的作用强度顺序为:维拉帕米>地尔硫>硝苯地平(图3)。
, 百拇医药
2.4 N-型电压门控钙通道阻滞剂对高K+诱导PC12细胞Δ[Ca2+]i的影响 用1×10-6 mol/L N-型电压门控钙通道阻滞剂ω-conotoxin GVIA在37℃预处理PC12细胞5 min时给予55 mmol/L KCl刺激,Δ[Ca2+]i 为(604±115)nmol/L(n=20); 单独用55 mmol/L KCl刺激的对照组的Δ[Ca2+]i为(626±136)nmol/L(n=20)。统计结果表明,1×10-6mol/L ω-conotoxin GVIA对高K+诱导的PC12细胞[Ca2+]i升高没有产生明显的抑制作用。
2.5 维拉帕米对Ca2+诱导PC12细胞Δ[Ca2+]i的影响 在细胞外无钙条件下,向细胞外液中补加3 mmol/L CaCl2,可使 Δ[Ca2+]i 达到(444±110)nmol/L(n=40), 当用5×10-5 mol/L维拉帕米预处理PC12细胞5 min(37℃)时,再补加3 mmol/L CaCl2于细胞外液,Δ[Ca2+]i 为(450±98)nmol/L(n=40)。统计分析表明:在维拉帕米完全抑制高K+诱导PC12细胞[Ca2+]i升高的浓度,其对外钙漏流入PC12细胞没有明显抑制作用。
, 百拇医药
3 讨 论
PC12细胞是研究神经内分泌、神经药理、神经毒理、神经发育等的常用实验模型,Ca2+是神经元内重要的第二信使,在许多生物过程中,起着不可缺少的调节作用。而KCl又是研究Ca2+调节作用常使用的刺激剂。如高K+诱导的PC12细胞外Ca2+内流可使表皮生长因子受体酪氨酸磷酸化,并进一步激活下游的蛋白激酶[3]。Matsuzawa等发现,高K+可诱导PC12细胞释放磷酯酶A2(PLA2)于细胞外液中,因PLA2可调节脱颗粒过程,所以这种释放对PC12细胞分泌儿茶酚胺是必要的[4]。Aletta等用高K+刺激PC12细胞,可快速引起钙调蛋白激酶I磷酸化,并使钙调蛋白激酶I的活性增加7.3倍;而使用L-型电压门控通道阻滞剂可使这种激活作用降低80%[5]。因此,弄清高K+诱导PC12细胞[Ca2+]i升高的机制,就显得特别重要。实验中使用不同浓度KCl刺激细胞,PC12细胞可产生对KCl剂量依赖性的[Ca2+]i升高,可能是不同浓度KCl引起细胞膜电位去极化程度不同所致,因去极化程度越大,膜上电压门控钙通道开放几率越大,宏观电流也越大[6],其结果是使[Ca2+]i越高。
, 百拇医药
当维拉帕米、地尔硫和硝苯地平浓度分别为5×10-5, 1×10-4和5×10-3 mol/L 时,可完全阻断高K+引起的[Ca2+]i升高,表明PC12细胞膜上电压门控钙通道主要为L-型。Sher等报道[7]ω-conotoxin GVIA的浓度在2×10-10 mol/L时,与PC12细胞的结合便达到饱和状态。本实验使用1×10-6 mol/L N-型电压门控钙通道阻滞剂ω-conotoxin GVIA,对高K+诱导PC12细胞[Ca2+]i升高仍然没有明显抑制作用的结果,也进一步证实了上面的结论。与我们的结果相一致是:Toll[8]和Stallcup[9]等通过电生理和药理学方法详细分析了PC12细胞膜上钙通道的分布情况,发现在未用NGF分化的PC12细胞膜上,电压门控钙通道主要为L型,没有或很难确定有N-型钙通道。本实验中,当细胞外无Ca2+时,高K+不能诱导PC12细胞[Ca2+]i发生改变,提示在PC12细胞,高K+本身不能诱导内钙释放。如果高K+引起内钙释放,也是依赖细胞外钙的存在,或者是高K+导致外钙依赖的磷脂酶C(PLC)活化,生成三磷酸肌醇(IP3),从而引起内钙释放或者外钙内流后直接作用于细胞内钙库引起内钙释放所致,即是说以膜上电压门控钙通道开放为基础。而使用5×10-5mol/L维拉帕米对细胞外由无Ca2+到有Ca2+过程引起的[Ca2+]i升高(属漏流形式)没有抑制作用,表明这种形式的[Ca2+]i变化与L-型钙通道无关,同时也表明高K+引起PC12细胞[Ca2+]i升高,主要是通过电压门控钙通道开放引起,与钙漏流无关。所以,膜上L-型电压门控钙通道开放是高K+诱导PC12细胞[Ca2+]i升高的决定因素。
, 百拇医药
参 考 文 献
1 Osullivan AJ, Cheek TR, Moreton RB, et al. Localization and heterogeneity of agonist-induced changes in cytosolic calcium concentration in single bovine adrenal chromaffin cells from video imaging of fura-2. EMBO J, 1989,8(2): 401
2 Grynkiewicz G, Poenie M, Tsien RY. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem, 1985,260(6):3440
, http://www.100md.com
3 Zwick E, Daub H, Aoki N, et al. Critical role of calcium-dependent epidermal growth factor receptor transactivation in PC12 cell membrane depolarization and bradykinin signaling. J Biol Chem, 1997, 272(40): 24767
4 Matsuzawa A, Murakami M, Atsumi G, et al. Release of secretory phospholipase A2 from rat neuronal cells and its possible function in the regulation of catecholamine secretion. Biochem J, 1996,318 (Pt 2): 701
, http://www.100md.com
5 Aletta JM, Selbert MA, Nairn AC, et al. Activation of a calcium-calmodulin-dependent protein kinase I cascade in PC12 cells. J Biol Chem, 1996,271(34):20930
6 Fox AP, Nowycky MC, Tsien RW. Single-channel recording of three types of calcium channels in chick sensory neurons. J Physiol, 1987, 394(2):173
7 Sher E, Pandiella A, Clementi F. ω-Conotoxin binding and effects on calcium channel function in human neuroblastoma and rat pheochromocytoma cell lines. FEBS Lett, 1988, 235(1/2):178
, 百拇医药
8 Toll L. Calcium antagonists: high-affinity binding and inhibition of calcium transport in a clonal cell line. J Biol Chem, 1982, 257(22):13189
9 Stallcup WB. Sodium and calcium fluxes in a clonal nerves cell lines. J Physiol (London), 1979, 286(2): 525
(1997-11-16收稿, 1998-06-16修回)
, 百拇医药