一氧化氮合成酶抑制剂(L-NNA)对缺血纹体兴奋性和抑制性氨基酸释放的影响
作者:徐超 张绍东 崔雯 朱凌
单位:100050 北京市神经外科研究所
关键词:半球缺血;纹体;兴奋性氨基酸;抑制性氨基酸;一氧化氮合成酶抑制剂
中华神经外科杂志980410 摘要 目的:研究一氧化氮合成酶抑制剂(L-NNA)对大鼠半球持续性缺血时兴奋性和抑制性氨基酸释放的影响。方法:用微透析结合高效液相法测定半球缺血30,60,90,120分钟时大鼠纹体Glu,Asp,Gly,Tau和GABA的释放。结果:大鼠半球缺血30,60,90,120分钟时纹体所有五种氨基酸的释放都显著增加,除了120分钟缺血时L-NNA可影响Glu的释放外,并不明显影响缺血时纹体Glu和Asp的释放。然而,它可明显地促进大鼠半球缺血30,60,90,120分钟时纹体Gly,Tau和GABA的释放。结论:半球缺血时所有五种氨基酸的不正常释放都参与了脑缺血病理过程,L-NNA促进半球缺血时抑制性氨基酸的释放可能是其保护缺血大脑的机制之一。
, http://www.100md.com
The influences of NOS inhibitor L-NNA on the releases of exitatory and inhibitory amino acids from rat striatums during persistent global ischemia. Xu Chao, Zhang Shaodong, Cui Wen, et al. Beijing Neurosurgical Institute, Beijing 100050
Abstract Objective: To study the influences of NOS inhibitor L-NNA on the releases of exitatory and inhibitory amino acids from rat striatums during persistent global ischemia. Methods: The releases of Glu, Asp, Gly, Tau and GABA from rat striatums during 30,60,90,120 min of global ischemia were determined by microdialysis and HPLC methods. Results: The releases of all five kinds of amino acids from rat striatum were remarkably increased during 30, 60,90,120 min of global ischemia. The increased releases of Glu and Asp were not influenced by L-NNA except the release of Glu increased during 120 min of ischemia. However, the increased Gly Tau and GABA release were promoted by L-NNA during 30,60,90,120 min ischemia. Conclusion: The abnormal release of all five kinds of amino acids are involved in the pathophysiological process of cerebral ischemia. The significanly increased release of inhibitory amino acids promoted by L-NNA during global ischemia may be one of the protective mechanisms of this agent on brain ischemia.
, 百拇医药
Key words Global ischemia Striatum EAA IAA L-NNA
一氧化氮(NO)是近年新发现的一种活性物质,在脑内和脑血管内也广泛存在。它具有多种功能既是自由基递质,又是血管舒张因子(1)。在脑缺血中既能起有害作用,又能起有利作用,各家结果不同,争论颇多(2,3)。因此有关NO在脑缺血中的作用,特别是其作用机制还需进一步研究。体外和体内实验中,已证明NO能调节不同递质的释放(4),而兴奋性氨基酸和抑制性氨基酸释放在脑缺血继发性损伤中起重要作用,因此,本文观察了大鼠半球持续性缺血时,一氧化氮合成酶抑制剂(L-NNA)对纹体谷氨酸(Glu),天门冬氨酸(Asp),甘氨酸(Gly),牛磺酸(Tau),r-氨基丁酸(GABA)释放的影响,由此角度去研究NO在脑缺血中的作用机制以及探索NO抑制剂能否保护缺血大脑。
材料和方法
, http://www.100md.com
雄性Wistar大鼠,体重250g~300g,10%水合氯醛麻醉,仰卧固定,颈正中切开,分离肌肉到近枕骨腹侧面,打一骨窗,可见基底动脉,手术显微镜下用双极电凝灼烧,剪断,缝合皮肤。置于笼中,自由进食。第二天,同样麻醉条件下,打开正中切口,分离双侧颈总动脉备用。需要形成脑缺血时,用动脉夹夹闭双侧颈总动脉(5)。
大鼠腹卧固定,头部正在剪开,冠状缝下1.8mm,正中缝左侧2.0mm打一骨窗,将大鼠固定于立体定位仪上,CMA-10微透析探针向下深入脑组织6.5mm,透析过程中定时补充麻醉药。灌流液的组成为:NaCl 147mM,KCl 4mM,CaCl 2.3mM,以2μl/min流速进行微透析灌流。透析开始,预平衡2小时后,开始计时,于冰浴中收集样品,每30分钟收集1管,平衡后,阻断颈总动脉(缺血)前,共收集4管(计2小时)作缺血前正常对照。阻断后每30分钟收集1管,共4管,即为不同缺血时间的样品。给药组动物于缺血前1小时腹腔注射L-NNA(100mg/kg),按同样条件收集样品。收集的样品冻干保存,Glu,Asp,Gly,Tau和GABA用AccQ-Tag柱后衍生法HPLC测定,样品衍生后,进样,用荧光分光光度检测器进行定量(6)。
, 百拇医药
结 果
1.大鼠半球缺血不同时间纹体Glu,Asp,Gly,Tau和GABA的释放:正常状态下(缺血前)大鼠纹体Glu,Asp,Gly,Tau和GABA的基础释放分别为1549+/-250 pmol/ml,509+/-98 pmol/ml,713+/-56 pmol/ml,4063+/-408 pmol/ml和52.5+/-6.0pmol/ml。分别以此基础释放值为100%,大鼠半球持续缺血30,60,90,120分钟时五种兴奋性和抑制性氨基酸的释放(以变化百分率计)都明显升高。P值均小于0.001见图1,2。
2.一氧化氮合成酶抑制剂L-NNA对大鼠半球持续缺血不同时间纹体Glu,Asp,Gly,Tau和GABA的释放影响:由附表可见到,半球持续缺血30,60,90分钟时L-NNA对Glu释放无明显影响,但缺血120分钟时L-NNA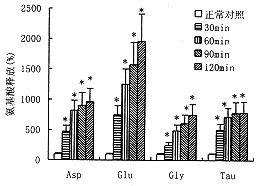
, 百拇医药
图1 大鼠半球缺血后不同时间纹体Asp, Glu, Gly, Tau释放的变化
图中数据为平均值±标准误,与缺血前相比,*P<0.01
附表 L-NNA对大鼠半球持续缺血不同时间后纹体氨基酸释放的影响(%)
Asp
Glu
Gly
Tau
GABA
缺血时间
对照组
L-NNA组
, 百拇医药
对照组
L-NNA组
对照组
L-NNA组
对照组
L-NNA组
对照组
L-NNA组
30min
476±296
361±148
747±459
712±158
, 百拇医药
249±68
384±133**
501±193
963±309###
5593±285
15925±9263***
60min
820±623
645±220
1253±442
1371±323
, 百拇医药
489±150
670±200*
717±101
1143±411***
10786±8513
25399±7122##
90min
900±699
614±213
1576±435
1425±394
, 百拇医药
611±281
847±170**
781±108
1230±280###
23800±10326
43287±24750*
120min
960±684
761±337
1958±481
1570±236*
, 百拇医药
750±226
1155±250#
786±114
1475±565#
28937±9000
52807±24732**
注:表中数值为 ±s与同时间缺血组氨基酸释放变化百分率比较
±s与同时间缺血组氨基酸释放变化百分率比较
*P<0.05,**P<0.025,***P<0.01,#P<0.005,##P<0.0025,###P<0.001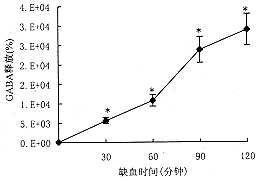
, 百拇医药
图2 大鼠半球缺血后不同时间纹体GABA释放的变化
图中数据为平均值±标准误,与缺血前相比,*P<0.001
明显降低Glu的释放。在四个缺血时间L-NNA虽然都能降低纹体 Asp的释放,但都无统计学差异。半球持续缺血30,60,90,120分钟时,L-NNA能非常明显升高纹体Gly,Tau和GABA的释放。
讨 论
由图1和图2所示结果可见大鼠半球持续缺血30,60,90,120分钟地五种氨基酸的释放都明显升高,提示它们都参与了脑缺血的病理生理过程。Glu和Asp是脑内二种最主要的兴奋性递质,Gly虽然传统上是一种抑制性递质,但在NMDA受体上又有Gly调节位点,因此这三种氨基酸的释放与脑缺血时兴奋性毒性作用有密切关系。而GABA和Tau是脑内主要的抑制性递质,它们的释放和受体激活有利于对抗脑缺血时兴奋性毒性的作用,保护神经元不受损害(7,8)。而且从我们的结果中可以看到,持续半球缺血过程中GABA释放增加的幅度远远高于Glu和Asp释放增加的幅度,表明GABA释放的猛增可能是大脑对抗缺血损害的一种自身保护机制。
, 百拇医药
如前言所述,NO在脑缺血中的作用及NOS抑制剂能否保护缺血大脑是近年来广为关注的一个研究课题,但由于所选动物模型、缺血类型、给药时间、剂量、给药方式的不同,结果紊乱,争议较多。NO能调节不同递质(包括谷氨酸)的释放,因此,研究NOS抑制剂对缺血时不同氨基酸释放的影响,有助于从一个新的角度去探讨NOS抑制剂的抗脑缺血作用。已有人报告了短暂性半球缺血15分钟和20分钟后再灌注时,NOS抑制剂对皮层或纹体Glu、Asp释放的影响(9,10)。由于NO既对神经元又对脑血管有作用,不同类型的NOS分别存在于神经元和脑血管内,为了在研究中突出非特异性NOS抑制剂L-NNA对神经元的作用,尽量减少其对血流作用的影响,我们首次报告了持续性半球缺血条件下,NOS抑制剂对纹体兴奋性氨基酸和抑制性氨基酸释放的影响。半球缺血30,60,90分钟后,L-NNA不改变纹体Glu的释放,而120分钟后,降低Glu的释放。L-NNA虽然能降低Asp的释放,但此改变在统计学上无明显差异。相反,L-NNA可非常明显地增加持续缺血30,60,90,120分钟时纹体GABA,Tau,Gly的释放,前二者释放的增加可拮抗缺血大脑过度的兴奋性。因此,从递质释放角度来看,L-NNA的抗脑缺血作用可能主要是通过增强抑制性递质而不是通过抑制兴奋性递质的作用去实现的。Gly从传统意义上来讲一直是一种抑制性递质,但近年来有报告认为它仅在脑干和脊髓部位发挥抑制性递质作用,且NMDA受体上又存在Gly结合位点,因此,L-NNA加强缺血时纹体Gly的释放,究竟是有利还是有害,还需要一些其他的研究才能确定。
, 百拇医药
参 考 文 献
1 Moncada S,Palmer R M J,Higgs E A. Nitric Oxide:physiology,pathophysiology,and pharmacology.Pharmacol Rev,1991,43:109-142.
2 Buisson A,Plotkine M,Boulu R G.The neuroprotective effect of a nitric oxide inhibitor in a rat model of focal cerebral ischemia.Brit J Pharmacol,1992,106:766-767.
3 Yamamoto S,Golanon E V,Barger S B,et al.Inhibition of nitric oxide synthesis increases focal ischemic infarction in rat.J cereb Blood FLow Metab,1992,12:717-726.
, http://www.100md.com
4 Guevara-guzman R,Emson P C,Kendrick K M.Modulation of in vivo striatal transmitter release by nitric oxide and cyclic GMP.J Neurochem,1994,62:807-810.
5 Kameyama M,Suzuki J,Shirane R,et al.A new model of bilateral hemispheric ischemia in the rat:three vessel occlusion model.Stroke,1985,16:489-493.
6 Steven A C,Dennis P M.Synthesis of a fluorescent derivatizing reagent,6-aminoguinolys-N-hydroxysuccinimidyl carbamate and its application for the analysis of hyduoysate amion acids via high performance liquid chromatagraphy.Anal Biochem,1993,211:279-287.
, http://www.100md.com
7 Fern R,Waxman S G,Ransom B R,et al.Endogenous GABA attenuates CNS white matter dysfunction follwing anoxia.J Neurosci,1995,15:699-708.
8 Shinji S,Miki K,Megumi S,et al.Effect of Systemic administration of N-Methyl-D-Aspartic acid on extracellular taurine level measured by microdialysis in the hippocampal CAl field and striatum of rats.J Neurochem,1993,61:1698-1704.
9 Zhang J,Benveniste H,Klitzman B, et al.Nitric oxide synthease inhibition and extracellular glutamate concentration after cerebral ischemia/reperfusion.Stroke,1997,26:298-304.
10 Buisson A,Margaill I,callebert J, et al.Mechanisms involved in the neuroprotective activity of a nitric oxide synthase inhibitor during focal cerebral ischemia.J Neurochem,1993,61:690-696.
本研究为国家“八五”攻关课题(85-915-03-07合同)
(收稿:1997-01-08 修回:1997-08-19), 百拇医药
单位:100050 北京市神经外科研究所
关键词:半球缺血;纹体;兴奋性氨基酸;抑制性氨基酸;一氧化氮合成酶抑制剂
中华神经外科杂志980410 摘要 目的:研究一氧化氮合成酶抑制剂(L-NNA)对大鼠半球持续性缺血时兴奋性和抑制性氨基酸释放的影响。方法:用微透析结合高效液相法测定半球缺血30,60,90,120分钟时大鼠纹体Glu,Asp,Gly,Tau和GABA的释放。结果:大鼠半球缺血30,60,90,120分钟时纹体所有五种氨基酸的释放都显著增加,除了120分钟缺血时L-NNA可影响Glu的释放外,并不明显影响缺血时纹体Glu和Asp的释放。然而,它可明显地促进大鼠半球缺血30,60,90,120分钟时纹体Gly,Tau和GABA的释放。结论:半球缺血时所有五种氨基酸的不正常释放都参与了脑缺血病理过程,L-NNA促进半球缺血时抑制性氨基酸的释放可能是其保护缺血大脑的机制之一。
, http://www.100md.com
The influences of NOS inhibitor L-NNA on the releases of exitatory and inhibitory amino acids from rat striatums during persistent global ischemia. Xu Chao, Zhang Shaodong, Cui Wen, et al. Beijing Neurosurgical Institute, Beijing 100050
Abstract Objective: To study the influences of NOS inhibitor L-NNA on the releases of exitatory and inhibitory amino acids from rat striatums during persistent global ischemia. Methods: The releases of Glu, Asp, Gly, Tau and GABA from rat striatums during 30,60,90,120 min of global ischemia were determined by microdialysis and HPLC methods. Results: The releases of all five kinds of amino acids from rat striatum were remarkably increased during 30, 60,90,120 min of global ischemia. The increased releases of Glu and Asp were not influenced by L-NNA except the release of Glu increased during 120 min of ischemia. However, the increased Gly Tau and GABA release were promoted by L-NNA during 30,60,90,120 min ischemia. Conclusion: The abnormal release of all five kinds of amino acids are involved in the pathophysiological process of cerebral ischemia. The significanly increased release of inhibitory amino acids promoted by L-NNA during global ischemia may be one of the protective mechanisms of this agent on brain ischemia.
, 百拇医药
Key words Global ischemia Striatum EAA IAA L-NNA
一氧化氮(NO)是近年新发现的一种活性物质,在脑内和脑血管内也广泛存在。它具有多种功能既是自由基递质,又是血管舒张因子(1)。在脑缺血中既能起有害作用,又能起有利作用,各家结果不同,争论颇多(2,3)。因此有关NO在脑缺血中的作用,特别是其作用机制还需进一步研究。体外和体内实验中,已证明NO能调节不同递质的释放(4),而兴奋性氨基酸和抑制性氨基酸释放在脑缺血继发性损伤中起重要作用,因此,本文观察了大鼠半球持续性缺血时,一氧化氮合成酶抑制剂(L-NNA)对纹体谷氨酸(Glu),天门冬氨酸(Asp),甘氨酸(Gly),牛磺酸(Tau),r-氨基丁酸(GABA)释放的影响,由此角度去研究NO在脑缺血中的作用机制以及探索NO抑制剂能否保护缺血大脑。
材料和方法
, http://www.100md.com
雄性Wistar大鼠,体重250g~300g,10%水合氯醛麻醉,仰卧固定,颈正中切开,分离肌肉到近枕骨腹侧面,打一骨窗,可见基底动脉,手术显微镜下用双极电凝灼烧,剪断,缝合皮肤。置于笼中,自由进食。第二天,同样麻醉条件下,打开正中切口,分离双侧颈总动脉备用。需要形成脑缺血时,用动脉夹夹闭双侧颈总动脉(5)。
大鼠腹卧固定,头部正在剪开,冠状缝下1.8mm,正中缝左侧2.0mm打一骨窗,将大鼠固定于立体定位仪上,CMA-10微透析探针向下深入脑组织6.5mm,透析过程中定时补充麻醉药。灌流液的组成为:NaCl 147mM,KCl 4mM,CaCl 2.3mM,以2μl/min流速进行微透析灌流。透析开始,预平衡2小时后,开始计时,于冰浴中收集样品,每30分钟收集1管,平衡后,阻断颈总动脉(缺血)前,共收集4管(计2小时)作缺血前正常对照。阻断后每30分钟收集1管,共4管,即为不同缺血时间的样品。给药组动物于缺血前1小时腹腔注射L-NNA(100mg/kg),按同样条件收集样品。收集的样品冻干保存,Glu,Asp,Gly,Tau和GABA用AccQ-Tag柱后衍生法HPLC测定,样品衍生后,进样,用荧光分光光度检测器进行定量(6)。
, 百拇医药
结 果
1.大鼠半球缺血不同时间纹体Glu,Asp,Gly,Tau和GABA的释放:正常状态下(缺血前)大鼠纹体Glu,Asp,Gly,Tau和GABA的基础释放分别为1549+/-250 pmol/ml,509+/-98 pmol/ml,713+/-56 pmol/ml,4063+/-408 pmol/ml和52.5+/-6.0pmol/ml。分别以此基础释放值为100%,大鼠半球持续缺血30,60,90,120分钟时五种兴奋性和抑制性氨基酸的释放(以变化百分率计)都明显升高。P值均小于0.001见图1,2。
2.一氧化氮合成酶抑制剂L-NNA对大鼠半球持续缺血不同时间纹体Glu,Asp,Gly,Tau和GABA的释放影响:由附表可见到,半球持续缺血30,60,90分钟时L-NNA对Glu释放无明显影响,但缺血120分钟时L-NNA

, 百拇医药
图1 大鼠半球缺血后不同时间纹体Asp, Glu, Gly, Tau释放的变化
图中数据为平均值±标准误,与缺血前相比,*P<0.01
附表 L-NNA对大鼠半球持续缺血不同时间后纹体氨基酸释放的影响(%)
Asp
Glu
Gly
Tau
GABA
缺血时间
对照组
L-NNA组
, 百拇医药
对照组
L-NNA组
对照组
L-NNA组
对照组
L-NNA组
对照组
L-NNA组
30min
476±296
361±148
747±459
712±158
, 百拇医药
249±68
384±133**
501±193
963±309###
5593±285
15925±9263***
60min
820±623
645±220
1253±442
1371±323
, 百拇医药
489±150
670±200*
717±101
1143±411***
10786±8513
25399±7122##
90min
900±699
614±213
1576±435
1425±394
, 百拇医药
611±281
847±170**
781±108
1230±280###
23800±10326
43287±24750*
120min
960±684
761±337
1958±481
1570±236*
, 百拇医药
750±226
1155±250#
786±114
1475±565#
28937±9000
52807±24732**
注:表中数值为
 ±s与同时间缺血组氨基酸释放变化百分率比较
±s与同时间缺血组氨基酸释放变化百分率比较*P<0.05,**P<0.025,***P<0.01,#P<0.005,##P<0.0025,###P<0.001

, 百拇医药
图2 大鼠半球缺血后不同时间纹体GABA释放的变化
图中数据为平均值±标准误,与缺血前相比,*P<0.001
明显降低Glu的释放。在四个缺血时间L-NNA虽然都能降低纹体 Asp的释放,但都无统计学差异。半球持续缺血30,60,90,120分钟时,L-NNA能非常明显升高纹体Gly,Tau和GABA的释放。
讨 论
由图1和图2所示结果可见大鼠半球持续缺血30,60,90,120分钟地五种氨基酸的释放都明显升高,提示它们都参与了脑缺血的病理生理过程。Glu和Asp是脑内二种最主要的兴奋性递质,Gly虽然传统上是一种抑制性递质,但在NMDA受体上又有Gly调节位点,因此这三种氨基酸的释放与脑缺血时兴奋性毒性作用有密切关系。而GABA和Tau是脑内主要的抑制性递质,它们的释放和受体激活有利于对抗脑缺血时兴奋性毒性的作用,保护神经元不受损害(7,8)。而且从我们的结果中可以看到,持续半球缺血过程中GABA释放增加的幅度远远高于Glu和Asp释放增加的幅度,表明GABA释放的猛增可能是大脑对抗缺血损害的一种自身保护机制。
, 百拇医药
如前言所述,NO在脑缺血中的作用及NOS抑制剂能否保护缺血大脑是近年来广为关注的一个研究课题,但由于所选动物模型、缺血类型、给药时间、剂量、给药方式的不同,结果紊乱,争议较多。NO能调节不同递质(包括谷氨酸)的释放,因此,研究NOS抑制剂对缺血时不同氨基酸释放的影响,有助于从一个新的角度去探讨NOS抑制剂的抗脑缺血作用。已有人报告了短暂性半球缺血15分钟和20分钟后再灌注时,NOS抑制剂对皮层或纹体Glu、Asp释放的影响(9,10)。由于NO既对神经元又对脑血管有作用,不同类型的NOS分别存在于神经元和脑血管内,为了在研究中突出非特异性NOS抑制剂L-NNA对神经元的作用,尽量减少其对血流作用的影响,我们首次报告了持续性半球缺血条件下,NOS抑制剂对纹体兴奋性氨基酸和抑制性氨基酸释放的影响。半球缺血30,60,90分钟后,L-NNA不改变纹体Glu的释放,而120分钟后,降低Glu的释放。L-NNA虽然能降低Asp的释放,但此改变在统计学上无明显差异。相反,L-NNA可非常明显地增加持续缺血30,60,90,120分钟时纹体GABA,Tau,Gly的释放,前二者释放的增加可拮抗缺血大脑过度的兴奋性。因此,从递质释放角度来看,L-NNA的抗脑缺血作用可能主要是通过增强抑制性递质而不是通过抑制兴奋性递质的作用去实现的。Gly从传统意义上来讲一直是一种抑制性递质,但近年来有报告认为它仅在脑干和脊髓部位发挥抑制性递质作用,且NMDA受体上又存在Gly结合位点,因此,L-NNA加强缺血时纹体Gly的释放,究竟是有利还是有害,还需要一些其他的研究才能确定。
, 百拇医药
参 考 文 献
1 Moncada S,Palmer R M J,Higgs E A. Nitric Oxide:physiology,pathophysiology,and pharmacology.Pharmacol Rev,1991,43:109-142.
2 Buisson A,Plotkine M,Boulu R G.The neuroprotective effect of a nitric oxide inhibitor in a rat model of focal cerebral ischemia.Brit J Pharmacol,1992,106:766-767.
3 Yamamoto S,Golanon E V,Barger S B,et al.Inhibition of nitric oxide synthesis increases focal ischemic infarction in rat.J cereb Blood FLow Metab,1992,12:717-726.
, http://www.100md.com
4 Guevara-guzman R,Emson P C,Kendrick K M.Modulation of in vivo striatal transmitter release by nitric oxide and cyclic GMP.J Neurochem,1994,62:807-810.
5 Kameyama M,Suzuki J,Shirane R,et al.A new model of bilateral hemispheric ischemia in the rat:three vessel occlusion model.Stroke,1985,16:489-493.
6 Steven A C,Dennis P M.Synthesis of a fluorescent derivatizing reagent,6-aminoguinolys-N-hydroxysuccinimidyl carbamate and its application for the analysis of hyduoysate amion acids via high performance liquid chromatagraphy.Anal Biochem,1993,211:279-287.
, http://www.100md.com
7 Fern R,Waxman S G,Ransom B R,et al.Endogenous GABA attenuates CNS white matter dysfunction follwing anoxia.J Neurosci,1995,15:699-708.
8 Shinji S,Miki K,Megumi S,et al.Effect of Systemic administration of N-Methyl-D-Aspartic acid on extracellular taurine level measured by microdialysis in the hippocampal CAl field and striatum of rats.J Neurochem,1993,61:1698-1704.
9 Zhang J,Benveniste H,Klitzman B, et al.Nitric oxide synthease inhibition and extracellular glutamate concentration after cerebral ischemia/reperfusion.Stroke,1997,26:298-304.
10 Buisson A,Margaill I,callebert J, et al.Mechanisms involved in the neuroprotective activity of a nitric oxide synthase inhibitor during focal cerebral ischemia.J Neurochem,1993,61:690-696.
本研究为国家“八五”攻关课题(85-915-03-07合同)
(收稿:1997-01-08 修回:1997-08-19), 百拇医药