同种异体关节软骨细胞分离体外培养再移植修复关节软骨缺损实验研究
作者:张雪华 于至悌 田小丽 朱争艳 高英堂 高茹
单位:于至悌 田小丽 朱争艳 高英堂 高茹 300170 天津医科大学附属第三中心医院骨科;张雪华 承德市中心医院骨科,067000
关键词:软骨细胞;移植;修复;缺损
中华创伤杂志980607 【摘要】 目的 关节软骨一旦缺损,其修复能力有限。本实验通过移植同种异体兔软骨细胞,修复关节软骨缺损。方法 软骨细胞取自出生后3周雄性新西兰幼兔,体外培养,移植于成年雌性新西兰兔膝关节。股骨内髁缺损区为移植细胞组,左股骨外髁缺损为移植胶原凝胶组,右股骨外缺损为空白对照组。术后所有动物不加外固定任意自由活动,于术后4,8,12周处死,进行肉眼、组织学、透射电镜观察,标本用带有Y染色体的Sex-determing-region-Y(SRY)基因进行杂交。结果 移植软骨细胞组术后股骨内髁缺损区得到修复,而移植胶原凝胶组和空白对照组术后股骨外髁缺损未得到修复。SRY基因性别鉴定也证明了以上结果。结论 关节软骨的缺损及骨性关节炎通过软骨细胞移植方法进行治疗,可再生出新的透明软骨。
, http://www.100md.com
Study on Articular Cartilage Defect Repaired with Homograft of Isolated and Cultured Chondrocytes ZHANG Xue-hua, YU Zhi-ti, TIAN Xiao-li, et al. Dept. of Orthopaedics, Third Affiliated Hospital, Tianjin Medical University, Tianjin 300170
【Abstract】 Aim To study the effect of homograft of isolated and cultured chondrocytes on articular cartilage defect. Methods Chondrocytes were taken from 3 weeks old New Zealand unmature male rabbits. The chondrocytes cultured and preserved in liquid nitrogen (-196℃) were transplanted into the defects of articular cartilage in female rabbits. The defects of either of the knee media femur condyle were planted with chondrocyte collagen and the exteral defects of the left knees were planted with collagen and the lateral defects of the right knees were left empty. After the operation, all the rabbits were set free, that is, without any splintage. The rabbits were killed at 4, 8 and 12 weeks postoperation, and the specimens were disected, macroscope examined histologically, and electronic microscope. The samples were hybridized with probe Y gene. Results The defects of media femur condyle were repaired, but the defects of the exteral femur condyle were not repaired. SRY (sex-determing region Y) gene could prove the result. Conclusion The defects of articular cartilage and arthritis may be repaired through transplantation with chondrocytes.
, http://www.100md.com
【Key words】 Chondrocyte Homograft Repair Defect
关节软骨对关节功能及骨骺生长异常重要。由于软骨组织几乎没有自身修复能力[1],近30年来对关节软骨的疾病和损伤在治疗上存在难以解决的难题,只能采用一些补救的方法。
体外软骨细胞培养至今虽已有70多年历史,但都没有应用到临床,近30年来在培养方法上才取得了很大进展。把软骨细胞从坚韧的软骨中分离出来,能获得大量高纯度的软骨细胞。培养方法的改进使培养的软骨细胞不仅能生长而且能分裂新生软骨细胞,改变了软骨细胞不能分裂的旧观点[2,3]。进入90年代,许多学者采用自体软骨细胞分离体外培养再移植方法,新生出软骨取得成功[4,5]。但自体关节软骨供源所限,仅能小面积移植,与临床需要有一定差距。笔者采用同种异体软骨细胞分离体外培养,扩大供源,修复关节软骨缺损,为临床应用提供依据。
, http://www.100md.com
材料与方法
1.软骨细胞游离与培养:取3周龄的新西兰雄性幼兔,双膝关节退毛,碘酒、酒精消毒,铺手术巾,在膝内侧切口充分暴露膝关节。用手术刀小心削取双侧股骨髁及胫骨平台的软骨,切取厚度约1~2mm,不超过软骨下骨板。取下的软骨片置入有PBS缓冲液的培养皿内。用PBS缓冲液反复冲洗3遍。在超净台内无菌操作,用眼科手术剪刀切取软骨,切成1mm3以下小碎片用于化学解离。再将软骨小碎片移至离心管内,加入0.1%Ⅱ型胶原酶在37℃水浴摇动器上消化5小时。再用200目金属滤网滤过并移至离心管内,加入PBS缓冲液,经1 500r/min离心10分钟,再反复PBS缓冲液冲洗3遍。按照Futto-Jacson方法进行软骨细胞培养,培养瓶内加入含有20%小牛血清(FCS)的1640培养液15ml,放置于37℃5%的CO2培养箱内培养。
2.软骨细胞的消化与冻存:软骨细胞培养5~7天以后在倒置显微镜下观察,见软骨细胞贴壁并长满培养瓶壁,然后用0.25%胰蛋白酶消化软骨细胞,经2 000r/min离心获得高纯度软骨细胞并置于细胞冻存管内,用细胞自动冻存仪冻存于液氮罐内-196℃保存,以备复苏后移植。
, 百拇医药
3.移植前软骨细胞包埋于胶原凝胶内:液氮罐内保存的软骨细胞在移植前快速复苏,并调至106cell/ml,按Wakitani方法进行包埋,使最后胶原浓度为0.315%,细胞数为2×105cell/ml,在4℃条件下保存。
4.软骨细胞的移植:30只新西兰成熟雌性兔,体重1 800~2 500g,氯胺酮静脉麻醉,双侧膝关节脱毛,碘酒、酒精消毒手术区,取双膝关节内侧缘切口,暴露双侧股骨内外髁,再用3.2mm钻头手摇骨钻分别在股骨内外髁负重区钻3mm深,3.2mm直径的圆洞,但不要钻透软骨下骨板,骨洞以不出血为度。股骨内髁骨洞(即软骨缺损区)移植带有雄性幼兔关节软骨细胞的胶原凝胶为细胞组。左膝关节股外髁的软骨缺损处单纯移植胶原凝胶为凝胶组,右膝关节股骨外髁缺损处为空白对照组。术后不给予任何外固定,放回笼内自由活动,饲养条件相同。分别于术后4,8,12周处死,用空心骨组织取出器,取出缺损部位修复的组织作为测试标本。
, 百拇医药 结 果
1.肉眼观察:软骨细胞组:术后4周软骨缺损区基本长平,颜色呈白色,用镊子按压移植部位有阻抗,基本上与周围软骨组织融合。8和12周缺损部位完全填平,颜色和周围正常的透明软骨一致,呈光滑有光泽的白色透明状,按压有阻抗并有弹性,与周围的正常软骨组织完全愈合。
单纯胶原凝胶组:术后4周,外髁软骨损伤部位未填平,色白,按压无阻抗,与周围软骨组织未融合。术后8周和12周,缺损区仍能明显辨认出来,阻抗很小,与周围软骨组织未愈合。
空白对照组:术后4,8,12周,缺损区仍明显可见,呈凹陷状瘢痕。
2.组织学切片观察:软骨细胞移植组:术后4周,修复的组织有软骨细胞陷窝,2~4个软骨细胞聚集一起,周围为异染的基质所包绕,细胞周围的胶原网是均匀的。术后8和12周时,异染的基质更多地分布,修复的组织形态和正常的透明软骨一致,与周围的组织愈合很好,无淋巴细胞和炎细胞浸润
, 百拇医药
(图1)。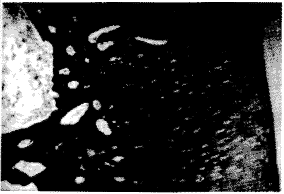
图1 移植软骨细胞术后12周 HE ×100
单纯胶原凝胶组:术后4周缺损区无新生的软骨组织,术后8和12周缺损区为纤维瘢痕充填,呈成纤维细胞形态。
空白对照组:术后4,8,12周,均为纤维组织。
3.电镜观察:透射电镜观察移植组的软骨细胞清晰呈扁平状,核染色质分布均匀,粗面内质网及高尔体扩张,嵴状突起明显,软骨细胞代谢旺盛,软骨细胞的基质呈Ⅱ型胶原,而胶原凝胶和空白对照组电镜观察为纤维细胞,呈条索状,无基质分泌。
4.Sex-determing-region-Y(SRY)基因性别的鉴定:斑点杂交结果证明移植的软骨细胞组在软骨缺损区修复的软骨组织具有SRY基因阳性,表明移植的软骨细胞在异体的软骨缺损区生长和繁殖(图2,3)。
, http://www.100md.com
图2 兔子基因组DNA酶切
图3 软骨细胞移植组SRY基因斑点杂交
讨 论
关节软骨对关节功能所起的作用非常重要,而且软骨组织几乎没有修复能力,关节软骨疾病或损伤难以修复。
1.关于软骨细胞分离培养和移植:从1965年Smith游离哺乳动物软骨细胞成功以后,培养方法经不断的研究和改进逐渐成熟。1968年Chesterman和Smith合作,把游离的成年荷兰兔的关节软骨细胞分别移植于同种动物的髂骨翼松质骨缺损及关节软骨缺损中,其结果软骨细胞虽然有部分成活,其周围有大量的纤维组织,使移植的软骨细胞成为纤维样软骨,又不能与受体关节面真正愈合。1971年和1978年Bentley和Gnner分析Chesterman失败的原因,认为植入的软骨细胞数量不足,以及应用成年动物的关节软骨细胞为供源是失败的原因。改变实验采用幼年动物的软骨细胞为供源,使实验获得成功,移植于关节软骨缺损内的软骨细胞同受体关节软骨完全愈合,结构为透明软骨,完全证明Itay[1]的幼稚细胞具有强繁殖能力的理论。笔者吸取前者成功与失败的教训,在本实验中采用幼兔的软骨细胞,并用胶原凝胶包埋,使软骨细胞固定于缺损处,不易丢失。凝胶为网状结构,又为软骨细胞保持活性分泌基质提供了理想的载体,这是实验成功的重要保证。
, 百拇医药
2.移植的软骨细胞的成活性:30只被移植的雌成年新西兰兔,除2只由于手术失误所致感染、2只软骨细胞凝胶脱落失败外,其他26只软骨细胞移植组均为较好的修复。肉眼观察缺损区为白色透明与正常透明软骨一致的软骨,与周围软骨组织完全愈合。光镜观察其形态学和特异染色证明,细胞具有分泌功能,与周围正常软骨组织结构一致,而单纯胶原凝胶组和空白对照组则呈纤维化。电镜也证明移植的软骨细胞有嵴状突起,周围有分泌的基质和Ⅱ型胶原,符合透明软骨的特点。
3.关于免疫问题:关节软骨无血管侵入,软骨细胞主要靠关节滑液及细胞周围的基质供给营养,有无氧酵解供能的特点。移植后早期有胶原凝胶保护,继而软骨细胞分泌基质中的粘多糖将软骨细胞封闭在陷窝内,保护细胞免受抗体的袭击而生存及繁殖。这也是许多学者认为软骨细胞具有“抗排斥”的功能。Quinn的实验证明,软骨基质中的硫酸软骨素是无抗原性的。笔者通过光镜及电镜未观察到炎细胞及淋巴细胞浸润。植入的软骨细胞能生存繁殖并能分泌基质和胶原,未发现排斥反应。
, http://www.100md.com
4.SRY基因的性别鉴定:软骨缺损区修复的软骨组织是否来源于供源的雄性幼兔的软骨细胞,笔者采用SRY基因性别鉴定证实:雄性幼兔的关节软骨细胞带有SRY基因(睾丸性别决定因子)。通过分子生物学手段,提取移植后修复的软骨细胞的DNA用与(Y-P32)-dCTP标记好的SRY探针进行斑点杂交,结果缺损区的修复软骨组织具有SRY基因阳性,证明移植的雄性幼兔的软骨细胞在受体软骨缺损区能生长繁殖,并有分泌功能。
软骨细胞的移植为关节软骨缺损的修复及骨性关节炎的治疗提供了一种新方法,具有广阔的前景及应用价值。
参考文献
[1]Itay. Use of cultured embroyal chick epiphyseal chondrocytes as grafts for defects in chick articular cartilage. Clin Orthop, 1987, 220∶284-303.
, http://www.100md.com
[2]Makagawa Y. Electron microscopy of calcification during high-density suspension culture of chondrocytes. Calcit Tissue Int, 1993, 53∶127-132.
[3]Flamery CR. Effects of proteinase inhibitors on aggrecan catabolism in chondrocyte cultures. Ann NY Acad Sci, 1994, 732∶382-390.
[4]Britterg M. Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation. New Eng J Med, 1994, 76∶579-592.
[5]Lyoda K. Repair of bone defect with cultured chondrocytes bond to hydroxyapatite. Clin Orthop, 1993, 288∶289-303.
(收稿:1997-09-10 修回:1998-05-29), 百拇医药
单位:于至悌 田小丽 朱争艳 高英堂 高茹 300170 天津医科大学附属第三中心医院骨科;张雪华 承德市中心医院骨科,067000
关键词:软骨细胞;移植;修复;缺损
中华创伤杂志980607 【摘要】 目的 关节软骨一旦缺损,其修复能力有限。本实验通过移植同种异体兔软骨细胞,修复关节软骨缺损。方法 软骨细胞取自出生后3周雄性新西兰幼兔,体外培养,移植于成年雌性新西兰兔膝关节。股骨内髁缺损区为移植细胞组,左股骨外髁缺损为移植胶原凝胶组,右股骨外缺损为空白对照组。术后所有动物不加外固定任意自由活动,于术后4,8,12周处死,进行肉眼、组织学、透射电镜观察,标本用带有Y染色体的Sex-determing-region-Y(SRY)基因进行杂交。结果 移植软骨细胞组术后股骨内髁缺损区得到修复,而移植胶原凝胶组和空白对照组术后股骨外髁缺损未得到修复。SRY基因性别鉴定也证明了以上结果。结论 关节软骨的缺损及骨性关节炎通过软骨细胞移植方法进行治疗,可再生出新的透明软骨。
, http://www.100md.com
Study on Articular Cartilage Defect Repaired with Homograft of Isolated and Cultured Chondrocytes ZHANG Xue-hua, YU Zhi-ti, TIAN Xiao-li, et al. Dept. of Orthopaedics, Third Affiliated Hospital, Tianjin Medical University, Tianjin 300170
【Abstract】 Aim To study the effect of homograft of isolated and cultured chondrocytes on articular cartilage defect. Methods Chondrocytes were taken from 3 weeks old New Zealand unmature male rabbits. The chondrocytes cultured and preserved in liquid nitrogen (-196℃) were transplanted into the defects of articular cartilage in female rabbits. The defects of either of the knee media femur condyle were planted with chondrocyte collagen and the exteral defects of the left knees were planted with collagen and the lateral defects of the right knees were left empty. After the operation, all the rabbits were set free, that is, without any splintage. The rabbits were killed at 4, 8 and 12 weeks postoperation, and the specimens were disected, macroscope examined histologically, and electronic microscope. The samples were hybridized with probe Y gene. Results The defects of media femur condyle were repaired, but the defects of the exteral femur condyle were not repaired. SRY (sex-determing region Y) gene could prove the result. Conclusion The defects of articular cartilage and arthritis may be repaired through transplantation with chondrocytes.
, http://www.100md.com
【Key words】 Chondrocyte Homograft Repair Defect
关节软骨对关节功能及骨骺生长异常重要。由于软骨组织几乎没有自身修复能力[1],近30年来对关节软骨的疾病和损伤在治疗上存在难以解决的难题,只能采用一些补救的方法。
体外软骨细胞培养至今虽已有70多年历史,但都没有应用到临床,近30年来在培养方法上才取得了很大进展。把软骨细胞从坚韧的软骨中分离出来,能获得大量高纯度的软骨细胞。培养方法的改进使培养的软骨细胞不仅能生长而且能分裂新生软骨细胞,改变了软骨细胞不能分裂的旧观点[2,3]。进入90年代,许多学者采用自体软骨细胞分离体外培养再移植方法,新生出软骨取得成功[4,5]。但自体关节软骨供源所限,仅能小面积移植,与临床需要有一定差距。笔者采用同种异体软骨细胞分离体外培养,扩大供源,修复关节软骨缺损,为临床应用提供依据。
, http://www.100md.com
材料与方法
1.软骨细胞游离与培养:取3周龄的新西兰雄性幼兔,双膝关节退毛,碘酒、酒精消毒,铺手术巾,在膝内侧切口充分暴露膝关节。用手术刀小心削取双侧股骨髁及胫骨平台的软骨,切取厚度约1~2mm,不超过软骨下骨板。取下的软骨片置入有PBS缓冲液的培养皿内。用PBS缓冲液反复冲洗3遍。在超净台内无菌操作,用眼科手术剪刀切取软骨,切成1mm3以下小碎片用于化学解离。再将软骨小碎片移至离心管内,加入0.1%Ⅱ型胶原酶在37℃水浴摇动器上消化5小时。再用200目金属滤网滤过并移至离心管内,加入PBS缓冲液,经1 500r/min离心10分钟,再反复PBS缓冲液冲洗3遍。按照Futto-Jacson方法进行软骨细胞培养,培养瓶内加入含有20%小牛血清(FCS)的1640培养液15ml,放置于37℃5%的CO2培养箱内培养。
2.软骨细胞的消化与冻存:软骨细胞培养5~7天以后在倒置显微镜下观察,见软骨细胞贴壁并长满培养瓶壁,然后用0.25%胰蛋白酶消化软骨细胞,经2 000r/min离心获得高纯度软骨细胞并置于细胞冻存管内,用细胞自动冻存仪冻存于液氮罐内-196℃保存,以备复苏后移植。
, 百拇医药
3.移植前软骨细胞包埋于胶原凝胶内:液氮罐内保存的软骨细胞在移植前快速复苏,并调至106cell/ml,按Wakitani方法进行包埋,使最后胶原浓度为0.315%,细胞数为2×105cell/ml,在4℃条件下保存。
4.软骨细胞的移植:30只新西兰成熟雌性兔,体重1 800~2 500g,氯胺酮静脉麻醉,双侧膝关节脱毛,碘酒、酒精消毒手术区,取双膝关节内侧缘切口,暴露双侧股骨内外髁,再用3.2mm钻头手摇骨钻分别在股骨内外髁负重区钻3mm深,3.2mm直径的圆洞,但不要钻透软骨下骨板,骨洞以不出血为度。股骨内髁骨洞(即软骨缺损区)移植带有雄性幼兔关节软骨细胞的胶原凝胶为细胞组。左膝关节股外髁的软骨缺损处单纯移植胶原凝胶为凝胶组,右膝关节股骨外髁缺损处为空白对照组。术后不给予任何外固定,放回笼内自由活动,饲养条件相同。分别于术后4,8,12周处死,用空心骨组织取出器,取出缺损部位修复的组织作为测试标本。
, 百拇医药 结 果
1.肉眼观察:软骨细胞组:术后4周软骨缺损区基本长平,颜色呈白色,用镊子按压移植部位有阻抗,基本上与周围软骨组织融合。8和12周缺损部位完全填平,颜色和周围正常的透明软骨一致,呈光滑有光泽的白色透明状,按压有阻抗并有弹性,与周围的正常软骨组织完全愈合。
单纯胶原凝胶组:术后4周,外髁软骨损伤部位未填平,色白,按压无阻抗,与周围软骨组织未融合。术后8周和12周,缺损区仍能明显辨认出来,阻抗很小,与周围软骨组织未愈合。
空白对照组:术后4,8,12周,缺损区仍明显可见,呈凹陷状瘢痕。
2.组织学切片观察:软骨细胞移植组:术后4周,修复的组织有软骨细胞陷窝,2~4个软骨细胞聚集一起,周围为异染的基质所包绕,细胞周围的胶原网是均匀的。术后8和12周时,异染的基质更多地分布,修复的组织形态和正常的透明软骨一致,与周围的组织愈合很好,无淋巴细胞和炎细胞浸润
, 百拇医药
(图1)。

图1 移植软骨细胞术后12周 HE ×100
单纯胶原凝胶组:术后4周缺损区无新生的软骨组织,术后8和12周缺损区为纤维瘢痕充填,呈成纤维细胞形态。
空白对照组:术后4,8,12周,均为纤维组织。
3.电镜观察:透射电镜观察移植组的软骨细胞清晰呈扁平状,核染色质分布均匀,粗面内质网及高尔体扩张,嵴状突起明显,软骨细胞代谢旺盛,软骨细胞的基质呈Ⅱ型胶原,而胶原凝胶和空白对照组电镜观察为纤维细胞,呈条索状,无基质分泌。
4.Sex-determing-region-Y(SRY)基因性别的鉴定:斑点杂交结果证明移植的软骨细胞组在软骨缺损区修复的软骨组织具有SRY基因阳性,表明移植的软骨细胞在异体的软骨缺损区生长和繁殖(图2,3)。

, http://www.100md.com
图2 兔子基因组DNA酶切

图3 软骨细胞移植组SRY基因斑点杂交
讨 论
关节软骨对关节功能所起的作用非常重要,而且软骨组织几乎没有修复能力,关节软骨疾病或损伤难以修复。
1.关于软骨细胞分离培养和移植:从1965年Smith游离哺乳动物软骨细胞成功以后,培养方法经不断的研究和改进逐渐成熟。1968年Chesterman和Smith合作,把游离的成年荷兰兔的关节软骨细胞分别移植于同种动物的髂骨翼松质骨缺损及关节软骨缺损中,其结果软骨细胞虽然有部分成活,其周围有大量的纤维组织,使移植的软骨细胞成为纤维样软骨,又不能与受体关节面真正愈合。1971年和1978年Bentley和Gnner分析Chesterman失败的原因,认为植入的软骨细胞数量不足,以及应用成年动物的关节软骨细胞为供源是失败的原因。改变实验采用幼年动物的软骨细胞为供源,使实验获得成功,移植于关节软骨缺损内的软骨细胞同受体关节软骨完全愈合,结构为透明软骨,完全证明Itay[1]的幼稚细胞具有强繁殖能力的理论。笔者吸取前者成功与失败的教训,在本实验中采用幼兔的软骨细胞,并用胶原凝胶包埋,使软骨细胞固定于缺损处,不易丢失。凝胶为网状结构,又为软骨细胞保持活性分泌基质提供了理想的载体,这是实验成功的重要保证。
, 百拇医药
2.移植的软骨细胞的成活性:30只被移植的雌成年新西兰兔,除2只由于手术失误所致感染、2只软骨细胞凝胶脱落失败外,其他26只软骨细胞移植组均为较好的修复。肉眼观察缺损区为白色透明与正常透明软骨一致的软骨,与周围软骨组织完全愈合。光镜观察其形态学和特异染色证明,细胞具有分泌功能,与周围正常软骨组织结构一致,而单纯胶原凝胶组和空白对照组则呈纤维化。电镜也证明移植的软骨细胞有嵴状突起,周围有分泌的基质和Ⅱ型胶原,符合透明软骨的特点。
3.关于免疫问题:关节软骨无血管侵入,软骨细胞主要靠关节滑液及细胞周围的基质供给营养,有无氧酵解供能的特点。移植后早期有胶原凝胶保护,继而软骨细胞分泌基质中的粘多糖将软骨细胞封闭在陷窝内,保护细胞免受抗体的袭击而生存及繁殖。这也是许多学者认为软骨细胞具有“抗排斥”的功能。Quinn的实验证明,软骨基质中的硫酸软骨素是无抗原性的。笔者通过光镜及电镜未观察到炎细胞及淋巴细胞浸润。植入的软骨细胞能生存繁殖并能分泌基质和胶原,未发现排斥反应。
, http://www.100md.com
4.SRY基因的性别鉴定:软骨缺损区修复的软骨组织是否来源于供源的雄性幼兔的软骨细胞,笔者采用SRY基因性别鉴定证实:雄性幼兔的关节软骨细胞带有SRY基因(睾丸性别决定因子)。通过分子生物学手段,提取移植后修复的软骨细胞的DNA用与(Y-P32)-dCTP标记好的SRY探针进行斑点杂交,结果缺损区的修复软骨组织具有SRY基因阳性,证明移植的雄性幼兔的软骨细胞在受体软骨缺损区能生长繁殖,并有分泌功能。
软骨细胞的移植为关节软骨缺损的修复及骨性关节炎的治疗提供了一种新方法,具有广阔的前景及应用价值。
参考文献
[1]Itay. Use of cultured embroyal chick epiphyseal chondrocytes as grafts for defects in chick articular cartilage. Clin Orthop, 1987, 220∶284-303.
, http://www.100md.com
[2]Makagawa Y. Electron microscopy of calcification during high-density suspension culture of chondrocytes. Calcit Tissue Int, 1993, 53∶127-132.
[3]Flamery CR. Effects of proteinase inhibitors on aggrecan catabolism in chondrocyte cultures. Ann NY Acad Sci, 1994, 732∶382-390.
[4]Britterg M. Treatment of deep cartilage defects in the knee with autologous chondrocyte transplantation. New Eng J Med, 1994, 76∶579-592.
[5]Lyoda K. Repair of bone defect with cultured chondrocytes bond to hydroxyapatite. Clin Orthop, 1993, 288∶289-303.
(收稿:1997-09-10 修回:1998-05-29), 百拇医药