急性脑缺血大鼠边缘系统谷氨酸及其受体对下丘脑-垂体-肾上腺轴的影响
作者:陈曼娥 何明利 蒋晓江
单位:(400042 重庆,第三军医大学大坪医院野战外科研究所)
关键词:脑缺血;氨基酸;受体;下丘脑-垂体系统
中华医学杂志980728 【摘要】 目的 观察脑缺血/再灌流过程中海马和下丘脑的谷氨酸、谷氨酸受体(GluR)的变化特征及其对下丘脑-垂体-肾上腺轴(HPA)活动的影响。方法 应用高效液相色谱、受体的放射配体结合分析、核酸原位杂交、放射免疫分析分别监测大脑中动脉闭塞大鼠海马和下丘脑的谷氨酸含量、促皮质释放激素(CRH)信使核糖核酸(mRNA)表达水平、血浆促肾上腺皮质激素(ACTH)浓度变化。结果 动脉闭塞15分钟,下丘脑、海马两部位的谷氨酸含量迅速增加,缺血1 小时达高峰,复流后迅速回落至基线水平;再灌流24小时再次中度升高,并持续至48小时后缓慢回降。缺血期海马、下丘脑的GluR下调,再灌流期呈现典型的上向同种特异性正向调节。缺血1小时颞皮质,海马、下丘脑等区CRHmRNA表达明显活跃,并持续至再灌流96小时,血浆ACTH浓度同步升高。再灌流损伤高峰期下丘脑谷氨酸含量与CRHmRNA阳性表达细胞数、血浆ACTH浓度间均呈显著正相关。结论 谷氨酸参与了急性脑缺血特定条件下HPA的异常活动,可能是一个重要的触发因子。
, 百拇医药
Effects of glutamate, glutamate receptor in limbic system and hypothalamus on hypothalamus-pituitary-adrenal axis after rats MCAO Chen Mane He Mingli Jiang Xiaojiang, DaPing hospital,Research Institute of Field Surgery, Third Military Medical University, Chongqing 400042
【Abstract】 Objective To investigate the features of activity changes of glutamate(Glu), glutamate receptors(GluR) in hippocampus and hypothalamus during rats middle cerebral artery occlusion (MCAO) or reperfusion. Methods Using radio-legend binding assay of receptor (RBA),high-performance liquid chromatography (HPLC) and hybridization in situ and radioimmunometric assay, (RIA), we determined the dynamic changes of Glu content,GluR capacity and it′s Kd in cell membrane from the hippocampus of the ischemic brain and the hypothalamus CRHmRNA expression levels in every brain areas and ACTH concentrations in plasma at different time after middle cerebral artery occlusion(MCAO) or reperfusion. Results Glu content rapidly increased in the hippocampus and the hypothalamus at 15 minutes after MCAO, and reached the peak values at I1h, and rapidly decreased to the basic-line level after reperfusion. Glu content IR24h to IR48h, was elevated again moderately , and declined slowly 48 hours after reperfusion. The GluR was down-regulated and the affinity enhanced in during the ischemic period. During the reperfusion period, the GluR was typically up-regulated. The CRHmRNA expressive levels were markedly enhanced in the tempol cortex, the hippocampus and the hypothalamus atI1h,and kept to IR96h,the ACTH concentration in the plasma increased relatively. In the peak time of reperfusion,the Glu content of hypothalamus was positively corrected with CRHmRNA expressive positive cell amounts of the hypothalamus. Conclusion CRH may aggravate ischemic neuronal damage, and Glu participates in the pathogenesis of HPA axis be excited strongly and may be an important impel factor for ACI specially condition.
, 百拇医药
【Key words】 Cerebral ischemia Amino acid Receptor Hypothalamus-pituitary-adrenal axis
(Natl Med J China, 1998, 78:547-550)
急性脑缺血(ACI)时神经元过量释放的谷氨酸(Glu)对缺血神经元损伤起关键作用[1]。下丘脑广泛分布有Glu及其受体(GluR),生理条件下对下丘脑-垂体-肾上腺(HPA)轴等有重要调节作用[2,3],但病理状态特别是急性脑缺血(ACI)特定应激条件下,有关边缘系统、下丘脑Glu、GluR对中枢神经系统应变调控的影响及机制的研究鲜见报道。 为此,作者对不同时相缺血海马和下丘脑的Glu含量,GluR容量及其离解常数(kd)进行了测定,并同步监测了脑内促皮质释放激素(CRH)信使核糖核酸(mRNA)表达水平和血浆促肾上腺皮质激素(ACTH) 的变化,拟探讨ACI边缘系统Glu、GluR对CNS应变调控的影响及机制。
, 百拇医药
材料与方法
一、材料
1.动物分组:Wistar大鼠120只,由本校野战外科研究所动物室提供,雌雄不拘,体重253±38 g。随机分为对照组(40只)和大脑中动脉缺血/再灌流组(简称ACI组,40只)。每组观测8个时相点,分别为缺血前,缺血15、30分钟、1小时,缺血1小时再灌流3、24、48及96小时。每个时相点Glu和GluR检测各用5只大鼠。原位杂交设缺血前、缺血1小时、再灌流24h和再灌流96小时4个时相点(40只)。
2.大鼠MCA缺血/再灌流模型按照Koizumi等[4]的方法复制。
二、方法
1.Glu含量测定:冰盘上切取下丘脑、海马各约60~120 mg,称重后用10%磺基水杨酸钠溶液2ml冰浴匀浆,1 000 g,离心15分钟将上清液定容为2 ml,HPLC分析系统检测,磷苯二甲醛等柱前演生,柱长26 cm,柱温37℃,流动相为30%甲醇/磷酸缓冲液。
, 百拇医药
2.GluR最大结合容量及Kd值测定:参照Meeker等[5]方法进行。谷氨酸标准品为美国Sigma公司产品,3 H-谷氨酸由上海原子核研究所标记。
3.ACTH浓度:采用放射免疫分析(RIA)法检测。ACTH放射免疫检测药盒为美国DPC公司产品。
4.CRHmRNA原位杂交及定量图象分析:动物届时用0.5%戊巴比妥钠(30 mg/kg,皮下注射) 麻醉后,用4℃多聚甲醛150 ml主动脉灌注,取出全脑,置于4%多聚甲醛溶液后固定4~6小时,转入30%蔗糖多聚甲醛脱水过液。经下丘脑中央部行全脑冠状连续冰冻切片(部分为缺血大脑连续矢状切片)10张(厚20 μm)。采用漂洗法原位杂交( CRH-cRNA探针由本校组胚教研室提供)。阴性对照以20 μl/ml RNA酶A(37℃)处理切片30分钟,同法操作。每个阳性杂交部位在100倍光镜下随机选取3 个视野进行定量图象分析,测出单位平方毫米的晶体数,然后运算出每平方毫米脑组织切片的阳性杂交细胞数,再求出3个视野的平均数。
, 百拇医药
三、统计学处理
所有数据均以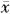 ±s表示。采用Excel 7.0计算机软件进行t检验和相关分析等。
±s表示。采用Excel 7.0计算机软件进行t检验和相关分析等。
结 果
一、Glu含量变化
ACI组于MCAO15分钟,海马和下丘脑Glu含量均显著高于缺血前或对照组(P<0.05),至缺血1小时达高峰。再灌注3小时两部位均下降至基线水平。再灌流24小时再次升高,次峰期出现在再灌注48小时,至96小时缓慢下降至基线水平,见表1,2。
二、GluR最大结合容量及Kd值变化
1.GluR最大结合容量:ACI组海马于缺血后30分钟显著降低(P<0.05),下丘脑于缺血后1小时降低非常显著(P<0.01),见表1,2。
, 百拇医药
表1 对照组和ACI组海马Glu含量及GluR容量变化( ±s) 组别
±s) 组别
鼠数
缺血前
缺血后
再灌流
5min
30 min
1h
3h
24h
48h
, 百拇医药
96h
对照组
40
Glu
8.3±0.9
9.9±3.7
8.2±1.6
8.6±1.0
8.3±2.6
7.9±1.4
8.3±0.7
8.5±2.0
GluR
, 百拇医药
5.6±1.4
4.8±0.8
4.5±1.2
4.3±1.1
5.5±0.7
5.7±1.4
5.8±1.9
5.5±2.1
ACI组
40
Glu
8.3±0.9
, 百拇医药 13.9±2.9*
17.9±3.4***△△△
21.5±2.9***△△△
8.5±1.3
11.6±2.3△
11.0±2.3△*
8.0±1.4
GluR
5.6±1.4
3.8±1.2
, http://www.100md.com
3.0±0.9*△△
2.4±0.7**△△△
5.2±0.8△*
7.5±1.0△
7.5±1.2
5.8±0.8
注:与术前相比△ P<0.05,△△P<0.01,△△△ P<0.001;与对照组相比* P<0.05,**P<0.01,*** P<0.001;Glu单位:mg.g-1GluR单位:pmol*g-1(表2同)表2 对照组和ACI组下丘脑Glu含量及GluR容量变化( ±s)
±s)
, 百拇医药
组别
鼠数
缺血前
缺血后
再灌流
15 min
30 min
1h
3h
24h
48h
96h
对照组
, http://www.100md.com
40
Glu
3.3±0.3
3.5±0.7
4.2±1.0
3.5±1.0
4.4±1.2
3.2±0.5
3.4±0.7
3.2±0.5
GluR
2.2±0.5
, 百拇医药 2.2±0.3
2.1±0.6
1.9±0.2
2.3±0.4
2.2±0.4
2.1±0.5
2.2±0.4
缺血组
40
Glu
3.3±0.3
5.6±1.3*△△
, 百拇医药
10.9±4.5*△△△
14.2±2.6***△△△
3.7±0.1
4.9±0.9**△△
4.2±1.2△*
3.8±0.7
GluR
2.2±0.5
2.0±0.5
1.5±0.5△
, http://www.100md.com
1.0±0.4△△*
2.2±0.2
4.2±0.8△△*
4.5±1.1△△*
2.6±0.6
2.Kd值的变化:ACI组于CMAO30分钟,海马、下丘脑显著低于缺血前及对照组(P<0.05),于缺血后1小时达低谷,再灌流回升至基线水平,再灌流24和48小时再次显著下降,再灌流96小时再次回升到基线水平,说明,GluR的亲和力在缺血和再灌注过程中两次升高。
3.血浆ACTH浓度变化:ACI组于再灌流3小时,血浆ACTH浓度均非常显著高于术前和对照组(P<0.01),于再灌流24小时达高峰,并持续至再灌流96小时以后。
, 百拇医药
4.各脑区CRHmRNA原位杂交的变化:缺血前的正常大鼠颞叶皮层、海马有稀疏分布的阳性信号。下丘脑的阳性杂交信号分布较密。对照组术后1小时各脑区阳性表达显著增强(图1),但术后24小时其表达回降至术前水平。 ACI组于MCAO后1小时及以后各时相,下丘脑、皮质、间脑、缺血大脑基底节区等部位的表达均持续活跃,其表达高峰期位于再灌流24小时(图2),其表达强度高于对照组2倍。
5.相关分析:ACI组缺血后1小时、再灌流24和 96小时,下丘脑CRHmRNA阳性表达细胞数与血浆ACTH浓度呈显著正相关(n=15,r=0.522,P<0.05)。缺血后1小时,下丘脑Glu含量与CRHmRNA表达阳性细胞数呈显著正相关(n=5,r=0.886,P<0.05) ,与血浆ACTH浓度呈非常显著正相关(n=5,r=0.957,P<0.01)。再灌流24和96小时,下丘脑Glu含量与CRHmRNA阳性表达细胞数呈非常显著正相关(n=10,r=0.774,P<0.01),与血浆ACTH浓度呈显著正相关(n=10,r=0.642,P<0.05)。讨 论
, http://www.100md.com
一、边缘系统CRHmRNA表达及其与血浆ACTH的关系
研究发现,CRH除作用于垂体腺外,还可作用于CNS,影响大多数行为、神经内分泌和自主调控系统对应激的反应。然而,应激反应中CRH引起CNS总体应变调控紊乱作用机制目前尚不完全明了。本实验模型,选用敏感反应HPA轴活动状况的脑内CRHmRNA和血浆ACTH水平为指标进行定性定量研究。发现生理条件下,脑内CRHmRNA表达以下丘脑为主,颞叶,海马仅有少量表达,充分显示下丘脑在神经内分泌特别是HPA轴活动中的主导地位,也说明边缘系统与下丘脑有着密切的内在联系和共同的物质基础。对照组术后1 小时各脑区表达增强,术后1小时达高峰,但显著低于ACI组,至25小时回降至基线水平,说明造模手术本身可致脑内应激性CRHmRNA表达增强,但持续时间短,程度较轻。本结果显示,在ACI特定应激条件下,颞皮层、 海马和下丘脑等广泛脑区CRH启动、合成活跃,应激反应强烈持久,边缘系统与HPA轴等总体应变效应有密切的内在联系和自身规律。Shafton等[6]发现在猫的星形神经节有丰富的CRH样免疫活性物,刺激这些神经,使血浆ACTH浓度、心率和血压迅速增加,故认为 CRH是一种神经递质,能通过植物神经调节人的总体反应和激素的分泌。Shimizu等[7]用制动法使大鼠应激,用微透析技术直接监测前额内侧皮质的激素活动,发现脑室内注射CRH后,额皮质去甲肾上腺素水平显著升高,他认为CRH主要通过刺激脑内去甲肾上腺素释放而引起CNS总体应变调控紊乱。ACI中强烈兴奋的HPA轴主要损害脑细胞的糖吸收和糖代谢而引起激素的神经毒性作用[8]。我们认为,ACI 时边缘系统和下丘脑等广泛脑区CRH的大量释放是导致CNS总体应变调控紊乱的关键环节。
, 百拇医药
图1 假手术组大鼠海马CRHmRNA原位杂交阳性表达高峰期呈较密集表达,免疫组织化学染色(图2同) ×200 图2 IR24小时大鼠
海马CRHmRNA原位杂交呈密集表达 ×40
二、Glu、GluR与CRHmRNA和ACTH启动、调控的关系
已证明,Glu在下丘脑大多数核中浓度较高,GluR 也分布在相应核团的神经元突触后膜上,Glu及其受体在调节HPA轴神经内分泌活动中起重要作用[3]。鉴于HPA轴异常兴奋是ACI应激反应的重要标志之一,那么,脑缺血再灌流特定应激条件下,是否Glu、GluR参与了HPA轴的异常活动,机制如何。本研究证实,缺血与再灌流Glu抬高高峰期,下丘脑的Glu含量与其CRHmRNA表达阳性细胞数和血浆ACTH浓度均呈显著正相关,说明海马、下丘脑的Glu与ACI应激性HPA轴异常兴奋有着密切的内在联系。Srivastava等[9]制作大鼠制动应激模型,腹腔注射NMDA和Glu,发现CRH等多种激素释放对Glu刺激的反应异常强烈。Chautard等[10]在新生鼠应激低反应期腹腔注射Glu引起强烈的HPA轴活动。目前有关Glu的作用部位及机制尚未定论,Chartard等认为是Glu作用于下丘脑,直接引起CRH 的释放,而Srivastar等[9]认为是Glu作用于包括海马在内的广泛脑区,间接引起CRH释放。我们认为,在ACI特定应激条件下,缺血缺氧或应激反应引起Glu大量释放,后者可能直接作用于颞叶皮质、海马、下丘脑等广泛脑区,使之大量启动、合成、释放CRH,进而导致HPA轴异常兴奋。因此,Glu可能是引起ACI时HPA轴异常兴奋的一个重要触发因子。
, 百拇医药
参考文献
1 Benveniste H, Jeanette M, Despande J, et al. Ischemic damage in hippocampal CA1 is dependent on glutamate release and intact innovation from CA3. J Cereb Blood Flow. Metab, 1989, 9:629-639.
2 Van Den Pol A, Wourin J, Dudek F. Glutamate the dominant excitatory transmitter in neuro-endocrine regulation. Science, 1990, 250:1276-1278.
3 Boudouresque F, Chautard T, Jezova D, et al. Excitatory amino acids and adeno-pituitary hormone secretion in mammals, with special reference to development. Endocr Regul, 1991, 25:44-52.
, 百拇医药
4 Koizumi J, Yoshida Y, Nakazwa, et al. Experimental studies of ischemic brain edema: 1. A new experimental model of cerebral embolism in cats in which recirculation can be introduced in the ischemic area. Jpn J stroke, 1986, 8:1-8.
5 Meeker RB, Greenwood RS, Hayward JN. Glutamate receptors in the rat hypothalamus and pituitary. Endocrinology, 1994, 134:621-629.
6 Shafton AD, Fernley RT, Mcallen RM. Is CRF a ganglion transmitter or modulator in the cat sudomotor pathway? Brain Res, 1994, 652:129-136.
, http://www.100md.com
7 Shimizu N, Nakane H, Hori T, et al. CRF receptor antagonist attenuates stress-induced noradrenaline release in the medial prefrontal cortex of rats. Brain Res, 1994, 654:145-148.
8 Tombaugh GC, Yang SH., Swanson RA, et al. Glucocorticoids exacerbate hypoxic and hypoglycemic hippocampal injury in vitro; biochemical correlates and a role for astrocybes. J Neurochem, 1992, 59:137-146.
9 Srivastava RK, Akinbami MA, Mann DR. Acute immobilization stress alters LH and ACTH release in response to administration of N-methyl-D. L-aspartic acid in peripubertal and adult male rats. Life Sci, 1995, 56:235-241.
10 Tchautard, F Boudouresque, V Guillaume, et al. Effect of Excitatory Amino Acid on the hypothalamic-pituitary-Adrenal Axis in the Rat during these stress Hypo-responsiveperiod. Nearoendocin, 1993, 57:70-78.
(收稿:1997-08-18 修回:1998-02-13), 百拇医药
单位:(400042 重庆,第三军医大学大坪医院野战外科研究所)
关键词:脑缺血;氨基酸;受体;下丘脑-垂体系统
中华医学杂志980728 【摘要】 目的 观察脑缺血/再灌流过程中海马和下丘脑的谷氨酸、谷氨酸受体(GluR)的变化特征及其对下丘脑-垂体-肾上腺轴(HPA)活动的影响。方法 应用高效液相色谱、受体的放射配体结合分析、核酸原位杂交、放射免疫分析分别监测大脑中动脉闭塞大鼠海马和下丘脑的谷氨酸含量、促皮质释放激素(CRH)信使核糖核酸(mRNA)表达水平、血浆促肾上腺皮质激素(ACTH)浓度变化。结果 动脉闭塞15分钟,下丘脑、海马两部位的谷氨酸含量迅速增加,缺血1 小时达高峰,复流后迅速回落至基线水平;再灌流24小时再次中度升高,并持续至48小时后缓慢回降。缺血期海马、下丘脑的GluR下调,再灌流期呈现典型的上向同种特异性正向调节。缺血1小时颞皮质,海马、下丘脑等区CRHmRNA表达明显活跃,并持续至再灌流96小时,血浆ACTH浓度同步升高。再灌流损伤高峰期下丘脑谷氨酸含量与CRHmRNA阳性表达细胞数、血浆ACTH浓度间均呈显著正相关。结论 谷氨酸参与了急性脑缺血特定条件下HPA的异常活动,可能是一个重要的触发因子。
, 百拇医药
Effects of glutamate, glutamate receptor in limbic system and hypothalamus on hypothalamus-pituitary-adrenal axis after rats MCAO Chen Mane He Mingli Jiang Xiaojiang, DaPing hospital,Research Institute of Field Surgery, Third Military Medical University, Chongqing 400042
【Abstract】 Objective To investigate the features of activity changes of glutamate(Glu), glutamate receptors(GluR) in hippocampus and hypothalamus during rats middle cerebral artery occlusion (MCAO) or reperfusion. Methods Using radio-legend binding assay of receptor (RBA),high-performance liquid chromatography (HPLC) and hybridization in situ and radioimmunometric assay, (RIA), we determined the dynamic changes of Glu content,GluR capacity and it′s Kd in cell membrane from the hippocampus of the ischemic brain and the hypothalamus CRHmRNA expression levels in every brain areas and ACTH concentrations in plasma at different time after middle cerebral artery occlusion(MCAO) or reperfusion. Results Glu content rapidly increased in the hippocampus and the hypothalamus at 15 minutes after MCAO, and reached the peak values at I1h, and rapidly decreased to the basic-line level after reperfusion. Glu content IR24h to IR48h, was elevated again moderately , and declined slowly 48 hours after reperfusion. The GluR was down-regulated and the affinity enhanced in during the ischemic period. During the reperfusion period, the GluR was typically up-regulated. The CRHmRNA expressive levels were markedly enhanced in the tempol cortex, the hippocampus and the hypothalamus atI1h,and kept to IR96h,the ACTH concentration in the plasma increased relatively. In the peak time of reperfusion,the Glu content of hypothalamus was positively corrected with CRHmRNA expressive positive cell amounts of the hypothalamus. Conclusion CRH may aggravate ischemic neuronal damage, and Glu participates in the pathogenesis of HPA axis be excited strongly and may be an important impel factor for ACI specially condition.
, 百拇医药
【Key words】 Cerebral ischemia Amino acid Receptor Hypothalamus-pituitary-adrenal axis
(Natl Med J China, 1998, 78:547-550)
急性脑缺血(ACI)时神经元过量释放的谷氨酸(Glu)对缺血神经元损伤起关键作用[1]。下丘脑广泛分布有Glu及其受体(GluR),生理条件下对下丘脑-垂体-肾上腺(HPA)轴等有重要调节作用[2,3],但病理状态特别是急性脑缺血(ACI)特定应激条件下,有关边缘系统、下丘脑Glu、GluR对中枢神经系统应变调控的影响及机制的研究鲜见报道。 为此,作者对不同时相缺血海马和下丘脑的Glu含量,GluR容量及其离解常数(kd)进行了测定,并同步监测了脑内促皮质释放激素(CRH)信使核糖核酸(mRNA)表达水平和血浆促肾上腺皮质激素(ACTH) 的变化,拟探讨ACI边缘系统Glu、GluR对CNS应变调控的影响及机制。
, 百拇医药
材料与方法
一、材料
1.动物分组:Wistar大鼠120只,由本校野战外科研究所动物室提供,雌雄不拘,体重253±38 g。随机分为对照组(40只)和大脑中动脉缺血/再灌流组(简称ACI组,40只)。每组观测8个时相点,分别为缺血前,缺血15、30分钟、1小时,缺血1小时再灌流3、24、48及96小时。每个时相点Glu和GluR检测各用5只大鼠。原位杂交设缺血前、缺血1小时、再灌流24h和再灌流96小时4个时相点(40只)。
2.大鼠MCA缺血/再灌流模型按照Koizumi等[4]的方法复制。
二、方法
1.Glu含量测定:冰盘上切取下丘脑、海马各约60~120 mg,称重后用10%磺基水杨酸钠溶液2ml冰浴匀浆,1 000 g,离心15分钟将上清液定容为2 ml,HPLC分析系统检测,磷苯二甲醛等柱前演生,柱长26 cm,柱温37℃,流动相为30%甲醇/磷酸缓冲液。
, 百拇医药
2.GluR最大结合容量及Kd值测定:参照Meeker等[5]方法进行。谷氨酸标准品为美国Sigma公司产品,3 H-谷氨酸由上海原子核研究所标记。
3.ACTH浓度:采用放射免疫分析(RIA)法检测。ACTH放射免疫检测药盒为美国DPC公司产品。
4.CRHmRNA原位杂交及定量图象分析:动物届时用0.5%戊巴比妥钠(30 mg/kg,皮下注射) 麻醉后,用4℃多聚甲醛150 ml主动脉灌注,取出全脑,置于4%多聚甲醛溶液后固定4~6小时,转入30%蔗糖多聚甲醛脱水过液。经下丘脑中央部行全脑冠状连续冰冻切片(部分为缺血大脑连续矢状切片)10张(厚20 μm)。采用漂洗法原位杂交( CRH-cRNA探针由本校组胚教研室提供)。阴性对照以20 μl/ml RNA酶A(37℃)处理切片30分钟,同法操作。每个阳性杂交部位在100倍光镜下随机选取3 个视野进行定量图象分析,测出单位平方毫米的晶体数,然后运算出每平方毫米脑组织切片的阳性杂交细胞数,再求出3个视野的平均数。
, 百拇医药
三、统计学处理
所有数据均以
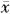 ±s表示。采用Excel 7.0计算机软件进行t检验和相关分析等。
±s表示。采用Excel 7.0计算机软件进行t检验和相关分析等。结 果
一、Glu含量变化
ACI组于MCAO15分钟,海马和下丘脑Glu含量均显著高于缺血前或对照组(P<0.05),至缺血1小时达高峰。再灌注3小时两部位均下降至基线水平。再灌流24小时再次升高,次峰期出现在再灌注48小时,至96小时缓慢下降至基线水平,见表1,2。
二、GluR最大结合容量及Kd值变化
1.GluR最大结合容量:ACI组海马于缺血后30分钟显著降低(P<0.05),下丘脑于缺血后1小时降低非常显著(P<0.01),见表1,2。
, 百拇医药
表1 对照组和ACI组海马Glu含量及GluR容量变化(
 ±s) 组别
±s) 组别鼠数
缺血前
缺血后
再灌流
5min
30 min
1h
3h
24h
48h
, 百拇医药
96h
对照组
40
Glu
8.3±0.9
9.9±3.7
8.2±1.6
8.6±1.0
8.3±2.6
7.9±1.4
8.3±0.7
8.5±2.0
GluR
, 百拇医药
5.6±1.4
4.8±0.8
4.5±1.2
4.3±1.1
5.5±0.7
5.7±1.4
5.8±1.9
5.5±2.1
ACI组
40
Glu
8.3±0.9
, 百拇医药 13.9±2.9*
17.9±3.4***△△△
21.5±2.9***△△△
8.5±1.3
11.6±2.3△
11.0±2.3△*
8.0±1.4
GluR
5.6±1.4
3.8±1.2
, http://www.100md.com
3.0±0.9*△△
2.4±0.7**△△△
5.2±0.8△*
7.5±1.0△
7.5±1.2
5.8±0.8
注:与术前相比△ P<0.05,△△P<0.01,△△△ P<0.001;与对照组相比* P<0.05,**P<0.01,*** P<0.001;Glu单位:mg.g-1GluR单位:pmol*g-1(表2同)表2 对照组和ACI组下丘脑Glu含量及GluR容量变化(
 ±s)
±s), 百拇医药
组别
鼠数
缺血前
缺血后
再灌流
15 min
30 min
1h
3h
24h
48h
96h
对照组
, http://www.100md.com
40
Glu
3.3±0.3
3.5±0.7
4.2±1.0
3.5±1.0
4.4±1.2
3.2±0.5
3.4±0.7
3.2±0.5
GluR
2.2±0.5
, 百拇医药 2.2±0.3
2.1±0.6
1.9±0.2
2.3±0.4
2.2±0.4
2.1±0.5
2.2±0.4
缺血组
40
Glu
3.3±0.3
5.6±1.3*△△
, 百拇医药
10.9±4.5*△△△
14.2±2.6***△△△
3.7±0.1
4.9±0.9**△△
4.2±1.2△*
3.8±0.7
GluR
2.2±0.5
2.0±0.5
1.5±0.5△
, http://www.100md.com
1.0±0.4△△*
2.2±0.2
4.2±0.8△△*
4.5±1.1△△*
2.6±0.6
2.Kd值的变化:ACI组于CMAO30分钟,海马、下丘脑显著低于缺血前及对照组(P<0.05),于缺血后1小时达低谷,再灌流回升至基线水平,再灌流24和48小时再次显著下降,再灌流96小时再次回升到基线水平,说明,GluR的亲和力在缺血和再灌注过程中两次升高。
3.血浆ACTH浓度变化:ACI组于再灌流3小时,血浆ACTH浓度均非常显著高于术前和对照组(P<0.01),于再灌流24小时达高峰,并持续至再灌流96小时以后。
, 百拇医药
4.各脑区CRHmRNA原位杂交的变化:缺血前的正常大鼠颞叶皮层、海马有稀疏分布的阳性信号。下丘脑的阳性杂交信号分布较密。对照组术后1小时各脑区阳性表达显著增强(图1),但术后24小时其表达回降至术前水平。 ACI组于MCAO后1小时及以后各时相,下丘脑、皮质、间脑、缺血大脑基底节区等部位的表达均持续活跃,其表达高峰期位于再灌流24小时(图2),其表达强度高于对照组2倍。
5.相关分析:ACI组缺血后1小时、再灌流24和 96小时,下丘脑CRHmRNA阳性表达细胞数与血浆ACTH浓度呈显著正相关(n=15,r=0.522,P<0.05)。缺血后1小时,下丘脑Glu含量与CRHmRNA表达阳性细胞数呈显著正相关(n=5,r=0.886,P<0.05) ,与血浆ACTH浓度呈非常显著正相关(n=5,r=0.957,P<0.01)。再灌流24和96小时,下丘脑Glu含量与CRHmRNA阳性表达细胞数呈非常显著正相关(n=10,r=0.774,P<0.01),与血浆ACTH浓度呈显著正相关(n=10,r=0.642,P<0.05)。讨 论
, http://www.100md.com
一、边缘系统CRHmRNA表达及其与血浆ACTH的关系
研究发现,CRH除作用于垂体腺外,还可作用于CNS,影响大多数行为、神经内分泌和自主调控系统对应激的反应。然而,应激反应中CRH引起CNS总体应变调控紊乱作用机制目前尚不完全明了。本实验模型,选用敏感反应HPA轴活动状况的脑内CRHmRNA和血浆ACTH水平为指标进行定性定量研究。发现生理条件下,脑内CRHmRNA表达以下丘脑为主,颞叶,海马仅有少量表达,充分显示下丘脑在神经内分泌特别是HPA轴活动中的主导地位,也说明边缘系统与下丘脑有着密切的内在联系和共同的物质基础。对照组术后1 小时各脑区表达增强,术后1小时达高峰,但显著低于ACI组,至25小时回降至基线水平,说明造模手术本身可致脑内应激性CRHmRNA表达增强,但持续时间短,程度较轻。本结果显示,在ACI特定应激条件下,颞皮层、 海马和下丘脑等广泛脑区CRH启动、合成活跃,应激反应强烈持久,边缘系统与HPA轴等总体应变效应有密切的内在联系和自身规律。Shafton等[6]发现在猫的星形神经节有丰富的CRH样免疫活性物,刺激这些神经,使血浆ACTH浓度、心率和血压迅速增加,故认为 CRH是一种神经递质,能通过植物神经调节人的总体反应和激素的分泌。Shimizu等[7]用制动法使大鼠应激,用微透析技术直接监测前额内侧皮质的激素活动,发现脑室内注射CRH后,额皮质去甲肾上腺素水平显著升高,他认为CRH主要通过刺激脑内去甲肾上腺素释放而引起CNS总体应变调控紊乱。ACI中强烈兴奋的HPA轴主要损害脑细胞的糖吸收和糖代谢而引起激素的神经毒性作用[8]。我们认为,ACI 时边缘系统和下丘脑等广泛脑区CRH的大量释放是导致CNS总体应变调控紊乱的关键环节。

, 百拇医药
图1 假手术组大鼠海马CRHmRNA原位杂交阳性表达高峰期呈较密集表达,免疫组织化学染色(图2同) ×200 图2 IR24小时大鼠
海马CRHmRNA原位杂交呈密集表达 ×40
二、Glu、GluR与CRHmRNA和ACTH启动、调控的关系
已证明,Glu在下丘脑大多数核中浓度较高,GluR 也分布在相应核团的神经元突触后膜上,Glu及其受体在调节HPA轴神经内分泌活动中起重要作用[3]。鉴于HPA轴异常兴奋是ACI应激反应的重要标志之一,那么,脑缺血再灌流特定应激条件下,是否Glu、GluR参与了HPA轴的异常活动,机制如何。本研究证实,缺血与再灌流Glu抬高高峰期,下丘脑的Glu含量与其CRHmRNA表达阳性细胞数和血浆ACTH浓度均呈显著正相关,说明海马、下丘脑的Glu与ACI应激性HPA轴异常兴奋有着密切的内在联系。Srivastava等[9]制作大鼠制动应激模型,腹腔注射NMDA和Glu,发现CRH等多种激素释放对Glu刺激的反应异常强烈。Chautard等[10]在新生鼠应激低反应期腹腔注射Glu引起强烈的HPA轴活动。目前有关Glu的作用部位及机制尚未定论,Chartard等认为是Glu作用于下丘脑,直接引起CRH 的释放,而Srivastar等[9]认为是Glu作用于包括海马在内的广泛脑区,间接引起CRH释放。我们认为,在ACI特定应激条件下,缺血缺氧或应激反应引起Glu大量释放,后者可能直接作用于颞叶皮质、海马、下丘脑等广泛脑区,使之大量启动、合成、释放CRH,进而导致HPA轴异常兴奋。因此,Glu可能是引起ACI时HPA轴异常兴奋的一个重要触发因子。
, 百拇医药
参考文献
1 Benveniste H, Jeanette M, Despande J, et al. Ischemic damage in hippocampal CA1 is dependent on glutamate release and intact innovation from CA3. J Cereb Blood Flow. Metab, 1989, 9:629-639.
2 Van Den Pol A, Wourin J, Dudek F. Glutamate the dominant excitatory transmitter in neuro-endocrine regulation. Science, 1990, 250:1276-1278.
3 Boudouresque F, Chautard T, Jezova D, et al. Excitatory amino acids and adeno-pituitary hormone secretion in mammals, with special reference to development. Endocr Regul, 1991, 25:44-52.
, 百拇医药
4 Koizumi J, Yoshida Y, Nakazwa, et al. Experimental studies of ischemic brain edema: 1. A new experimental model of cerebral embolism in cats in which recirculation can be introduced in the ischemic area. Jpn J stroke, 1986, 8:1-8.
5 Meeker RB, Greenwood RS, Hayward JN. Glutamate receptors in the rat hypothalamus and pituitary. Endocrinology, 1994, 134:621-629.
6 Shafton AD, Fernley RT, Mcallen RM. Is CRF a ganglion transmitter or modulator in the cat sudomotor pathway? Brain Res, 1994, 652:129-136.
, http://www.100md.com
7 Shimizu N, Nakane H, Hori T, et al. CRF receptor antagonist attenuates stress-induced noradrenaline release in the medial prefrontal cortex of rats. Brain Res, 1994, 654:145-148.
8 Tombaugh GC, Yang SH., Swanson RA, et al. Glucocorticoids exacerbate hypoxic and hypoglycemic hippocampal injury in vitro; biochemical correlates and a role for astrocybes. J Neurochem, 1992, 59:137-146.
9 Srivastava RK, Akinbami MA, Mann DR. Acute immobilization stress alters LH and ACTH release in response to administration of N-methyl-D. L-aspartic acid in peripubertal and adult male rats. Life Sci, 1995, 56:235-241.
10 Tchautard, F Boudouresque, V Guillaume, et al. Effect of Excitatory Amino Acid on the hypothalamic-pituitary-Adrenal Axis in the Rat during these stress Hypo-responsiveperiod. Nearoendocin, 1993, 57:70-78.
(收稿:1997-08-18 修回:1998-02-13), 百拇医药