多发伤合并休克早期大鼠多脏器细胞凋亡的观察
作者:官健 金大地 金丽娟
单位:510515 广州,第一军医大学南方医院骨科(官健、金大地);病理生理学教研室(金丽娟)
关键词:创伤;休克;细胞凋亡
中华医学杂志/981006 【摘要】 目的 探讨多发伤合并休克早期大鼠多个脏器中细胞凋亡的发生情况及其意义。方法 应用DNA琼脂糖凝胶电泳、光镜和电镜、原位末端标记法(ISEL),并测定DNA片段百分率(ap%),观察细胞凋亡情况。结果 在胸腺、脾、肝、肺和小肠中均检测到凋亡所特有的DNA梯形条带,而心、肾、脑则否。在复苏后6小时,胸腺、脾、肝、肺和小肠的ap%均随创伤程度的加重而升高;在6处创伤合并休克组,复苏后1小时这5个脏器的ap%均已显著升高,3小时升高更为显著,此时脾、肝、肺和小肠已达顶峰,以后逐渐下降,胸腺则于3小时后继续升高,6小时后趋于平稳至24小时。ISEL法发现8个脏器均呈现不同程度的阳性反应。形态学显示,胸腺中凋亡主要发生于皮质,脾脏主要发生于白髓生发中心,肝细胞凋亡主要位于小叶周边部和汇管区,肺脏中包括肺泡上皮细胞、血管内皮细胞和中性粒细胞等多种细胞发生了凋亡,小肠凋亡主要发生于粘膜上皮层和固有层。结论 多发伤合并休克早期大鼠胸腺、脾、肝、肺和小肠中均发生了细胞凋亡,并可能在早期的脏器功能损害和晚期的多器官衰竭中发挥作用。
, http://www.100md.com
Apoptosis in multiple organs of rats in early stage of polytrauma combined with shock
Guan Jian, Jin Da-di, Jin Lijuan. Department of Orthopaedics, NanFang Hospital, First Military Medical University, Guangzhou 510515
【Abstract】 Objective To discuss Apoptosis in multiple organs of rats in early stage of polytrauma combined with shock. Methods DNA agarose gel electrophoresis, in situ end labeling (ISEL), light microscope and electron microscope were used and DNA fragmentation percentage (ap%) was detected. Results The special ladder pattern for apoptosis was seen in thymus, spleen, liver, lung and intestine, but not in heart, kidney and brain. At 6 hours after resuscitation, the ap% of thymus, spleen, liver, lung and intestine increased together with the severity of trauma. In six-site trauma combined with hemorrhagic shock group, the ap% of these five organs increased significantly at 1 hour after resuscitation and most significantly at 3 hours. At this point, the ap% of spleen, liver, lung and intestine reached peak, and declined gradually afterward. But the ap% of thymus continued to increase after 3 hours and kept stable from 6 hours to 24 hours ISEL showed that there were positive responses of different degrees in these eight organs. It was feand Morphologically most apoptotic cells in the thymus were positioned in the cortex, and those in spleen in the growing center of white pulp, and those in liver in the border area of hepatic lobule and portal area, and apoptosis of multiple kinds of cells including alveolar epithelial cells, vasculr endothelial cells and polymorphonuclear neutrophils was induced in lung, and intestinal apoptotic cells laid in the epithelium and lamina propria of mucosa. Conclusion Apoptosis was really induced in thymus, spleen, liver, lung and intestine in early stage of polytrauma combined with shock, which may play a role in early organ injury and late multiple organ failure.
, 百拇医药
【Key words】 Trauma Shock Apoptosis
(Natl Med J China, 1998, 78:741-745)
细胞凋亡作为细胞死亡的基本方式之一,广泛参与多种生理和病理过程。本实验对多发伤合并休克早期大鼠胸腺、脾、肝、肺、小肠、心、肾和脑等多个脏器中细胞凋亡的发生情况进行了系统研究,旨在探讨这种病理性凋亡的发生规律,可能作用及意义。
材料与方法
一、材料
1.实验动物及分组:健康成年SD大鼠,体重200~250 g,雌雄各半,随机分成6组:伤前对照组(A,6只)、假手术组(N,6只)、失血性休克组(S,6只)、2处创伤合并休克组(B,6只)、4处创伤合并休克组(C,6只)、6处创伤合并休克组(D,30只)。D组分5个时间点:复苏后1、3、6、12、24小时各6只。
, 百拇医药
二、方法
1.实验设计:N组只做1%戊巴比妥钠麻醉及颈外静脉、颈总动脉插管,术后拔管及结扎血管。S组麻醉及插管后,自动脉放血至血压降至5.3 kPa~6.6 kPa,维持1小时后自静脉回输所放的血,并加输生理盐水4 ml,拔管。B组在放血前用特制夹钳夹双侧股骨至骨折,余同S组。C组夹双侧股骨+双侧胫腓骨。N、S、B、C组均于复苏后6小时自后腔静脉放血处死。D组夹双侧股骨+双侧胫腓骨+双侧肱骨,在复苏后5个时间点同法处死。
2.DNA片段的提取及电泳[1]:动物处死后,准确称取胸腺0.2 g、脾、肝、肺、小肠粘膜、肾、脑各1.0 g、心0.5 g,分别加入4 ℃预冷之缓冲液(50 mmol/L phosphate, 120 mmol/L NaCl,10 mmol/L依地酸,pH7.4)制成匀浆(胸腺为10%,余为20%,镜下见细胞绝大部分破裂),27 000×g离心20分钟,取上清500 μl,酚法抽提,无水乙醇沉淀,1.8%琼脂糖凝胶电泳,溴乙锭(10 μg/ml)染色,紫外灯下观察,照相。
, http://www.100md.com
3.DNA片段百分率(ap%)的测定[2]:采用二苯胺法分别测定上述离心后上清及沉淀中的DNA含量,计算DNA片段百分率=上清DNA含量/上清+沉淀的DNA含量×100%。
4.形态学检查: 光镜HE染色和透射电镜观察。
5.原位末端标记法(ISEL)[3]:动物处死后,立即切取各脏器一部分固定于4%甲醛溶液中。固定完全后,常规石蜡切片。脱蜡、复水化后,置于2×SSC液(0.3 mol/L NaCl,30 mmol/L枸橼酸钠,pH 7.0)中,80 ℃处理20分钟。再置于0.5%胰蛋白酶(pH 2.0,HCl配)中,37 ℃孵育20分钟。Buffer A(50 mmol/L Tris-Cl,5 mmol/L MgCl2,10 mmol/L β-巯基乙醇,0.005%牛血清白蛋白,pH 7.5)漂洗5分钟。标记液(5 μmol/L dATP,5 μmol/L dCTP,5 μmol/L dGTP,5 μmol/L biotin-dUTP,50U/ml Klenow片段,均购自宝灵曼公司,buffer A配)覆盖,25 ℃孵育2小时。内源酶阻断剂(1份3% H2O2+2份甲醇)覆盖,25 ℃处理30分钟。Avidin-辣根过氧化酶[购自宝灵曼公司,用含1%牛血清白蛋白和0.5% Tween20 的磷酸盐缓冲液(PBS)稀释成1∶100]覆盖,25 ℃孵育30分钟。每次处理后,均用PBS(10mmol/L,pH7.4)漂洗3 次,5分钟/次。DAB-H2O2[0.05%DAB(重氮氨苯),0.01% H2O2]显色5-10分钟。苏木素复染,光镜下观察。
, 百拇医药
6.统计方法:所有数据均以均数±标准差( ±s)表示,复苏后6h各组间(含A组)比较采用方差分析,两两比较采用Student-Newman-Keuls法,D组各时间点间(含A组)比较采用团体t检验,两两比较采用Kruskal-Wallis法。
±s)表示,复苏后6h各组间(含A组)比较采用方差分析,两两比较采用Student-Newman-Keuls法,D组各时间点间(含A组)比较采用团体t检验,两两比较采用Kruskal-Wallis法。
结果
1.DNA片段琼脂糖凝胶电泳:胸腺、脾、肝、肺和小肠均可见明显的梯形条带,且在复苏后6小时各脏器的条带荧光强度随创伤程度的加重而增大;D组复苏后3小时脾、肝、肺和小肠的条带荧光强度最大,以后逐渐减小,而胸腺于3小时后仍继续增大,6小时后趋稳定(图1、2)。心、肾、脑各组均未见梯形条带。所用Marker(M)为λDNA EcoRⅠ/hindⅢ。阴性对照(-)为正常小鼠胸腺细胞基因组DNA,阳性对照(+)为小鼠胸腺细胞经地塞米松(10-5 mol/L)处理24小时后SDS裂解,酚法抽提,无水乙醇沉淀,电泳结果。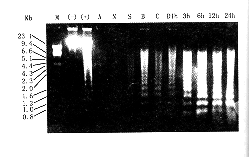
, 百拇医药
图1 各组动物胸腺DNA片段琼脂糖凝胶电泳
图2 各组动物肝脏DNA片段琼脂糖凝胶电泳
表1 复苏后6小时各组动物各脏器ap%的比较(×10-2, ±s) 脏器
±s) 脏器
A
N
S
B
C
D
, http://www.100md.com
胸腺
4.0±0.6
CDE
4.5±0.8
GHI
5.7±0.8
JKL
20±3
CGJMN
30±4
DHKMO
63±6
EILNO
, 百拇医药
脾脏
3.4±0.4
BCDE
4.0±0.9
FGHI
7.0±0.7
BFJKL
11.6±1.6
CGJN
13.8±2.6
DHKO
20±3
EILNO
, 百拇医药
肝脏
1.08±0.25
CDE
1.6±0.4
GHI
2.4±0.4
JKL
6.0±0.7
CGJmN
7.8±0.9
DHKmO
15±3
EILNO
, http://www.100md.com
肺脏
1.2±0.3
BCDE
1.7±0.5
FGHI
6.1±0.8
BFJKL
10.4±1.4
CGJMN
15.2±1.8
DHKMO
22±4
EILNO
, http://www.100md.com
小肠
3.3±0.5
CDE
3.8±0.6
GHI
6.2±0.7
JKL
12.3±2.8
CGJMN
20.2±2.3
DHKMO
37±7
EILNO
, http://www.100md.com
注:两两比较,小写字母:P<0.05,大写字母:P<0.01.任两组之间具有相同字母表示两组比较存在显著性差异表2 D组动物不同时间点各脏器ap%的比较(×10-2, ±s) 脏器
±s) 脏器
A
1h
3h
6h
12h
24h
胸腺
4.0±0.6
aBCDE
, 百拇医药
6.5±0.5
afGHI
43±6
BfJKL
63±6
CGJ
67±6
DHK
68±7
EIL
脾脏
3.4±0.4
ABCD
, 百拇医药
7.8±0.5
AFGI
30±5
BFJKL
20±3
CGJMN
7.4±1.0
DKMO
3.9±0.9
ILNO
肝脏
1.08±0.25
aBCDE
, 百拇医药
1.4±0.4
aFGHI
25±4
BFJKL
15±3
CGJMN
4.8±0.9
DHKMO
2.4±0.5
EILNO
肺脏
1.2±0.3
ABCDE
, 百拇医药
5.3±0.6
AFGHi
31±3
BFJKL
22±4
CGJMN
16.8±2.7
DHKMO
4.4±0.7
EiLNO
小肠
3.3±0.5
ABCDE
, 百拇医药
4.8±0.9
AFGHI
48±5
BFJKL
37±7
CGJMN
28±5
DHKMO
14.9±3.0
EILNO
注:两两比较,小写字母:P<0.05,大写字母:P<0.01.任两组之间具有相同字母表示两组比较存在显著性差异
, http://www.100md.com 2.复苏后6小时各组动物各脏器ap%的比较见表1。
3.D组动物不同时间点各脏器ap%的比较见表2。
4.HE染色光镜检查结果:胸腺中凋亡几乎全部集中于皮质的小淋巴细胞,髓质极少波及,D1小时见凋亡细胞散在分布,表现为核固缩、碎裂,复苏后3、6小时见凋亡细胞和凋亡小体呈灶、片状分布:复苏后12、24小时凋亡分布继续扩大,皮质细胞密度明显减少。脾脏于3小时凋亡细胞和凋亡小体为最多,且主要集中于白髓生发中心(图3)。肝脏D3、6小时见嗜酸性变增多,呈点、片状分布,罕见坏死(图4);12、24小时见肝细胞呈灶状坏死,嗜酸性变减少,坏死灶内及周围大量中性粒细胞浸润。肺脏D3、6小时见肺泡壁增厚,肺泡腔缩小,吞噬细胞、淋巴细胞增生,中性粒细胞浸润,气道旁淋巴组织内大量淋巴细胞凋亡,凋亡小体形成;12、24小时见肺泡壁破坏,吞噬细胞增生活跃,中性粒细胞浸润,肺泡腔内可见游离红细胞、吞噬细胞及中性粒细胞。小肠D3、6小时可见粘膜上皮细胞和固有层淋巴细胞核固缩、碎裂,凋亡的上皮细胞主要位于绒毛底部的腺泡,顶部较少;12、24小时可见粘膜层脱落、小肠绒毛断裂等。肾小管上皮细胞浊肿变性,间质淤血、出血,肾小球囊内红细胞渗出,可见红细胞管型。心肌细胞肿胀变性,心肌纤维可见断裂、排列紊乱。脑白质可见大量胶质细胞核浓染,呈片状分布,神经元改变不明显。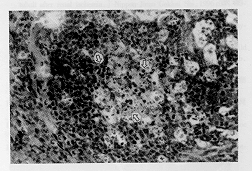
, http://www.100md.com
图3 D3小时脾脏白髓生发中心大量淋巴细胞凋亡,凋亡小体形成( ) HE×20
) HE×20
图4 D3小时肝脏小叶周边部较多肝细胞嗜酸性变,呈核固缩、胞浆浓缩( ) HE×200
) HE×200
5.透射电镜检查结果:胸腺内罕见中性粒细胞的浸润,D1小时可见少量凋亡细胞和凋亡小体,3、6小时可见大量凋亡细胞、凋亡小体的形成及被吞噬(图5);12、24小时见大量凋亡细胞,细胞密度下降,网状内皮增生,少数细胞内质网极度增生,凋亡体的形成和被吞噬。脾脏中亦可见凋亡细胞和凋亡小体及被吞噬现象,以3小时为最多,但仍远较胸腺为少。肝脏1~24小时均可见肝细胞线粒体增殖、肿胀和中性粒细胞的浸润;3、6小时见枯否氏细胞增生活跃,溶酶体大量增殖,并吞噬有凋亡小体;12、24小时见肝细胞破裂,红细胞和中性粒细胞大量游出肝窦外。肺脏D3、6小时见肺泡上皮细胞、血管内皮细胞、中性粒细胞等多种细胞表现为核固缩、胞浆浓缩(图6);小肠中少见中性粒细胞浸润,凋亡主要发生于粘膜上皮细胞和固有层的淋巴细胞和嗜酸粒细胞,凋亡以3小时为最多见。肾中少见凋亡细胞,1、3小时肾小管上皮细胞内线粒体大量增殖,并可见细胞内吞噬有大量红细胞;12、24小时见上皮细胞破裂,大量细胞器游离,但中性粒细胞的浸润并不多见。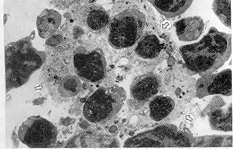
, 百拇医药
图5 D6小时胸腺大量凋亡细胞和凋亡小体被吞噬( ) EM×3 000
) EM×3 000 
图6 D3小时肺泡上皮细胞( )、血管内皮细胞(
)、血管内皮细胞( )和中性粒细胞(↑)凋亡 EM×3 000
)和中性粒细胞(↑)凋亡 EM×3 000 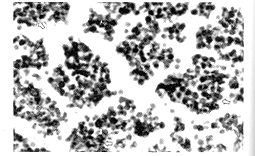
图7 D3胸腺皮质阳性染色淋巴细胞( ) ISEL×400
) ISEL×400
, 百拇医药
图8 D3小时肾脏阳性染色肾小管上皮细胞(左)脑白质阳性染色胶质细胞(右)( )ISEL×400
)ISEL×400
6.ISEL法结果:胸腺皮质淋巴细胞(图7)、脾白髓生发中心、肝小叶周边部及汇管区、肺泡壁、小肠粘膜上皮层及固有层、心肌细胞,肾小管上皮细胞和脑白质胶质细胞(图8)均呈现不同程度的阳性染色,阳性细胞呈棕黄色,阴性细胞呈蓝色。
讨论
多发伤合并休克是外科常见危重病,是多器官衰竭(MOF)的重要病因之一。传统观点认为,在严重创伤和休克等急性损伤下,机体组织、细胞因缺血、缺氧及继发性损害常发生坏死,但近年亦相继有凋亡的报道。Bohlinger等[4]采用内毒素在大鼠肝、肾、小肠、淋巴器官中诱导了细胞凋亡。肝脏[5]、肾脏[6]、心肌[7]、大脑[8]在缺血-再灌流损伤后均可检测到细胞凋亡。邓恭华等[9]采用小鼠烧伤模型、陆江洋等[10]采用大鼠腹腔注射酵母多糖复制的多器官衰竭模型中,也发现了胸腺皮质淋巴细胞的大量凋亡。这说明,在创伤情况下,细胞凋亡在机体中也是普遍发生的一种现象。
, 百拇医药
本研究发现,多发伤合并休克大鼠复苏后24小时内胸腺、脾、肝、肺、小肠、心、肾和脑等8个脏器中,胸腺、脾、肝、肺和小肠中DNA片段琼脂糖凝胶电泳检测到凋亡所特有的梯形条带,而心、肾、脑则否。表1,表2显示,DNA片段百分率测定结果与电泳的结果基本一致。ISEL法是比电泳更为敏感的分子生物学方法,但它并非凋亡细胞所特有,故特异性较差。本实验中,除胸腺等5个脏器外,心、肾、脑亦呈现出不同程度的阳性染色,但电泳并未发现梯形条带。同时,电泳梯形条带虽可判断细胞凋亡,但并非必要条件,故据此结果尚不能断定心、肾、脑中有无凋亡的发生。形态学结果显示,多发伤合并休克后,凋亡、坏死和炎症可同时发生,但在不同脏器和不同时间点表现不同:胸腺、脾脏以凋亡为主,坏死、炎症极轻。肝脏3、6小时以凋亡为主,炎症较轻,12、24小时以变性、坏死为主,炎症较重。肺脏各时间点均有中性粒细胞的浸润和巨噬细胞的增生,3、6小时以凋亡为主,12、24小时以坏死为主,肺泡壁损伤重。小肠早期以凋亡为主,后期坏死和凋亡并存,少见中性粒细胞浸润,而嗜酸粒细胞明显增多。肾则以变性、坏死、出血为主,少见凋亡,中性粒细胞浸润亦不多见。
, http://www.100md.com
本研究结果说明,在多发伤合并休克的情况下,机体内各脏器中普遍发生了细胞凋亡,而且这种凋亡发生得很早(复苏后3小时内),而坏死主要发生在后期。其中,淋巴组织和器官最易发生细胞凋亡,包括胸腺、脾脏、小肠和肺中的淋巴组织等,这可能是导致创伤后免疫功能低下的直接原因。创伤后早期肠内生菌移位,为此人们把小肠作为内源性感染的主要原因和MOF的启动器官;而在本实验中,发现小肠粘膜上皮细胞、固有层的淋巴细胞和嗜酸粒细胞均发生了凋亡,这些都将直接损害肠屏障功能,可能是肠内生菌移位的重要机制之一。另外,在肝和肺中还观察到了中性粒细胞和巨噬细胞的大量增殖和浸润,我们认为,这可能是机体在创伤后免疫抑制的情况下的一种代偿性反应,它造成的结果是:一方面,巨噬细胞被激活后产生大量细胞因子,发挥局部和全身的各种效应,使炎症扩大;另一方面,凋亡的中性粒细胞不能被及时的清除而发生迟发性坏死[11],并导致炎症的扩大,这可能是创伤后炎症失控的原因之一[12]。
同时,创伤后细胞的主动死亡可能对机体具有保护性意义。首先,创伤使机体内反应差、受损后不能恢复的细胞发生凋亡而起到汰劣作用;其次,机体内过度增生的细胞如炎症细胞尽快发生凋亡而恢复到正常状态,有利于炎症的消散;另外,凋亡细胞不发生破裂,被吞噬细胞吞噬后不引起炎症反应,故可有效地限制炎症,保护机体。当然,当严重创伤时,细胞内外环境发生极度紊乱,细胞凋亡出现严重异常,如凋亡过快或延迟、比例过大、清除障碍等,都可能造成各脏器的继发性损害,导致多器官功能衰竭
, 百拇医药
参考文献
1 Leist M,Gantner F,Bohlinger I,et al. Murine hepatocyte apoptosis induced in vitro and in vivo by TNF-α requires transcriptional arrest. J Immunol, 1994,153:1778-1788.
2 Burton K. A study of the conditions and mechanism of the diphenylamine reaction for the colorimetric estimation of deoxyribonucleic acid. Biochem J, 1956,62:315-321.
3 Wijsman JH, Jonker RR, Keijzer R,et al. A new method to detect apoptosis in paraffin sections: in situ end-labeling of fragmented DNA. J Histochem Cytochem, 1993,41:7-12.
, 百拇医药
4 Bohlinger I, Leist M, Gantner F,et al. DNA fragmentation in mouse organs during endotoxic shock. Am J Pathol, 1996, 149:1381-1393.
5 Sasaki H, Matsuno T,Tanaka N, et al. Activation of apoptosis during the reperfusion phase after rat liver ischemia. Transplantation Proceedings, 1996,28:1908-1909.
6 Takeda T. [A pathomorphological study on damage and repair process of tubuli after renal ischemia.] Nippon Jinzo Gakkai Shi,1996,38:493-501.
, 百拇医药
7 Fliss H, Gattinger D. Apoptosis in ischemia and reperfused rat myocardium. Cir Res, 1996, 79:949.
8 Du C, Hu R, Csernansky CA, et al. Very delayed infarction after mild focal cerebral ischemia: a role of apoptosis? J Cereb Blood Flow Metab,1996,16:195-201.
9 邓恭华,王殿华,皮业庆, 等.烧伤对胸腺细胞凋亡的影响.湖南医科大学学报, 1996,21:95-99.
10 陆江洋,梁延杰,王晓虹,等.多器官衰竭早期免疫器官细胞凋亡的检测及意义.解放军医学杂志,1996,21:414-416.
11 Squier MKT, Sehnert AJ, Coher JJ. Apoptosis in leukocytes. J Leukoc Biol, 1995, 57:2-10.
12 Goris RJA. MODS/SIRS: result of an overwhelming inflammatory response? World J Surg,1996,20:418-421.
(收稿:1997-09-23 修回:1998-06-04), 百拇医药
单位:510515 广州,第一军医大学南方医院骨科(官健、金大地);病理生理学教研室(金丽娟)
关键词:创伤;休克;细胞凋亡
中华医学杂志/981006 【摘要】 目的 探讨多发伤合并休克早期大鼠多个脏器中细胞凋亡的发生情况及其意义。方法 应用DNA琼脂糖凝胶电泳、光镜和电镜、原位末端标记法(ISEL),并测定DNA片段百分率(ap%),观察细胞凋亡情况。结果 在胸腺、脾、肝、肺和小肠中均检测到凋亡所特有的DNA梯形条带,而心、肾、脑则否。在复苏后6小时,胸腺、脾、肝、肺和小肠的ap%均随创伤程度的加重而升高;在6处创伤合并休克组,复苏后1小时这5个脏器的ap%均已显著升高,3小时升高更为显著,此时脾、肝、肺和小肠已达顶峰,以后逐渐下降,胸腺则于3小时后继续升高,6小时后趋于平稳至24小时。ISEL法发现8个脏器均呈现不同程度的阳性反应。形态学显示,胸腺中凋亡主要发生于皮质,脾脏主要发生于白髓生发中心,肝细胞凋亡主要位于小叶周边部和汇管区,肺脏中包括肺泡上皮细胞、血管内皮细胞和中性粒细胞等多种细胞发生了凋亡,小肠凋亡主要发生于粘膜上皮层和固有层。结论 多发伤合并休克早期大鼠胸腺、脾、肝、肺和小肠中均发生了细胞凋亡,并可能在早期的脏器功能损害和晚期的多器官衰竭中发挥作用。
, http://www.100md.com
Apoptosis in multiple organs of rats in early stage of polytrauma combined with shock
Guan Jian, Jin Da-di, Jin Lijuan. Department of Orthopaedics, NanFang Hospital, First Military Medical University, Guangzhou 510515
【Abstract】 Objective To discuss Apoptosis in multiple organs of rats in early stage of polytrauma combined with shock. Methods DNA agarose gel electrophoresis, in situ end labeling (ISEL), light microscope and electron microscope were used and DNA fragmentation percentage (ap%) was detected. Results The special ladder pattern for apoptosis was seen in thymus, spleen, liver, lung and intestine, but not in heart, kidney and brain. At 6 hours after resuscitation, the ap% of thymus, spleen, liver, lung and intestine increased together with the severity of trauma. In six-site trauma combined with hemorrhagic shock group, the ap% of these five organs increased significantly at 1 hour after resuscitation and most significantly at 3 hours. At this point, the ap% of spleen, liver, lung and intestine reached peak, and declined gradually afterward. But the ap% of thymus continued to increase after 3 hours and kept stable from 6 hours to 24 hours ISEL showed that there were positive responses of different degrees in these eight organs. It was feand Morphologically most apoptotic cells in the thymus were positioned in the cortex, and those in spleen in the growing center of white pulp, and those in liver in the border area of hepatic lobule and portal area, and apoptosis of multiple kinds of cells including alveolar epithelial cells, vasculr endothelial cells and polymorphonuclear neutrophils was induced in lung, and intestinal apoptotic cells laid in the epithelium and lamina propria of mucosa. Conclusion Apoptosis was really induced in thymus, spleen, liver, lung and intestine in early stage of polytrauma combined with shock, which may play a role in early organ injury and late multiple organ failure.
, 百拇医药
【Key words】 Trauma Shock Apoptosis
(Natl Med J China, 1998, 78:741-745)
细胞凋亡作为细胞死亡的基本方式之一,广泛参与多种生理和病理过程。本实验对多发伤合并休克早期大鼠胸腺、脾、肝、肺、小肠、心、肾和脑等多个脏器中细胞凋亡的发生情况进行了系统研究,旨在探讨这种病理性凋亡的发生规律,可能作用及意义。
材料与方法
一、材料
1.实验动物及分组:健康成年SD大鼠,体重200~250 g,雌雄各半,随机分成6组:伤前对照组(A,6只)、假手术组(N,6只)、失血性休克组(S,6只)、2处创伤合并休克组(B,6只)、4处创伤合并休克组(C,6只)、6处创伤合并休克组(D,30只)。D组分5个时间点:复苏后1、3、6、12、24小时各6只。
, 百拇医药
二、方法
1.实验设计:N组只做1%戊巴比妥钠麻醉及颈外静脉、颈总动脉插管,术后拔管及结扎血管。S组麻醉及插管后,自动脉放血至血压降至5.3 kPa~6.6 kPa,维持1小时后自静脉回输所放的血,并加输生理盐水4 ml,拔管。B组在放血前用特制夹钳夹双侧股骨至骨折,余同S组。C组夹双侧股骨+双侧胫腓骨。N、S、B、C组均于复苏后6小时自后腔静脉放血处死。D组夹双侧股骨+双侧胫腓骨+双侧肱骨,在复苏后5个时间点同法处死。
2.DNA片段的提取及电泳[1]:动物处死后,准确称取胸腺0.2 g、脾、肝、肺、小肠粘膜、肾、脑各1.0 g、心0.5 g,分别加入4 ℃预冷之缓冲液(50 mmol/L phosphate, 120 mmol/L NaCl,10 mmol/L依地酸,pH7.4)制成匀浆(胸腺为10%,余为20%,镜下见细胞绝大部分破裂),27 000×g离心20分钟,取上清500 μl,酚法抽提,无水乙醇沉淀,1.8%琼脂糖凝胶电泳,溴乙锭(10 μg/ml)染色,紫外灯下观察,照相。
, http://www.100md.com
3.DNA片段百分率(ap%)的测定[2]:采用二苯胺法分别测定上述离心后上清及沉淀中的DNA含量,计算DNA片段百分率=上清DNA含量/上清+沉淀的DNA含量×100%。
4.形态学检查: 光镜HE染色和透射电镜观察。
5.原位末端标记法(ISEL)[3]:动物处死后,立即切取各脏器一部分固定于4%甲醛溶液中。固定完全后,常规石蜡切片。脱蜡、复水化后,置于2×SSC液(0.3 mol/L NaCl,30 mmol/L枸橼酸钠,pH 7.0)中,80 ℃处理20分钟。再置于0.5%胰蛋白酶(pH 2.0,HCl配)中,37 ℃孵育20分钟。Buffer A(50 mmol/L Tris-Cl,5 mmol/L MgCl2,10 mmol/L β-巯基乙醇,0.005%牛血清白蛋白,pH 7.5)漂洗5分钟。标记液(5 μmol/L dATP,5 μmol/L dCTP,5 μmol/L dGTP,5 μmol/L biotin-dUTP,50U/ml Klenow片段,均购自宝灵曼公司,buffer A配)覆盖,25 ℃孵育2小时。内源酶阻断剂(1份3% H2O2+2份甲醇)覆盖,25 ℃处理30分钟。Avidin-辣根过氧化酶[购自宝灵曼公司,用含1%牛血清白蛋白和0.5% Tween20 的磷酸盐缓冲液(PBS)稀释成1∶100]覆盖,25 ℃孵育30分钟。每次处理后,均用PBS(10mmol/L,pH7.4)漂洗3 次,5分钟/次。DAB-H2O2[0.05%DAB(重氮氨苯),0.01% H2O2]显色5-10分钟。苏木素复染,光镜下观察。
, 百拇医药
6.统计方法:所有数据均以均数±标准差(
 ±s)表示,复苏后6h各组间(含A组)比较采用方差分析,两两比较采用Student-Newman-Keuls法,D组各时间点间(含A组)比较采用团体t检验,两两比较采用Kruskal-Wallis法。
±s)表示,复苏后6h各组间(含A组)比较采用方差分析,两两比较采用Student-Newman-Keuls法,D组各时间点间(含A组)比较采用团体t检验,两两比较采用Kruskal-Wallis法。结果
1.DNA片段琼脂糖凝胶电泳:胸腺、脾、肝、肺和小肠均可见明显的梯形条带,且在复苏后6小时各脏器的条带荧光强度随创伤程度的加重而增大;D组复苏后3小时脾、肝、肺和小肠的条带荧光强度最大,以后逐渐减小,而胸腺于3小时后仍继续增大,6小时后趋稳定(图1、2)。心、肾、脑各组均未见梯形条带。所用Marker(M)为λDNA EcoRⅠ/hindⅢ。阴性对照(-)为正常小鼠胸腺细胞基因组DNA,阳性对照(+)为小鼠胸腺细胞经地塞米松(10-5 mol/L)处理24小时后SDS裂解,酚法抽提,无水乙醇沉淀,电泳结果。

, 百拇医药
图1 各组动物胸腺DNA片段琼脂糖凝胶电泳

图2 各组动物肝脏DNA片段琼脂糖凝胶电泳
表1 复苏后6小时各组动物各脏器ap%的比较(×10-2,
 ±s) 脏器
±s) 脏器A
N
S
B
C
D
, http://www.100md.com
胸腺
4.0±0.6
CDE
4.5±0.8
GHI
5.7±0.8
JKL
20±3
CGJMN
30±4
DHKMO
63±6
EILNO
, 百拇医药
脾脏
3.4±0.4
BCDE
4.0±0.9
FGHI
7.0±0.7
BFJKL
11.6±1.6
CGJN
13.8±2.6
DHKO
20±3
EILNO
, 百拇医药
肝脏
1.08±0.25
CDE
1.6±0.4
GHI
2.4±0.4
JKL
6.0±0.7
CGJmN
7.8±0.9
DHKmO
15±3
EILNO
, http://www.100md.com
肺脏
1.2±0.3
BCDE
1.7±0.5
FGHI
6.1±0.8
BFJKL
10.4±1.4
CGJMN
15.2±1.8
DHKMO
22±4
EILNO
, http://www.100md.com
小肠
3.3±0.5
CDE
3.8±0.6
GHI
6.2±0.7
JKL
12.3±2.8
CGJMN
20.2±2.3
DHKMO
37±7
EILNO
, http://www.100md.com
注:两两比较,小写字母:P<0.05,大写字母:P<0.01.任两组之间具有相同字母表示两组比较存在显著性差异表2 D组动物不同时间点各脏器ap%的比较(×10-2,
 ±s) 脏器
±s) 脏器A
1h
3h
6h
12h
24h
胸腺
4.0±0.6
aBCDE
, 百拇医药
6.5±0.5
afGHI
43±6
BfJKL
63±6
CGJ
67±6
DHK
68±7
EIL
脾脏
3.4±0.4
ABCD
, 百拇医药
7.8±0.5
AFGI
30±5
BFJKL
20±3
CGJMN
7.4±1.0
DKMO
3.9±0.9
ILNO
肝脏
1.08±0.25
aBCDE
, 百拇医药
1.4±0.4
aFGHI
25±4
BFJKL
15±3
CGJMN
4.8±0.9
DHKMO
2.4±0.5
EILNO
肺脏
1.2±0.3
ABCDE
, 百拇医药
5.3±0.6
AFGHi
31±3
BFJKL
22±4
CGJMN
16.8±2.7
DHKMO
4.4±0.7
EiLNO
小肠
3.3±0.5
ABCDE
, 百拇医药
4.8±0.9
AFGHI
48±5
BFJKL
37±7
CGJMN
28±5
DHKMO
14.9±3.0
EILNO
注:两两比较,小写字母:P<0.05,大写字母:P<0.01.任两组之间具有相同字母表示两组比较存在显著性差异
, http://www.100md.com 2.复苏后6小时各组动物各脏器ap%的比较见表1。
3.D组动物不同时间点各脏器ap%的比较见表2。
4.HE染色光镜检查结果:胸腺中凋亡几乎全部集中于皮质的小淋巴细胞,髓质极少波及,D1小时见凋亡细胞散在分布,表现为核固缩、碎裂,复苏后3、6小时见凋亡细胞和凋亡小体呈灶、片状分布:复苏后12、24小时凋亡分布继续扩大,皮质细胞密度明显减少。脾脏于3小时凋亡细胞和凋亡小体为最多,且主要集中于白髓生发中心(图3)。肝脏D3、6小时见嗜酸性变增多,呈点、片状分布,罕见坏死(图4);12、24小时见肝细胞呈灶状坏死,嗜酸性变减少,坏死灶内及周围大量中性粒细胞浸润。肺脏D3、6小时见肺泡壁增厚,肺泡腔缩小,吞噬细胞、淋巴细胞增生,中性粒细胞浸润,气道旁淋巴组织内大量淋巴细胞凋亡,凋亡小体形成;12、24小时见肺泡壁破坏,吞噬细胞增生活跃,中性粒细胞浸润,肺泡腔内可见游离红细胞、吞噬细胞及中性粒细胞。小肠D3、6小时可见粘膜上皮细胞和固有层淋巴细胞核固缩、碎裂,凋亡的上皮细胞主要位于绒毛底部的腺泡,顶部较少;12、24小时可见粘膜层脱落、小肠绒毛断裂等。肾小管上皮细胞浊肿变性,间质淤血、出血,肾小球囊内红细胞渗出,可见红细胞管型。心肌细胞肿胀变性,心肌纤维可见断裂、排列紊乱。脑白质可见大量胶质细胞核浓染,呈片状分布,神经元改变不明显。

, http://www.100md.com
图3 D3小时脾脏白髓生发中心大量淋巴细胞凋亡,凋亡小体形成(
 ) HE×20
) HE×20
图4 D3小时肝脏小叶周边部较多肝细胞嗜酸性变,呈核固缩、胞浆浓缩(
 ) HE×200
) HE×2005.透射电镜检查结果:胸腺内罕见中性粒细胞的浸润,D1小时可见少量凋亡细胞和凋亡小体,3、6小时可见大量凋亡细胞、凋亡小体的形成及被吞噬(图5);12、24小时见大量凋亡细胞,细胞密度下降,网状内皮增生,少数细胞内质网极度增生,凋亡体的形成和被吞噬。脾脏中亦可见凋亡细胞和凋亡小体及被吞噬现象,以3小时为最多,但仍远较胸腺为少。肝脏1~24小时均可见肝细胞线粒体增殖、肿胀和中性粒细胞的浸润;3、6小时见枯否氏细胞增生活跃,溶酶体大量增殖,并吞噬有凋亡小体;12、24小时见肝细胞破裂,红细胞和中性粒细胞大量游出肝窦外。肺脏D3、6小时见肺泡上皮细胞、血管内皮细胞、中性粒细胞等多种细胞表现为核固缩、胞浆浓缩(图6);小肠中少见中性粒细胞浸润,凋亡主要发生于粘膜上皮细胞和固有层的淋巴细胞和嗜酸粒细胞,凋亡以3小时为最多见。肾中少见凋亡细胞,1、3小时肾小管上皮细胞内线粒体大量增殖,并可见细胞内吞噬有大量红细胞;12、24小时见上皮细胞破裂,大量细胞器游离,但中性粒细胞的浸润并不多见。

, 百拇医药
图5 D6小时胸腺大量凋亡细胞和凋亡小体被吞噬(
 ) EM×3 000
) EM×3 000 
图6 D3小时肺泡上皮细胞(
 )、血管内皮细胞(
)、血管内皮细胞( )和中性粒细胞(↑)凋亡 EM×3 000
)和中性粒细胞(↑)凋亡 EM×3 000 
图7 D3胸腺皮质阳性染色淋巴细胞(
 ) ISEL×400
) ISEL×400
, 百拇医药
图8 D3小时肾脏阳性染色肾小管上皮细胞(左)脑白质阳性染色胶质细胞(右)(
 )ISEL×400
)ISEL×4006.ISEL法结果:胸腺皮质淋巴细胞(图7)、脾白髓生发中心、肝小叶周边部及汇管区、肺泡壁、小肠粘膜上皮层及固有层、心肌细胞,肾小管上皮细胞和脑白质胶质细胞(图8)均呈现不同程度的阳性染色,阳性细胞呈棕黄色,阴性细胞呈蓝色。
讨论
多发伤合并休克是外科常见危重病,是多器官衰竭(MOF)的重要病因之一。传统观点认为,在严重创伤和休克等急性损伤下,机体组织、细胞因缺血、缺氧及继发性损害常发生坏死,但近年亦相继有凋亡的报道。Bohlinger等[4]采用内毒素在大鼠肝、肾、小肠、淋巴器官中诱导了细胞凋亡。肝脏[5]、肾脏[6]、心肌[7]、大脑[8]在缺血-再灌流损伤后均可检测到细胞凋亡。邓恭华等[9]采用小鼠烧伤模型、陆江洋等[10]采用大鼠腹腔注射酵母多糖复制的多器官衰竭模型中,也发现了胸腺皮质淋巴细胞的大量凋亡。这说明,在创伤情况下,细胞凋亡在机体中也是普遍发生的一种现象。
, 百拇医药
本研究发现,多发伤合并休克大鼠复苏后24小时内胸腺、脾、肝、肺、小肠、心、肾和脑等8个脏器中,胸腺、脾、肝、肺和小肠中DNA片段琼脂糖凝胶电泳检测到凋亡所特有的梯形条带,而心、肾、脑则否。表1,表2显示,DNA片段百分率测定结果与电泳的结果基本一致。ISEL法是比电泳更为敏感的分子生物学方法,但它并非凋亡细胞所特有,故特异性较差。本实验中,除胸腺等5个脏器外,心、肾、脑亦呈现出不同程度的阳性染色,但电泳并未发现梯形条带。同时,电泳梯形条带虽可判断细胞凋亡,但并非必要条件,故据此结果尚不能断定心、肾、脑中有无凋亡的发生。形态学结果显示,多发伤合并休克后,凋亡、坏死和炎症可同时发生,但在不同脏器和不同时间点表现不同:胸腺、脾脏以凋亡为主,坏死、炎症极轻。肝脏3、6小时以凋亡为主,炎症较轻,12、24小时以变性、坏死为主,炎症较重。肺脏各时间点均有中性粒细胞的浸润和巨噬细胞的增生,3、6小时以凋亡为主,12、24小时以坏死为主,肺泡壁损伤重。小肠早期以凋亡为主,后期坏死和凋亡并存,少见中性粒细胞浸润,而嗜酸粒细胞明显增多。肾则以变性、坏死、出血为主,少见凋亡,中性粒细胞浸润亦不多见。
, http://www.100md.com
本研究结果说明,在多发伤合并休克的情况下,机体内各脏器中普遍发生了细胞凋亡,而且这种凋亡发生得很早(复苏后3小时内),而坏死主要发生在后期。其中,淋巴组织和器官最易发生细胞凋亡,包括胸腺、脾脏、小肠和肺中的淋巴组织等,这可能是导致创伤后免疫功能低下的直接原因。创伤后早期肠内生菌移位,为此人们把小肠作为内源性感染的主要原因和MOF的启动器官;而在本实验中,发现小肠粘膜上皮细胞、固有层的淋巴细胞和嗜酸粒细胞均发生了凋亡,这些都将直接损害肠屏障功能,可能是肠内生菌移位的重要机制之一。另外,在肝和肺中还观察到了中性粒细胞和巨噬细胞的大量增殖和浸润,我们认为,这可能是机体在创伤后免疫抑制的情况下的一种代偿性反应,它造成的结果是:一方面,巨噬细胞被激活后产生大量细胞因子,发挥局部和全身的各种效应,使炎症扩大;另一方面,凋亡的中性粒细胞不能被及时的清除而发生迟发性坏死[11],并导致炎症的扩大,这可能是创伤后炎症失控的原因之一[12]。
同时,创伤后细胞的主动死亡可能对机体具有保护性意义。首先,创伤使机体内反应差、受损后不能恢复的细胞发生凋亡而起到汰劣作用;其次,机体内过度增生的细胞如炎症细胞尽快发生凋亡而恢复到正常状态,有利于炎症的消散;另外,凋亡细胞不发生破裂,被吞噬细胞吞噬后不引起炎症反应,故可有效地限制炎症,保护机体。当然,当严重创伤时,细胞内外环境发生极度紊乱,细胞凋亡出现严重异常,如凋亡过快或延迟、比例过大、清除障碍等,都可能造成各脏器的继发性损害,导致多器官功能衰竭
, 百拇医药
参考文献
1 Leist M,Gantner F,Bohlinger I,et al. Murine hepatocyte apoptosis induced in vitro and in vivo by TNF-α requires transcriptional arrest. J Immunol, 1994,153:1778-1788.
2 Burton K. A study of the conditions and mechanism of the diphenylamine reaction for the colorimetric estimation of deoxyribonucleic acid. Biochem J, 1956,62:315-321.
3 Wijsman JH, Jonker RR, Keijzer R,et al. A new method to detect apoptosis in paraffin sections: in situ end-labeling of fragmented DNA. J Histochem Cytochem, 1993,41:7-12.
, 百拇医药
4 Bohlinger I, Leist M, Gantner F,et al. DNA fragmentation in mouse organs during endotoxic shock. Am J Pathol, 1996, 149:1381-1393.
5 Sasaki H, Matsuno T,Tanaka N, et al. Activation of apoptosis during the reperfusion phase after rat liver ischemia. Transplantation Proceedings, 1996,28:1908-1909.
6 Takeda T. [A pathomorphological study on damage and repair process of tubuli after renal ischemia.] Nippon Jinzo Gakkai Shi,1996,38:493-501.
, 百拇医药
7 Fliss H, Gattinger D. Apoptosis in ischemia and reperfused rat myocardium. Cir Res, 1996, 79:949.
8 Du C, Hu R, Csernansky CA, et al. Very delayed infarction after mild focal cerebral ischemia: a role of apoptosis? J Cereb Blood Flow Metab,1996,16:195-201.
9 邓恭华,王殿华,皮业庆, 等.烧伤对胸腺细胞凋亡的影响.湖南医科大学学报, 1996,21:95-99.
10 陆江洋,梁延杰,王晓虹,等.多器官衰竭早期免疫器官细胞凋亡的检测及意义.解放军医学杂志,1996,21:414-416.
11 Squier MKT, Sehnert AJ, Coher JJ. Apoptosis in leukocytes. J Leukoc Biol, 1995, 57:2-10.
12 Goris RJA. MODS/SIRS: result of an overwhelming inflammatory response? World J Surg,1996,20:418-421.
(收稿:1997-09-23 修回:1998-06-04), 百拇医药