过氧化氢对小鼠脾细胞IL-2基因表达的影响①
作者:陈建忠② 郭实士③
单位:陈建忠② 郭实士③(免疫研究室 长沙 410078)
关键词:H2O2;IL-2;基因表达;脾;细胞;小鼠
湖南医科大学学报990102 提要 应用细胞免疫学和分子生物学的斑点杂交技术,探讨H2O2对小鼠脾细胞产生IL-2和IL-2mRNA表达的影响。结果示10-3~10-2mol.L-1 H2O2对小鼠脾细胞产生IL-2有抑制作用,并显著低于对照组(P<0.01);10-4mol.L-1有促进作用(P<0.01);10-8~10-5mol.L-1则影响不明显。斑点杂交结果示10-3mol.L-1 H2O2对小鼠脾细胞IL-2mRNA表达有抑制作用,10-4mol.L-1有促进作用,而10-5mol.L-1影响不明显。以上结果提示H2O2可能是通过影响IL-2mRNA的水平来影响IL-2的产生。
, 百拇医药
中国图书分类号 O623.424 R392.1
Effect of hydrogen peroxide on expression of interleukin-2 gene in mouse splenocytes
Chen Jianzhong Guo Shishi
(Research Laboratory of Immunology, Hunan Medical University, Changsha 410078)
The effect of hydrogen peroxide on interleukin-2(IL-2) production and IL-2mRNA expression in mouse splenocytes was detected by cellular immunological and molecular biological methods. The results were that the level of IL-2 activity was significantly elevated in 10-4mol.L-1 of H2O2 as compared with the control group (P<0.01), was obviously inhibited in 10-3~10-2mol.L-1 of H2O2 (P<0.01), and had no effect in 10-8~10-5mol.L-1 of H2O2. The results of dot blotting were that 10-4mol.L-1 of H2O2 enhanced IL-2mRNA expression, while 10-3mol.L-1 inhibited it, and 10-5mol.L-1 had no effect in mouse splenocytes. These results suggest that the effect of H2O2 on IL-2 production may be mediated by regulating IL-2 mRNA expression in mouse splenocytes.
, 百拇医药
Key words hydrogen peroxide; IL-2; gene expression; spleen; cells; mice
H2O2是机体内吞噬细胞被激活产生的主要活性氧产物之一,与吞噬细胞的抗微生物活性、处理和递呈抗原、免疫调节等功能有关。近年研究发现,H2O2对T淋巴细胞具有一定影响,该影响与H2O2浓度有关[1]。低浓度的H2O2对T细胞增殖、分化、对有丝分裂原的反应以及产生IL-2的能力有促进作用,高浓度的H2O2则有一定的抑制作用。此外,H2O2对B细胞产生抗体的能力及NK细胞和CTL细胞的杀伤活性也有一定影响。H2O2对T细胞影响的作用机制目前尚不清楚。本文用细胞生物学方法测定IL-2的生物活性水平,用分子生物学的斑点杂交技术研究H2O2对小鼠脾细胞IL-2mRNA表达的影响,旨在探讨H2O2在体外对小鼠脾细胞产生IL-2能力的影响及其分子机制,帮助了解体内单核-巨噬细胞与淋巴细胞相互调节机制以及某些疾病,如自身免疫病等的发病机制,并为防治这些疾病提供实验依据。
, http://www.100md.com
1 材料与方法
1.1 材料与试剂 实验动物:Balb/c健康小鼠,雄性,8~10周龄,18~25g,本校实验动物学部提供。HB101大肠杆菌由中科院基础所分子生物室提供。PKK质粒,含人IL-2 cDNA,具氨苄青霉素抗性和BamHI,EcoRI酶切位点,由本校分子生物研究中心提供。H2O2系上海桃浦化工厂产品。ConA系美国生化联合公司产品。3H-TdR系中国原子能研究所产品。CTLL细胞株系瑞士巴塞尔免疫研究所赠送。焦碳酸二乙酯(DEPL)、异硫氰酸胍、3-(N-玛啉代)丙磺酸(MOPS)、EcoRI和Primer-gene-labeling-system均系Promega公司产品。SDS和琼脂糖系Sigma产品。BamHI和λDNA/HindⅢ系华美生物工程公司产品。α-32P-dCTP系北京亚辉生物医学工程公司产品。
1.2 方法
, 百拇医药
1.2.1 小鼠脾细胞IL-2的诱生和活性测定 按本室常规方法[2]制备小鼠脾细胞悬液。调节细胞浓度为5×106.ml-1,加入ConA 10?μg.ml-1 37℃ 5% CO2孵育48h,收集上清,-20℃保存。各批标本同时检测活性。以1×105.ml-1 CTLL细胞为检测细胞,按本室常规方法测定IL-2活性[2],并以生长指数表示(Growth Index; GI)。
1.2.2 总RNA制备 以收取含IL-2的上清液后余下的细胞用于提取细胞总RNA。使用苯酚-氯仿/异戊醇法提取,并测定OD值和电泳鉴定。
1.2.3 IL-2 cDNA制备与探针标记 接种含PKK质粒的大肠杆菌于LB培养基(含氨苄青霉素)中37℃振摇培养,再加入氯霉素继续培养以扩增质粒。收集细菌洗涤后,加入溶菌酶;再加入预冷的3 mol.L-1的NaAc,混匀,离心后收集上清;无水乙醇沉淀,并以70%乙醇洗两次;真空干燥后用TE液溶解;加入RNaseA用苯酚/氯仿-异戊醇抽提两次,取上层水相。最后用70%乙醇洗两次制成DNA;加入BamHI和EcoRI分别于37℃消化2h,点样于琼脂糖凝胶板上,以λDNA/HindⅢ酶切片段作标准分子量对照,40V电泳1~2h,获取IL-2 cDNA;依次加入dNTPs,BSA,α-32P-dCTP和Klenow酶使总体积为50μl,混匀,室温放置1h,95~100℃水浴2min,放入冰中速冷,加入0.25mol.L-1 EDTA 4μl,加入杂交袋或-20℃保存。
, 百拇医药
1.2.4 总RNA的纯度与质粒DNA的鉴定 经AGPC一步法提取总RNA样品。OD(260/280nm)比值在1.8~2.0范围,表明核酸含量高,蛋白污染少。甲醛变性琼脂糖凝胶电泳结果明显可见28S和18S两条RNA带。28S带略宽于18S带,无明显降解(图1)。PKK质粒经BamHI和EcoRI酶切后琼脂糖凝胶电泳结果可见质粒酶切后第二条带长度0.67kb,符合IL-2mRNA插入片段长度(图2)。
图1 RNA甲醛变性凝胶电泳结果
图2 PKK质粒酶切电泳结果
Fig.1 Electrophoresis of RNA through gels containing formaldehyde
Fig.2 Electrophoresis of plasmid PKK digested by BamHI and EcoRI
, http://www.100md.com
1.2.5 斑点杂交与放射自显影 将尼龙膜装于点膜器上,连接真空抽吸器,将10μg RNA加入各点样孔中,取出尼龙膜,置80℃烘烤2h;此膜先在42℃预杂交6h,然后加入含32P-IL-2 cDNA杂交液杂交24h,洗膜;晾干后用X光胶片-70℃曝光2~7天后显影,用扫描仪扫描对mRNA定量。
1.3 统计学处理 实验结果以组间t检验进行显著性分析,IL-2活性与IL-2 mRNA表达作直线相关分析。
2 结 果
2.1 不同浓度的H2O2对体外小鼠脾细胞产生IL-2的影响 附表示,高浓度10-3,10-2mol.L-1 H2O2对体外小鼠脾细胞产生IL-2有抑制作用,与对照组相比差异有显著性(P<0.01);10-4mol.L-1则有促进作用,与对照组相比差异非常显著(P<0.01);而10-8~10-5mol.L-1有一定增强作用,但无统计学意义。
, http://www.100md.com
附表 不同浓度H2O2对小鼠脾细胞产生IL-2的影响( ±s) H2O2浓度(mol.L-1)
±s) H2O2浓度(mol.L-1)
n
IL-2活性(GI)
P
10-2
10
1.53±0.81
<0.01
10-3
, http://www.100md.com
13
2.13±0.94
<0.01
10-4
13
88.34±11.05
<0.01
10-5
13
64.41±8.07
>0.05
10-6
, http://www.100md.com
10
70.49±9.87
>0.05
10-7
10
68.69±11.62
>0.05
10-8
10
66.53±11.16
>0.05
ConA对照
, 百拇医药
13
63.87±8.73
Cell对照
13
3.66±0.97
2.2 不同浓度H2O2对小鼠脾细胞IL-2mRNA表达的影响 用α-32P-IL-2 cDNA作为探针,与从小鼠脾细胞提取的总RNA进行斑点杂交,结果显示:10-3mol.L-1 H2O2对小鼠脾细胞IL-2mRNA表达有抑制作用,10-4mol.L-1 H2O2有促进作用,而10-5mol.L-1的影响不明显。小鼠脾细胞经不同浓度的H2O2处理后,其产生IL-2与IL-2 mRNA表达之间呈正相关(r=0.955;P<0.01)(图3,4)。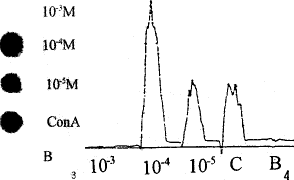
, http://www.100md.com
图3 斑点杂交放射自显影结果
图4 斑点杂交密度扫描曲线图
Fig.3 Autoradiographic result of dot hybridization of IL-2 mRNA B=Blank, only cells
Fig.4 Denimetric scanning curve of blotting autoradiograph C=ConA;B=Blank, only cells
3 讨 论
近年的研究发现,H2O2除与多种疾病如自身免疫病、肿瘤、炎症以及细胞程序性死亡(PCD)等病理过程关系密切外[3,4],还影响机体的免疫调节功能,同时对淋巴细胞的活化、T细胞的细胞毒作用及淋巴细胞的功能状态均有一定的影响。Roth报道,1×10-5mol.L-1 H2O2能促进去除粘附细胞后的小鼠脾细胞分泌IL-2,而对其增殖、分化无影响;较高浓度(3×10-5~1×10-4mol.L-1)的H2O2对去除粘附细胞的小鼠脾细胞的增殖、分化和产生IL-2则有抑制作用[1]。我室曾对此作过研究,与前述结果基本一致[5]。Gardner发现高浓度的H2O2(>10mmol.L-1)很快诱导细胞坏死(necrosis);中等浓度(1~10mmol.L-1)主要引起细胞凋亡(apoptosis);低浓度(<0.1mmol.L-1,相当于<10-4mol.L-1)作用48h对细胞仍无影响。笔者此次的结果基本与之一致。Gardner还证实bcl-2仅在H2O2低浓度时发挥抑制凋亡作用[6]。Suzuki提出H2O2可能是通过增强p53基因活性而诱导凋亡[7]。
, 百拇医药
本组结果表明,H2O2对小鼠脾细胞体外产生IL-2的影响与浓度有关。高浓度(10-3~10-2mol.L-1)的H2O2可显著抑制小鼠脾细胞产生IL-2的能力,一定浓度(10-4mol.L-1)的H2O2则有促进作用,而低浓度(10-8~10-5mol.L-1)则影响不明显。结果提示机体内单核-巨噬细胞产生H2O2可对体内细胞免疫功能起双重作用,即一定浓度的H2O2是机体生理功能所必须,但浓度过高则有抑制作用。单核-巨噬细胞递呈抗原肽的同时,除释放IL-1等细胞因子外,还可通过释放一定量的H2O2促进T细胞的增殖、分化及分泌IL-2,以增强机体的免疫功能。当机体对外来抗原性物质不产生免疫应答或完全清除时,单核-巨噬细胞则表现为释放大量的H2O2抑制IL-2的产生。文献报道T淋巴细胞受到抗原,或植物血凝素(PHA)和美洲商陆(PWM)等有丝分裂原刺激后产生呼吸爆发(respiratory burst)和释放氧自由基增多,抗氧化剂如苯甲酸钠、二甲亚砜(DMSO)、甘露醇和触酶等能抑制淋巴细胞增殖反应、IL-2受体及转铁蛋白受体(TfR)的表达[8],间接提示H2O2影响淋巴细胞活化。此外,由于T辅助细胞(TH)和T抑制细胞(TS)对H2O2的敏感性不同,H2O2可选择性地抑制TS细胞来调节免疫功能。用高浓度(10-3~10-2mol.L-1)H2O2处理后的小鼠脾细胞产生的IL-2低于细胞对照,可能说明此浓度的H2O2对小鼠脾细胞具有坏死作用。
, 百拇医药
Ryan报道,95%的氧能使转铁蛋白轻链亚单位的mRNA增加数倍,而其重链亚单位的mRNA的量无明显变化[9]。笔者采用IL-2cDNA探针,通过DNA-RNA斑点杂交技术检测H2O2处理后的小鼠脾细胞产生的IL-2mRNA,结果显示10-3mol.L-1的H2O2对小鼠脾细胞IL-2mRNA表达具有抑制作用,10-4mol.L-1 H2O2则有促进作用,而10-5mol.L-1 影响不明显。IL-2mRNA与IL-2活性相关分析表明,IL-2mRNA水平的高低与IL-2生物学活性的高低呈正相关。提示H2O2可能是通过影响IL-2mRNA的水平来影响小鼠脾细胞产生IL-2。淋巴细胞产生IL-2 mRNA受多种因素的影响,如IL-2mRNA合成与降解速率、稳定性和其他转录后水平的调控等[10]。至于H2O2影响小鼠脾细胞产生IL-2mRNA是直接引起还是通过其他物质如cAMP和NF-κB介导以及影响的环节尚须深入探讨。
, 百拇医药
作者:陈建忠 男 29岁 讲师 ①国家自然科学基金资助项目(19070744) ②硕士研究生,现在浙江医科大学免疫教研室 ③导师
参考文献
[1]Roth S, Dorge W. Regulation of T-cell antivation and T-cell growth factor (TCGF) production by hydrogen peroxide. Cell Immunol, 1987,108(2):417-424
[2]郭实士,燕美玉,李立新.双突变型小鼠细胞免疫功能观察.中国免疫学杂志,1990,6(5):289-290
[3]Ara J, Ali R. Polynucleotide specificity of anti-reactive oxygen species (ROS) DNA antibodies. Clin Exp Immunol, 1993,94(1):134-139
, http://www.100md.com
[4]Buttke TM, Sandstrom PA. Oxidative stress as a mediator of apoptosis. Immunol Today, 1994,15(1):7-10
[5]胡四海,郭实士.氧自由基对体外小鼠脾细胞产生白细胞介素-2的影响及其机理初探.中国实验临床免疫学杂志,1995,7(5):10-13
[6]Gardner AM, Xu FH, Fady C, et al. Apoptotic vs, nonapoptotic cytotoxicity induced by hydrogen peroxide. Free Radic Biol Med, 1997,22(1/2):73-83
[7]Suzuki YJ, Forman HJ, Sevanian A. Oxidants as stimulators of signal transduction. Free Radic Biol Med, 1997,22(1/2):269-285
, 百拇医药
[8]Baker MA, He S. Elaboration of cellular DNA breaks by hydroperoxides. Free Radic Biol Med, 1991,11(6):563-572
[9]Ryan TP, Krzesicki RF, Blakeman DP, et al. Pulmonary ferritin: Differential effects of hydroxic lung injury on subunit mRNA levels. Free Radic Biol Med, 1997,22(5):901-908
[10]Kalsi JK, Clay K, Hall ND. Antioxidant drugs as modulators of lymphocyte activation in vitro. Molec Aspects Med, 1991,12(2):161-167
1998-04-17 收稿, 百拇医药(陈建忠② 郭实士③)
单位:陈建忠② 郭实士③(免疫研究室 长沙 410078)
关键词:H2O2;IL-2;基因表达;脾;细胞;小鼠
湖南医科大学学报990102 提要 应用细胞免疫学和分子生物学的斑点杂交技术,探讨H2O2对小鼠脾细胞产生IL-2和IL-2mRNA表达的影响。结果示10-3~10-2mol.L-1 H2O2对小鼠脾细胞产生IL-2有抑制作用,并显著低于对照组(P<0.01);10-4mol.L-1有促进作用(P<0.01);10-8~10-5mol.L-1则影响不明显。斑点杂交结果示10-3mol.L-1 H2O2对小鼠脾细胞IL-2mRNA表达有抑制作用,10-4mol.L-1有促进作用,而10-5mol.L-1影响不明显。以上结果提示H2O2可能是通过影响IL-2mRNA的水平来影响IL-2的产生。
, 百拇医药
中国图书分类号 O623.424 R392.1
Effect of hydrogen peroxide on expression of interleukin-2 gene in mouse splenocytes
Chen Jianzhong Guo Shishi
(Research Laboratory of Immunology, Hunan Medical University, Changsha 410078)
The effect of hydrogen peroxide on interleukin-2(IL-2) production and IL-2mRNA expression in mouse splenocytes was detected by cellular immunological and molecular biological methods. The results were that the level of IL-2 activity was significantly elevated in 10-4mol.L-1 of H2O2 as compared with the control group (P<0.01), was obviously inhibited in 10-3~10-2mol.L-1 of H2O2 (P<0.01), and had no effect in 10-8~10-5mol.L-1 of H2O2. The results of dot blotting were that 10-4mol.L-1 of H2O2 enhanced IL-2mRNA expression, while 10-3mol.L-1 inhibited it, and 10-5mol.L-1 had no effect in mouse splenocytes. These results suggest that the effect of H2O2 on IL-2 production may be mediated by regulating IL-2 mRNA expression in mouse splenocytes.
, 百拇医药
Key words hydrogen peroxide; IL-2; gene expression; spleen; cells; mice
H2O2是机体内吞噬细胞被激活产生的主要活性氧产物之一,与吞噬细胞的抗微生物活性、处理和递呈抗原、免疫调节等功能有关。近年研究发现,H2O2对T淋巴细胞具有一定影响,该影响与H2O2浓度有关[1]。低浓度的H2O2对T细胞增殖、分化、对有丝分裂原的反应以及产生IL-2的能力有促进作用,高浓度的H2O2则有一定的抑制作用。此外,H2O2对B细胞产生抗体的能力及NK细胞和CTL细胞的杀伤活性也有一定影响。H2O2对T细胞影响的作用机制目前尚不清楚。本文用细胞生物学方法测定IL-2的生物活性水平,用分子生物学的斑点杂交技术研究H2O2对小鼠脾细胞IL-2mRNA表达的影响,旨在探讨H2O2在体外对小鼠脾细胞产生IL-2能力的影响及其分子机制,帮助了解体内单核-巨噬细胞与淋巴细胞相互调节机制以及某些疾病,如自身免疫病等的发病机制,并为防治这些疾病提供实验依据。
, http://www.100md.com
1 材料与方法
1.1 材料与试剂 实验动物:Balb/c健康小鼠,雄性,8~10周龄,18~25g,本校实验动物学部提供。HB101大肠杆菌由中科院基础所分子生物室提供。PKK质粒,含人IL-2 cDNA,具氨苄青霉素抗性和BamHI,EcoRI酶切位点,由本校分子生物研究中心提供。H2O2系上海桃浦化工厂产品。ConA系美国生化联合公司产品。3H-TdR系中国原子能研究所产品。CTLL细胞株系瑞士巴塞尔免疫研究所赠送。焦碳酸二乙酯(DEPL)、异硫氰酸胍、3-(N-玛啉代)丙磺酸(MOPS)、EcoRI和Primer-gene-labeling-system均系Promega公司产品。SDS和琼脂糖系Sigma产品。BamHI和λDNA/HindⅢ系华美生物工程公司产品。α-32P-dCTP系北京亚辉生物医学工程公司产品。
1.2 方法
, 百拇医药
1.2.1 小鼠脾细胞IL-2的诱生和活性测定 按本室常规方法[2]制备小鼠脾细胞悬液。调节细胞浓度为5×106.ml-1,加入ConA 10?μg.ml-1 37℃ 5% CO2孵育48h,收集上清,-20℃保存。各批标本同时检测活性。以1×105.ml-1 CTLL细胞为检测细胞,按本室常规方法测定IL-2活性[2],并以生长指数表示(Growth Index; GI)。
1.2.2 总RNA制备 以收取含IL-2的上清液后余下的细胞用于提取细胞总RNA。使用苯酚-氯仿/异戊醇法提取,并测定OD值和电泳鉴定。
1.2.3 IL-2 cDNA制备与探针标记 接种含PKK质粒的大肠杆菌于LB培养基(含氨苄青霉素)中37℃振摇培养,再加入氯霉素继续培养以扩增质粒。收集细菌洗涤后,加入溶菌酶;再加入预冷的3 mol.L-1的NaAc,混匀,离心后收集上清;无水乙醇沉淀,并以70%乙醇洗两次;真空干燥后用TE液溶解;加入RNaseA用苯酚/氯仿-异戊醇抽提两次,取上层水相。最后用70%乙醇洗两次制成DNA;加入BamHI和EcoRI分别于37℃消化2h,点样于琼脂糖凝胶板上,以λDNA/HindⅢ酶切片段作标准分子量对照,40V电泳1~2h,获取IL-2 cDNA;依次加入dNTPs,BSA,α-32P-dCTP和Klenow酶使总体积为50μl,混匀,室温放置1h,95~100℃水浴2min,放入冰中速冷,加入0.25mol.L-1 EDTA 4μl,加入杂交袋或-20℃保存。
, 百拇医药
1.2.4 总RNA的纯度与质粒DNA的鉴定 经AGPC一步法提取总RNA样品。OD(260/280nm)比值在1.8~2.0范围,表明核酸含量高,蛋白污染少。甲醛变性琼脂糖凝胶电泳结果明显可见28S和18S两条RNA带。28S带略宽于18S带,无明显降解(图1)。PKK质粒经BamHI和EcoRI酶切后琼脂糖凝胶电泳结果可见质粒酶切后第二条带长度0.67kb,符合IL-2mRNA插入片段长度(图2)。

图1 RNA甲醛变性凝胶电泳结果
图2 PKK质粒酶切电泳结果
Fig.1 Electrophoresis of RNA through gels containing formaldehyde
Fig.2 Electrophoresis of plasmid PKK digested by BamHI and EcoRI
, http://www.100md.com
1.2.5 斑点杂交与放射自显影 将尼龙膜装于点膜器上,连接真空抽吸器,将10μg RNA加入各点样孔中,取出尼龙膜,置80℃烘烤2h;此膜先在42℃预杂交6h,然后加入含32P-IL-2 cDNA杂交液杂交24h,洗膜;晾干后用X光胶片-70℃曝光2~7天后显影,用扫描仪扫描对mRNA定量。
1.3 统计学处理 实验结果以组间t检验进行显著性分析,IL-2活性与IL-2 mRNA表达作直线相关分析。
2 结 果
2.1 不同浓度的H2O2对体外小鼠脾细胞产生IL-2的影响 附表示,高浓度10-3,10-2mol.L-1 H2O2对体外小鼠脾细胞产生IL-2有抑制作用,与对照组相比差异有显著性(P<0.01);10-4mol.L-1则有促进作用,与对照组相比差异非常显著(P<0.01);而10-8~10-5mol.L-1有一定增强作用,但无统计学意义。
, http://www.100md.com
附表 不同浓度H2O2对小鼠脾细胞产生IL-2的影响(
 ±s) H2O2浓度(mol.L-1)
±s) H2O2浓度(mol.L-1)n
IL-2活性(GI)
P
10-2
10
1.53±0.81
<0.01
10-3
, http://www.100md.com
13
2.13±0.94
<0.01
10-4
13
88.34±11.05
<0.01
10-5
13
64.41±8.07
>0.05
10-6
, http://www.100md.com
10
70.49±9.87
>0.05
10-7
10
68.69±11.62
>0.05
10-8
10
66.53±11.16
>0.05
ConA对照
, 百拇医药
13
63.87±8.73
Cell对照
13
3.66±0.97
2.2 不同浓度H2O2对小鼠脾细胞IL-2mRNA表达的影响 用α-32P-IL-2 cDNA作为探针,与从小鼠脾细胞提取的总RNA进行斑点杂交,结果显示:10-3mol.L-1 H2O2对小鼠脾细胞IL-2mRNA表达有抑制作用,10-4mol.L-1 H2O2有促进作用,而10-5mol.L-1的影响不明显。小鼠脾细胞经不同浓度的H2O2处理后,其产生IL-2与IL-2 mRNA表达之间呈正相关(r=0.955;P<0.01)(图3,4)。

, http://www.100md.com
图3 斑点杂交放射自显影结果
图4 斑点杂交密度扫描曲线图
Fig.3 Autoradiographic result of dot hybridization of IL-2 mRNA B=Blank, only cells
Fig.4 Denimetric scanning curve of blotting autoradiograph C=ConA;B=Blank, only cells
3 讨 论
近年的研究发现,H2O2除与多种疾病如自身免疫病、肿瘤、炎症以及细胞程序性死亡(PCD)等病理过程关系密切外[3,4],还影响机体的免疫调节功能,同时对淋巴细胞的活化、T细胞的细胞毒作用及淋巴细胞的功能状态均有一定的影响。Roth报道,1×10-5mol.L-1 H2O2能促进去除粘附细胞后的小鼠脾细胞分泌IL-2,而对其增殖、分化无影响;较高浓度(3×10-5~1×10-4mol.L-1)的H2O2对去除粘附细胞的小鼠脾细胞的增殖、分化和产生IL-2则有抑制作用[1]。我室曾对此作过研究,与前述结果基本一致[5]。Gardner发现高浓度的H2O2(>10mmol.L-1)很快诱导细胞坏死(necrosis);中等浓度(1~10mmol.L-1)主要引起细胞凋亡(apoptosis);低浓度(<0.1mmol.L-1,相当于<10-4mol.L-1)作用48h对细胞仍无影响。笔者此次的结果基本与之一致。Gardner还证实bcl-2仅在H2O2低浓度时发挥抑制凋亡作用[6]。Suzuki提出H2O2可能是通过增强p53基因活性而诱导凋亡[7]。
, 百拇医药
本组结果表明,H2O2对小鼠脾细胞体外产生IL-2的影响与浓度有关。高浓度(10-3~10-2mol.L-1)的H2O2可显著抑制小鼠脾细胞产生IL-2的能力,一定浓度(10-4mol.L-1)的H2O2则有促进作用,而低浓度(10-8~10-5mol.L-1)则影响不明显。结果提示机体内单核-巨噬细胞产生H2O2可对体内细胞免疫功能起双重作用,即一定浓度的H2O2是机体生理功能所必须,但浓度过高则有抑制作用。单核-巨噬细胞递呈抗原肽的同时,除释放IL-1等细胞因子外,还可通过释放一定量的H2O2促进T细胞的增殖、分化及分泌IL-2,以增强机体的免疫功能。当机体对外来抗原性物质不产生免疫应答或完全清除时,单核-巨噬细胞则表现为释放大量的H2O2抑制IL-2的产生。文献报道T淋巴细胞受到抗原,或植物血凝素(PHA)和美洲商陆(PWM)等有丝分裂原刺激后产生呼吸爆发(respiratory burst)和释放氧自由基增多,抗氧化剂如苯甲酸钠、二甲亚砜(DMSO)、甘露醇和触酶等能抑制淋巴细胞增殖反应、IL-2受体及转铁蛋白受体(TfR)的表达[8],间接提示H2O2影响淋巴细胞活化。此外,由于T辅助细胞(TH)和T抑制细胞(TS)对H2O2的敏感性不同,H2O2可选择性地抑制TS细胞来调节免疫功能。用高浓度(10-3~10-2mol.L-1)H2O2处理后的小鼠脾细胞产生的IL-2低于细胞对照,可能说明此浓度的H2O2对小鼠脾细胞具有坏死作用。
, 百拇医药
Ryan报道,95%的氧能使转铁蛋白轻链亚单位的mRNA增加数倍,而其重链亚单位的mRNA的量无明显变化[9]。笔者采用IL-2cDNA探针,通过DNA-RNA斑点杂交技术检测H2O2处理后的小鼠脾细胞产生的IL-2mRNA,结果显示10-3mol.L-1的H2O2对小鼠脾细胞IL-2mRNA表达具有抑制作用,10-4mol.L-1 H2O2则有促进作用,而10-5mol.L-1 影响不明显。IL-2mRNA与IL-2活性相关分析表明,IL-2mRNA水平的高低与IL-2生物学活性的高低呈正相关。提示H2O2可能是通过影响IL-2mRNA的水平来影响小鼠脾细胞产生IL-2。淋巴细胞产生IL-2 mRNA受多种因素的影响,如IL-2mRNA合成与降解速率、稳定性和其他转录后水平的调控等[10]。至于H2O2影响小鼠脾细胞产生IL-2mRNA是直接引起还是通过其他物质如cAMP和NF-κB介导以及影响的环节尚须深入探讨。
, 百拇医药
作者:陈建忠 男 29岁 讲师 ①国家自然科学基金资助项目(19070744) ②硕士研究生,现在浙江医科大学免疫教研室 ③导师
参考文献
[1]Roth S, Dorge W. Regulation of T-cell antivation and T-cell growth factor (TCGF) production by hydrogen peroxide. Cell Immunol, 1987,108(2):417-424
[2]郭实士,燕美玉,李立新.双突变型小鼠细胞免疫功能观察.中国免疫学杂志,1990,6(5):289-290
[3]Ara J, Ali R. Polynucleotide specificity of anti-reactive oxygen species (ROS) DNA antibodies. Clin Exp Immunol, 1993,94(1):134-139
, http://www.100md.com
[4]Buttke TM, Sandstrom PA. Oxidative stress as a mediator of apoptosis. Immunol Today, 1994,15(1):7-10
[5]胡四海,郭实士.氧自由基对体外小鼠脾细胞产生白细胞介素-2的影响及其机理初探.中国实验临床免疫学杂志,1995,7(5):10-13
[6]Gardner AM, Xu FH, Fady C, et al. Apoptotic vs, nonapoptotic cytotoxicity induced by hydrogen peroxide. Free Radic Biol Med, 1997,22(1/2):73-83
[7]Suzuki YJ, Forman HJ, Sevanian A. Oxidants as stimulators of signal transduction. Free Radic Biol Med, 1997,22(1/2):269-285
, 百拇医药
[8]Baker MA, He S. Elaboration of cellular DNA breaks by hydroperoxides. Free Radic Biol Med, 1991,11(6):563-572
[9]Ryan TP, Krzesicki RF, Blakeman DP, et al. Pulmonary ferritin: Differential effects of hydroxic lung injury on subunit mRNA levels. Free Radic Biol Med, 1997,22(5):901-908
[10]Kalsi JK, Clay K, Hall ND. Antioxidant drugs as modulators of lymphocyte activation in vitro. Molec Aspects Med, 1991,12(2):161-167
1998-04-17 收稿, 百拇医药(陈建忠② 郭实士③)