一氧化氮参与失血性休克后期血管反应性下降的发生*
作者:一氧化氮参与失血性休克后期血管反应性下降的发生*
单位:第一军医大学病理生理学教研室,广州,510515
关键词:失血性休克;血管反应性;一氧化氮
第一军医大学学报990110 摘要:方法和目的 选择雄性SD大鼠(180~220 g)12只(其中对照组5只),颈动脉放血使血压维持在5.33 kPa (40 mmHg),复制失血性休克模型。分离左侧脊斜肌进行微循环观察,局部滴加去甲肾上腺素(NE), 使三级微动脉(A3)关闭的最小NE浓度梯度为血管反应性指标。失血前和血管反应性下降时,按镉还原法检测血浆NO水平,观察休克前后血管反应性与NO变化。结果 失血前血浆NO浓度为(37.8 ± 5.3) m mol/L, 使A3关闭的最小NE浓度为(3.44 ± 1.16)m mol/L; 而休克至血管反应性降低时[ NE: (6.88 ± 2.33) m mol/L 、休克持续时间: (110 ± 47) min)] ,血浆NO浓度升高显著[ (72.9 ± 20.8) m mol/L, P< 0.01] ; 对照组假手术后90 min,血管反应性与NO浓度变化无显著意义(P > 0.05)。结论 失血性休克后期体内NO产生过多可能参与了血管反应性下降的发生。
, http://www.100md.com
中图分类号:Q463; R363
Nitric oxide involves in vascular hyporeactivity to vasoconstrictor agents in prolonged period of hemorrhagic shock
Yang Guiyuan, Zhao Kesen, Jiang Yong
Key Lab for Shock and Microcirculation of PLA, First Military Medical University, Guangzhou, 510515
Abstract: Objective and method Seven male Sprague-Dawley rats (180~220 g) were subjected to hemorrhagic shock (HS) by withdrawing blood from the left carotid artery to maintain mean arterial pressure (MAP) at 5.33 kPa. Spinotrapezius muscle was exteriorized for intravital microscopy, and vascular reactivity was determined by topical application of norepinephrine. Plasma nitrite/nitrate level was determined by cadmium reduction method. Results Compared with that before initiation of HS, plasma nitrite/nitrate level was elevated significantly when vascular reactivity decreased (110 ± 47 min after initiation of HS, P < 0.01). Conclusion Nitric oxide may contribute to the development of vascular hyporeactivity to vasoconstrictor agents in prolonged period of hemorrhagic shock.
, 百拇医药
Key words: hemorrhagic shock; vascular reactivity; nitric oxide
急性失血引起心输出量和血压下降,从而引起去甲肾上腺素(NE)、肾上腺素等内源性缩血管物质大量产生,以维持血压。在这一代偿期内,血管对缩血管物质的反应性升高;随着失血状态的持续,虽然体内缩血管物质仍维持较高水平,但血管对其反应性进行性下降,休克由代偿转为失代偿,血管扩张,引起血压进行性下降,进一步发展为复苏无效的不可逆休克。因此,血管反应性下降是休克由代偿期转为失代偿期的重要标志之一 [ 1] ,弄清其发生机制对失血性休克(HS)的救治具有重要意义。作为重要的新型舒血管分子,一氧化氮(NO)对正常和内毒素休克状态下的血管紧张性和血压发挥重要作用[ 2,3] ,而NO与失血性休克血管反应性的关系多数为试验治疗推测,未见直接测定报告。本实验复制大鼠失血性休克模型,观察休克前后血管不同反应性时血浆NO水平的变化。
, 百拇医药
1 材料和方法
1.1 休克模型复制 雄性SD大鼠(第一军医大学实验动物中心提供)12只(其中对照5只),体质量180~220 g,肌肉注射13.3%乌拉坦+0.5%氯醛糖(0.06 ml/kg) 全身麻醉,左侧股动脉和颈动脉插PE50管,分别通过三通管连接液晶血压显示器和玻璃注射器,观察血压和放血。放血前经插管注射0.1 ml肝素钠(125 000 U/L)生理盐水,5 min后打开颈动脉三通管,让血液自然流入注射器内,直至大鼠平均动脉压降至5.33 kPa (40 mmHg),在实验过程中通过间断放血、输血,以维持平均动脉压在5.33 kPa。
1.2 血管反应性观察 于插管后复制休克前,在微循环观察台上按照Gray法[4]制作大鼠左侧脊斜肌活体微循环观察标本,用Kreb液恒温滴注,用Olympus显微镜寻找三级微动脉 (A3),按Zhao法[5],分别于失血前和失血后每隔15 min,在标本上滴加50 m l酒石酸去甲肾上腺素(用Kreb液倍比稀释成10个浓度),以使三级微动脉(A3)关闭的最小NE浓度梯度表示血管反应性。于失血休克前和血管反应性下降时(对照组于微循环标本观察前后1.5 h)分别取血0.6 ml,分离血浆,冷冻保存,用于测定NO2-/NO3-。对照组大鼠于微循环观察前后90 min取血测定NO2-/NO3-,除不复制休克外,其他操作同实验组。
, 百拇医药
1.3 血浆NO2-/NO3-浓度测定 按文献方法[6~8]加以改进。
1.3.1 铜-镉还原柱制作 取镉粒(广州化学试剂厂,批号950301-3)自制镉锯屑,加入约10倍体积5%硫酸铜水溶液,轻轻搅动,5 min后弃液体,用大量蒸馏水冲洗至无明显黑色,再加约10倍体积0.1 mol/L盐酸溶液,同上处理。将此镉锯屑保存于5% NH4Cl溶液(pH 9.0, 用硼酸钠调)中备用。使用前将此镉锯屑装入约120 mm×8 mm大小的层析柱中,用0.05% NH4Cl溶液(pH 9.0, 用硼酸钠调)约10 ml平衡后即可使用。若还原性明显下降时,可分别用蒸馏水、0.1 mol/L盐酸、蒸馏水和5% NH4Cl溶液(pH 9.0)各5 ml冲洗一遍。 分别将硝酸钠和亚硝酸钠配成100~3.125 m mol/L倍比稀释的标准液,按下述测定血浆的步骤操作,测定其吸光度。比较测定值以判断铜-镉还原柱的还原性和稳定性。
, 百拇医药
1.3.2 NO2-/NO3-浓度测定 血浆样品加1/20体积的30%硫酸锌混匀。离心去蛋白沉淀。取上清加等体积5% NH4Cl溶液混匀。离心(去硫酸锌)后,取上清0.5 ml过柱。以0.05% NH4Cl(pH=9)溶液为洗脱液,弃去最初流出的1.5 ml液体,收集随后的2.5 ml洗脱液,加Griess试剂1 ml混匀。室温放置半小时后,用SHIMUDAZU紫外分光光度计在l 540 nm处比色。以倍比稀释的硝酸钠溶液经同样步骤后的检测结果绘制标准曲线,以此为据确定NO2-/NO3-的含量。
1.4 统计学处理 所有实验数据均用均数± 标准差(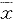 ± s)表示,统计方法根据实际情况采用t检验或方差分析。
± s)表示,统计方法根据实际情况采用t检验或方差分析。
, 百拇医药
2 结果
2.1 铜-镉还原柱的还原性与稳定性 对于6.25 ~100 m mol/L的硝酸钠溶液的平均还原率为(96± 6)%。对小量正常大鼠血浆重复检测的结果显示其变异系数在4%左右。
2.2 血压及血管反应性改变 休克组自然放血,血压在5 min由正常降至5.33 kPa。休克初期血管反应性升高,随着休克状态的持续而逐渐下降,直至休克结束时,血管反应性显著低于休克前水平;假手术前后对照组血压及血管反应性未见明显改变(表1)。
表1 大鼠休克或假手术前后血管反应性变化( ± s)
± s)
Tab. 1 Effects of hemorrhagic shock or shame operation on vascular reactivity in rats Time course (min)
, http://www.100md.com
0
30
60
110± 47
Sham (m mol/L)
3.51± 1.15
3.51± 1.15
3.51± 1.15
3.51± 1.15
Shock (m mol/L)
3.44± 1.16
1.72± 0.58*
, http://www.100md.com
3.± 1.16
6.88± 2.33*
*P< 0.01 vs that before shock
2.3 血浆NO浓度变化 失血前血浆NO浓度为(37.8± 5.3) m mol/L,当休克持续至 (110± 47) min 时,出现血管反应性显著下降,血浆NO浓度也升高[ (72.9± 20.8) m mol/L],差异具有极显著意义(P < 0.01),对照组5只大鼠插管及微循环观察1.5 h(假手术)前后,NO浓度变化[(35.26± 5.77) m mol/L ,(39.24± 3.96) m mol/L ],无显著意义(P > 0.05)。
3 讨论
近年来,NO在失血休克中的作用引起人们关注,但研究结果不尽一致。沈文梅等报道[9],犬失血休克后血浆NO并不升高,反而降低。 Kelly等[10]研究表明,大鼠失血休克5 h(不可逆期,需回输90%血液以维持血压),血浆NO2-/NO3-及诱导型NOS蛋白表达和mRNA显著升高,而休克3 h(失代偿期,需回输40%血液以维持血压)则未见升高, 据此认为NO产生增多仅见于失血休克的不可逆期。上述差异可能是由于休克模型复制方法及实验动物的差异导致实验结果的不一致。由于失血性休克后期血管反应性下降对失血性休克转归的重要影响,对其发生机制的研究引起人们重视。有研究[11]表明,这种血管低反应性的发生与肾上腺素能受体饱和、酸中毒以及神经效应器接点失效无关。刘杰等[12]报道,重症失血性休克血管反应性低下与KATP通道开放导致细胞外钙内流减少有关。Thiemermann等[1]发现,大鼠失血休克2 h及回输血后3 h时的血管低反应性可被NO合成酶(NOS)抑制剂所逆转;本实验表明,失血休克至血管反应性降低时,引起细动脉收缩的NE浓度增高2倍,而血浆NO浓度升高也为休克前的2倍,说明NO参与了失血休克后期血管反应性降低的发生。急性失血本身是一种应激,导致缩血管活性物质大量产生,另外,休克初期细胞损伤较轻,代偿机制较完备,血管反应性升高显著(本实验也观察到这一现象)。随着失血状态的持续,通过某种机制导致舒血管活性物质,如NO等的增加,使其优势逐渐趋于明显,虽然体内缩血管物质仍处于较高水平,但由于缺血、缺氧等原因,细胞损伤越来越明显,机体由代偿转为失代偿,从而导致血管反应性下降。
, 百拇医药
*国家自然科学基金(39870332)
作者简介:杨贵远,男,1964年出生,1988年7月毕业于解放军农牧大学,硕士,讲师
参考文献
1 Thiemermann C, Szabo C, Jane A et al. Vascular hyporeactivity to vasoconstrictor agents and hemodynamic decompensation in hemorrhagic shock is mediated by nitric oxide. Proc Natl Acad Sci USA, 1993, 90: 267
2 Rees DD, Palmer RM, Moncada S. Role of endothelium-derived nitric oxide in the regulation of blood pressure. Proc Natl Acad Sci USA, 1989, 86: 3375
, http://www.100md.com
3 Kilbourn RG, Jubran A, Gross SS et al. Reversal of endotoxin-mediated shock by NG-methyl-L-arginine, an inhibitor of nitric oxide synthesis. Biochem Biophys Rews Commun, 1990,172: 1132
4 Gray SD. Rat spinotrapezius muscle preparation for microscopic observation of the terminal vascular bed. Microvas Res, 1973, 5: 395
5 Zhao KS, Junker D, Delano FA et al. Microvascular adjustments during irreversible hemorrhagic shock in rat skeletal muscle. Microvas Res, 1985, 30: 143
, 百拇医药
6 Green LC, Wagner DA, Glogowski J et al. Analysis of nitrate, nitrite, and [15N] nitrate in biological fluids. Anal Biochem, 1982,126: 131
7 Hegesh E, Shiloah J. Blood nitrates and infantile methemoglobinemia. Clin Chim Acta, 1982, 125: 107
8 石胜军,吴坤莹. 一氧化氮对烧伤休克大鼠微循环的作用. 微循环学杂志,1997,7(2):1
9 沈文梅,王成彬,田亚平等. 失血性休克犬血液一氧化氮浓度的变化. 中华医学杂志,1996,76(8):603
10 Kelly E, Shah NS, Morgan NN et al. Physiologic and molecular characterization of the role of nitric oxide in hemorrhagic shock: evidence that type II nitric oxide synthase does not regulate vascular decompensation. Shock, 1997, 7(3): 157
11 Perbeck L, Hedqvist P. Blood pressure responses associated with hemorrhagic shock in anesthetized rats. Acta Chir Scand, 1982,148(1): 3
12 刘 杰,赵克森. 钙动力学变化在重症休克血管反应性低下发生中的作用. 中华创伤杂志,1997,13(6):33
(收稿日期:1998-07-03), 百拇医药
单位:第一军医大学病理生理学教研室,广州,510515
关键词:失血性休克;血管反应性;一氧化氮
第一军医大学学报990110 摘要:方法和目的 选择雄性SD大鼠(180~220 g)12只(其中对照组5只),颈动脉放血使血压维持在5.33 kPa (40 mmHg),复制失血性休克模型。分离左侧脊斜肌进行微循环观察,局部滴加去甲肾上腺素(NE), 使三级微动脉(A3)关闭的最小NE浓度梯度为血管反应性指标。失血前和血管反应性下降时,按镉还原法检测血浆NO水平,观察休克前后血管反应性与NO变化。结果 失血前血浆NO浓度为(37.8 ± 5.3) m mol/L, 使A3关闭的最小NE浓度为(3.44 ± 1.16)m mol/L; 而休克至血管反应性降低时[ NE: (6.88 ± 2.33) m mol/L 、休克持续时间: (110 ± 47) min)] ,血浆NO浓度升高显著[ (72.9 ± 20.8) m mol/L, P< 0.01] ; 对照组假手术后90 min,血管反应性与NO浓度变化无显著意义(P > 0.05)。结论 失血性休克后期体内NO产生过多可能参与了血管反应性下降的发生。
, http://www.100md.com
中图分类号:Q463; R363
Nitric oxide involves in vascular hyporeactivity to vasoconstrictor agents in prolonged period of hemorrhagic shock
Yang Guiyuan, Zhao Kesen, Jiang Yong
Key Lab for Shock and Microcirculation of PLA, First Military Medical University, Guangzhou, 510515
Abstract: Objective and method Seven male Sprague-Dawley rats (180~220 g) were subjected to hemorrhagic shock (HS) by withdrawing blood from the left carotid artery to maintain mean arterial pressure (MAP) at 5.33 kPa. Spinotrapezius muscle was exteriorized for intravital microscopy, and vascular reactivity was determined by topical application of norepinephrine. Plasma nitrite/nitrate level was determined by cadmium reduction method. Results Compared with that before initiation of HS, plasma nitrite/nitrate level was elevated significantly when vascular reactivity decreased (110 ± 47 min after initiation of HS, P < 0.01). Conclusion Nitric oxide may contribute to the development of vascular hyporeactivity to vasoconstrictor agents in prolonged period of hemorrhagic shock.
, 百拇医药
Key words: hemorrhagic shock; vascular reactivity; nitric oxide
急性失血引起心输出量和血压下降,从而引起去甲肾上腺素(NE)、肾上腺素等内源性缩血管物质大量产生,以维持血压。在这一代偿期内,血管对缩血管物质的反应性升高;随着失血状态的持续,虽然体内缩血管物质仍维持较高水平,但血管对其反应性进行性下降,休克由代偿转为失代偿,血管扩张,引起血压进行性下降,进一步发展为复苏无效的不可逆休克。因此,血管反应性下降是休克由代偿期转为失代偿期的重要标志之一 [ 1] ,弄清其发生机制对失血性休克(HS)的救治具有重要意义。作为重要的新型舒血管分子,一氧化氮(NO)对正常和内毒素休克状态下的血管紧张性和血压发挥重要作用[ 2,3] ,而NO与失血性休克血管反应性的关系多数为试验治疗推测,未见直接测定报告。本实验复制大鼠失血性休克模型,观察休克前后血管不同反应性时血浆NO水平的变化。
, 百拇医药
1 材料和方法
1.1 休克模型复制 雄性SD大鼠(第一军医大学实验动物中心提供)12只(其中对照5只),体质量180~220 g,肌肉注射13.3%乌拉坦+0.5%氯醛糖(0.06 ml/kg) 全身麻醉,左侧股动脉和颈动脉插PE50管,分别通过三通管连接液晶血压显示器和玻璃注射器,观察血压和放血。放血前经插管注射0.1 ml肝素钠(125 000 U/L)生理盐水,5 min后打开颈动脉三通管,让血液自然流入注射器内,直至大鼠平均动脉压降至5.33 kPa (40 mmHg),在实验过程中通过间断放血、输血,以维持平均动脉压在5.33 kPa。
1.2 血管反应性观察 于插管后复制休克前,在微循环观察台上按照Gray法[4]制作大鼠左侧脊斜肌活体微循环观察标本,用Kreb液恒温滴注,用Olympus显微镜寻找三级微动脉 (A3),按Zhao法[5],分别于失血前和失血后每隔15 min,在标本上滴加50 m l酒石酸去甲肾上腺素(用Kreb液倍比稀释成10个浓度),以使三级微动脉(A3)关闭的最小NE浓度梯度表示血管反应性。于失血休克前和血管反应性下降时(对照组于微循环标本观察前后1.5 h)分别取血0.6 ml,分离血浆,冷冻保存,用于测定NO2-/NO3-。对照组大鼠于微循环观察前后90 min取血测定NO2-/NO3-,除不复制休克外,其他操作同实验组。
, 百拇医药
1.3 血浆NO2-/NO3-浓度测定 按文献方法[6~8]加以改进。
1.3.1 铜-镉还原柱制作 取镉粒(广州化学试剂厂,批号950301-3)自制镉锯屑,加入约10倍体积5%硫酸铜水溶液,轻轻搅动,5 min后弃液体,用大量蒸馏水冲洗至无明显黑色,再加约10倍体积0.1 mol/L盐酸溶液,同上处理。将此镉锯屑保存于5% NH4Cl溶液(pH 9.0, 用硼酸钠调)中备用。使用前将此镉锯屑装入约120 mm×8 mm大小的层析柱中,用0.05% NH4Cl溶液(pH 9.0, 用硼酸钠调)约10 ml平衡后即可使用。若还原性明显下降时,可分别用蒸馏水、0.1 mol/L盐酸、蒸馏水和5% NH4Cl溶液(pH 9.0)各5 ml冲洗一遍。 分别将硝酸钠和亚硝酸钠配成100~3.125 m mol/L倍比稀释的标准液,按下述测定血浆的步骤操作,测定其吸光度。比较测定值以判断铜-镉还原柱的还原性和稳定性。
, 百拇医药
1.3.2 NO2-/NO3-浓度测定 血浆样品加1/20体积的30%硫酸锌混匀。离心去蛋白沉淀。取上清加等体积5% NH4Cl溶液混匀。离心(去硫酸锌)后,取上清0.5 ml过柱。以0.05% NH4Cl(pH=9)溶液为洗脱液,弃去最初流出的1.5 ml液体,收集随后的2.5 ml洗脱液,加Griess试剂1 ml混匀。室温放置半小时后,用SHIMUDAZU紫外分光光度计在l 540 nm处比色。以倍比稀释的硝酸钠溶液经同样步骤后的检测结果绘制标准曲线,以此为据确定NO2-/NO3-的含量。
1.4 统计学处理 所有实验数据均用均数± 标准差(
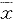 ± s)表示,统计方法根据实际情况采用t检验或方差分析。
± s)表示,统计方法根据实际情况采用t检验或方差分析。, 百拇医药
2 结果
2.1 铜-镉还原柱的还原性与稳定性 对于6.25 ~100 m mol/L的硝酸钠溶液的平均还原率为(96± 6)%。对小量正常大鼠血浆重复检测的结果显示其变异系数在4%左右。
2.2 血压及血管反应性改变 休克组自然放血,血压在5 min由正常降至5.33 kPa。休克初期血管反应性升高,随着休克状态的持续而逐渐下降,直至休克结束时,血管反应性显著低于休克前水平;假手术前后对照组血压及血管反应性未见明显改变(表1)。
表1 大鼠休克或假手术前后血管反应性变化(
 ± s)
± s)Tab. 1 Effects of hemorrhagic shock or shame operation on vascular reactivity in rats Time course (min)
, http://www.100md.com
0
30
60
110± 47
Sham (m mol/L)
3.51± 1.15
3.51± 1.15
3.51± 1.15
3.51± 1.15
Shock (m mol/L)
3.44± 1.16
1.72± 0.58*
, http://www.100md.com
3.± 1.16
6.88± 2.33*
*P< 0.01 vs that before shock
2.3 血浆NO浓度变化 失血前血浆NO浓度为(37.8± 5.3) m mol/L,当休克持续至 (110± 47) min 时,出现血管反应性显著下降,血浆NO浓度也升高[ (72.9± 20.8) m mol/L],差异具有极显著意义(P < 0.01),对照组5只大鼠插管及微循环观察1.5 h(假手术)前后,NO浓度变化[(35.26± 5.77) m mol/L ,(39.24± 3.96) m mol/L ],无显著意义(P > 0.05)。
3 讨论
近年来,NO在失血休克中的作用引起人们关注,但研究结果不尽一致。沈文梅等报道[9],犬失血休克后血浆NO并不升高,反而降低。 Kelly等[10]研究表明,大鼠失血休克5 h(不可逆期,需回输90%血液以维持血压),血浆NO2-/NO3-及诱导型NOS蛋白表达和mRNA显著升高,而休克3 h(失代偿期,需回输40%血液以维持血压)则未见升高, 据此认为NO产生增多仅见于失血休克的不可逆期。上述差异可能是由于休克模型复制方法及实验动物的差异导致实验结果的不一致。由于失血性休克后期血管反应性下降对失血性休克转归的重要影响,对其发生机制的研究引起人们重视。有研究[11]表明,这种血管低反应性的发生与肾上腺素能受体饱和、酸中毒以及神经效应器接点失效无关。刘杰等[12]报道,重症失血性休克血管反应性低下与KATP通道开放导致细胞外钙内流减少有关。Thiemermann等[1]发现,大鼠失血休克2 h及回输血后3 h时的血管低反应性可被NO合成酶(NOS)抑制剂所逆转;本实验表明,失血休克至血管反应性降低时,引起细动脉收缩的NE浓度增高2倍,而血浆NO浓度升高也为休克前的2倍,说明NO参与了失血休克后期血管反应性降低的发生。急性失血本身是一种应激,导致缩血管活性物质大量产生,另外,休克初期细胞损伤较轻,代偿机制较完备,血管反应性升高显著(本实验也观察到这一现象)。随着失血状态的持续,通过某种机制导致舒血管活性物质,如NO等的增加,使其优势逐渐趋于明显,虽然体内缩血管物质仍处于较高水平,但由于缺血、缺氧等原因,细胞损伤越来越明显,机体由代偿转为失代偿,从而导致血管反应性下降。
, 百拇医药
*国家自然科学基金(39870332)
作者简介:杨贵远,男,1964年出生,1988年7月毕业于解放军农牧大学,硕士,讲师
参考文献
1 Thiemermann C, Szabo C, Jane A et al. Vascular hyporeactivity to vasoconstrictor agents and hemodynamic decompensation in hemorrhagic shock is mediated by nitric oxide. Proc Natl Acad Sci USA, 1993, 90: 267
2 Rees DD, Palmer RM, Moncada S. Role of endothelium-derived nitric oxide in the regulation of blood pressure. Proc Natl Acad Sci USA, 1989, 86: 3375
, http://www.100md.com
3 Kilbourn RG, Jubran A, Gross SS et al. Reversal of endotoxin-mediated shock by NG-methyl-L-arginine, an inhibitor of nitric oxide synthesis. Biochem Biophys Rews Commun, 1990,172: 1132
4 Gray SD. Rat spinotrapezius muscle preparation for microscopic observation of the terminal vascular bed. Microvas Res, 1973, 5: 395
5 Zhao KS, Junker D, Delano FA et al. Microvascular adjustments during irreversible hemorrhagic shock in rat skeletal muscle. Microvas Res, 1985, 30: 143
, 百拇医药
6 Green LC, Wagner DA, Glogowski J et al. Analysis of nitrate, nitrite, and [15N] nitrate in biological fluids. Anal Biochem, 1982,126: 131
7 Hegesh E, Shiloah J. Blood nitrates and infantile methemoglobinemia. Clin Chim Acta, 1982, 125: 107
8 石胜军,吴坤莹. 一氧化氮对烧伤休克大鼠微循环的作用. 微循环学杂志,1997,7(2):1
9 沈文梅,王成彬,田亚平等. 失血性休克犬血液一氧化氮浓度的变化. 中华医学杂志,1996,76(8):603
10 Kelly E, Shah NS, Morgan NN et al. Physiologic and molecular characterization of the role of nitric oxide in hemorrhagic shock: evidence that type II nitric oxide synthase does not regulate vascular decompensation. Shock, 1997, 7(3): 157
11 Perbeck L, Hedqvist P. Blood pressure responses associated with hemorrhagic shock in anesthetized rats. Acta Chir Scand, 1982,148(1): 3
12 刘 杰,赵克森. 钙动力学变化在重症休克血管反应性低下发生中的作用. 中华创伤杂志,1997,13(6):33
(收稿日期:1998-07-03), 百拇医药