外源性基因在血管球囊损伤后新生内膜中的表达
作者:祁哲 高润霖 钱杰 宋杰 司文学 陈纪林 陈在嘉
单位:祁哲 高润霖 钱杰 宋杰 陈纪林 陈在嘉 北京市,中国医学科学院 中国协和医科大学 心血管病研究所 阜外心血管病医院 冠心病研究室 1000347;司文学 病理科
关键词:动物,转基因 β半乳糖苷酶类
摘要 目的摘要 目的:应用重组腺病毒载体介导的β-半乳糖苷酶基因(LacZ)标记基因,探讨外源性基因在股动脉血管球囊损伤后,新生内膜中的表达。方法:用犬的股动脉内皮损伤模型,4周后经犬颈外动脉插管至股动脉内皮损伤处,并导入重组腺病毒载体介导的LacZ标记基因。转基因7天后,处死动物。β-半乳糖苷酶表达由x-Gal染色评价。经显微镜观察:在血管球囊损伤后,新生内膜中所见的蓝染细胞即为β-半乳糖苷酶表达阳性。结果:β-半乳糖苷酶表达出现在新生内膜、部分中膜和部分修复的内皮细胞。血管损伤后,新生内膜中平滑肌细胞转染率为100%。对照血管和远处脏器未显示β-半乳糖苷酶的表达。结论:在重组腺病毒载体的介导下,外源性基因可以在新生内膜中高效率地表达,新生内膜中的平滑肌细胞为基因治疗的靶细胞。
, 百拇医药
In Vivo Gene Transfer and Expression in Thickening Neointima of Balloon-injured Blood Vessels
Qi Zhe,Gao Runlin,Qian Jie,et al.
Department of Coronary Heart Disease,Cardiovascular Institute and Fu Wai Hospital,CAMS and PUMC,Beijing(100037)
Abstract Objective:To study the expression of exogenous gene in thickening neointima of balloon-injured blood vessels,we transferred the marker gene LacZ to balloon-injured femoral artery of dogs through the mediation of recombinant adenovirus.Methods:At first,a balloon-injured femoral artery model of dogs was made.Four weeks later,we inserted the double-balloon catheter through external carotid artery to injured sites of femoral artery.While the balloon was inflated,adenovirus-mediated LacZ(Adex1SRLacZL)gene was transferred to the injured vessels.Seven days later,the animals were sacrificed.x-Gal blue stain was used to evaluate the expression of β-galactosidase.The specimen was observed by microscope,the blue stain represents positive results.Results:The expression of β-galactosidase appears in thickening neointima,some media and some repaired endothelium cells.It is expressed in 100% of smooth muscle cells of the neointima,while the control group and distant organs has none of the expression of β-galactosidase.Conclusion:Through the mediation of recombinant adenovirus,Adex1SRLacZL gene can be expressed with high transferring efficiency in thickening neointima,which is good target cells for gene therapy.
, 百拇医药
Key words Animals,transgenic;Beta-galactosidase
基因治疗是将外源性目的基因,高效率地转染至体内靶细胞,通过基因表达,达到治疗的目的。已有研究表明,血管平滑肌细胞(VSMC)具有摄取和表达外源性基因的功能[1~3]。血管球囊损伤后,新生内膜中的平滑肌细胞(SMC),从理论上讲,是来自中膜的SMC,其是否也能摄取与表达外源性基因,目前尚未见报道。本实验将重组腺病毒载体介导的β-半乳糖苷酶基因(LacZ),导入新生的血管内膜中,并观察LacZ标记基因在血管球囊损伤后新生内膜中的表达。
1 材料和方法
重组腺病毒载体的制备:腺病毒载体的制作,按文献[4,5]方法,含有LacZ标记基因的腺病毒载体,为人类腺病毒5型。在其腺病毒序列中除去了E1a、E1b和E3区。所获得的重组腺病毒载体携带有LacZ标记基因,其表达产物为特异性β-半乳糖苷酶。
, 百拇医药
犬股动脉粥样硬化模型的制备:1997年5月至10月选取杂种犬6只,雌雄不拘,体重约15 kg。分为对照组与转基因组,各3只。苯巴比妥钠静脉麻醉(30 mg/kg),按Block等[6]的方法,在透视下,经犬右颈外动脉插入4F Fogarty导管至左、右股动脉,充盈气囊0.5 ml,反复剥脱动脉内皮3次。继之结扎颈外动脉,缝合切口,普通饲料喂养4周。
在体血管局部转基因:犬股动脉内皮损伤4周后,苯巴比妥钠麻醉,在透视下,经犬右颈总动脉插入7F双球囊导管分别至左、右股动脉内膜损伤处,充盈双球囊导管,形成导基因间腔。经侧孔用生理盐水冲洗间腔后,转基因组向间腔内注入0.5 ml含1×109 pfu/ml的重组腺病毒载体介导的LacZ标记基因。留置30分钟后,再将其抽出,之后松开气囊,恢复血流。对照组:向间腔内注入不含LacZ标记基因的腺病毒空载载体。其他操作同转基因组,普通饲料喂养7天。
组织化学分析:基因转染后7天,注射过量的苯巴比妥钠处死动物。迅速取出双侧股动脉,用磷酸盐缓冲液(PBS)冲洗后,以2%福尔马林和0.2%戊二醛固定30分钟。将标本放入x-Gal染色液中,在37℃恒温箱中孵育6小时后再以2%福尔马林和0.2%戊二醛固定24小时。经脱水、石蜡包埋、切片、苏木素伊红复染,以镜下观察到蓝染的细胞为β-半乳糖苷酶表达阳性。同样采集动物的心、肝、脾、肺、肾等主要脏器,用同样方法处理。最后镜下观察。
, 百拇医药
2 结果
在腺病毒载体介导的LacZ标记基因转染血管7天后,经x-Gal染色,显微镜下观察显示:股动脉内皮损伤后新生内膜中,增厚内膜全层的SMC均能良好地表达β-半乳糖苷酶,全层SMC均被蓝染。在内弹力膜下方,中膜浅层亦有大量被蓝染的细胞。部分修复的内皮细胞亦被蓝染(图1),β-半乳糖苷酶表达阳性。而导入不含LacZ标记基因的空载腺病毒对照组,在股动脉内膜增厚的部位未见蓝染的细胞(图2),β-半乳糖苷酶表达阴性。经重组腺病毒载体介导的LacZ标记基因,在血管新生内膜的SMC中仍能高效地转染并表达。
图1 内膜拉伤后4周 Lac Z标记基因转染后7天(x-Gal染色+苏木素伊红染色×117)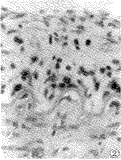
, 百拇医药
图2 内膜拉伤后4周,内膜明显增生(x-Gal染色+苏木素伊红染色×117)
而对照组心、肝、脾、肺、肾等脏器,均未显示β-半乳糖苷酶的表达,x-Gal染色阴性。
3 讨论
如何将外源性基因高效地导入体内靶细胞,是基因治疗的关键。但必须有能高效转染的载体。腺病毒载体,具有复制缺陷、高效转染等优点,被视为有希望的载体。已有报道:正常兔髂动脉,内皮细胞完整状态时,外源性β-半乳糖苷酶基因表达仅局限于内皮细胞。球囊损伤致内皮细胞剥脱后,明显促进中层SMC转染。而在动脉粥样硬化的血管,其转染效率明显降低。本实验将重组腺病毒载体介导的LacZ标记基因,导入血管球囊损伤后内膜明显增厚的部位,且脱落的内皮细胞已有部分修复。但在重组腺病毒载体的介导下,修复的内皮细胞仍可表达外源性基因。新生内膜中的SMC仍可高效地转染并表达外源性基因。部分中膜SMC亦可转染并表达外源性基因。提示:外源性基因在重组腺病毒载体的介导下,不仅可以高效地转染内皮细胞剥脱后正常动脉中膜SMC,且对动脉粥样硬化,内膜明显增厚的血管亦能高效地转染。新生内膜中的SMC仍为基因治疗的靶细胞。重组腺病毒载体在基因治疗方面具有独特的优越性。
, 百拇医药
作者简介:祁哲 女 43岁 副主任医师 硕士
参考文献
1 Nabel EG,Pompilli VJ,Plartz GE,et al.Gene transfer and vascular disease.Cardiovasc Res,1994,28:445—452.
2 Guzman RJ,Lemarchand P,Crystal KG,et al.Effective and selective adenovirus-mediated gene transfer into vascular neointima.Circulation,1993,88:2838—2848.
3 Lee SW,Trapnell BC,Rade JJ,et al.In vivo adenoviral vectormediated gene transfer in balloon-injured rat carotid arteries.Circ Res,1993,73:797—807.
, 百拇医药
4 Li JJ,Veno H,Pan Y,et al.Percutaneous transluminal gene transfer into canine myocardium in vivo by replication defective adenovirus.Cardiovasc Res,1995,30:97—105.
5 Li JJ,Veno H,Tomita H,et al.Adenovirus mediated arterial gene transfer does not require prior injures for submaximal gene expression.Gene Ther,1995,2:351—354.
6 Block PC,Banghman KI,Pasterank RC,et al.Transluminal angioplasty:correlation of morphologic and angiographic findings in an experimental model.Circulation,1980,61:778—785.
(收稿:1998-05-11 修回:1998-08-27), 百拇医药
单位:祁哲 高润霖 钱杰 宋杰 陈纪林 陈在嘉 北京市,中国医学科学院 中国协和医科大学 心血管病研究所 阜外心血管病医院 冠心病研究室 1000347;司文学 病理科
关键词:动物,转基因 β半乳糖苷酶类
摘要 目的摘要 目的:应用重组腺病毒载体介导的β-半乳糖苷酶基因(LacZ)标记基因,探讨外源性基因在股动脉血管球囊损伤后,新生内膜中的表达。方法:用犬的股动脉内皮损伤模型,4周后经犬颈外动脉插管至股动脉内皮损伤处,并导入重组腺病毒载体介导的LacZ标记基因。转基因7天后,处死动物。β-半乳糖苷酶表达由x-Gal染色评价。经显微镜观察:在血管球囊损伤后,新生内膜中所见的蓝染细胞即为β-半乳糖苷酶表达阳性。结果:β-半乳糖苷酶表达出现在新生内膜、部分中膜和部分修复的内皮细胞。血管损伤后,新生内膜中平滑肌细胞转染率为100%。对照血管和远处脏器未显示β-半乳糖苷酶的表达。结论:在重组腺病毒载体的介导下,外源性基因可以在新生内膜中高效率地表达,新生内膜中的平滑肌细胞为基因治疗的靶细胞。
, 百拇医药
In Vivo Gene Transfer and Expression in Thickening Neointima of Balloon-injured Blood Vessels
Qi Zhe,Gao Runlin,Qian Jie,et al.
Department of Coronary Heart Disease,Cardiovascular Institute and Fu Wai Hospital,CAMS and PUMC,Beijing(100037)
Abstract Objective:To study the expression of exogenous gene in thickening neointima of balloon-injured blood vessels,we transferred the marker gene LacZ to balloon-injured femoral artery of dogs through the mediation of recombinant adenovirus.Methods:At first,a balloon-injured femoral artery model of dogs was made.Four weeks later,we inserted the double-balloon catheter through external carotid artery to injured sites of femoral artery.While the balloon was inflated,adenovirus-mediated LacZ(Adex1SRLacZL)gene was transferred to the injured vessels.Seven days later,the animals were sacrificed.x-Gal blue stain was used to evaluate the expression of β-galactosidase.The specimen was observed by microscope,the blue stain represents positive results.Results:The expression of β-galactosidase appears in thickening neointima,some media and some repaired endothelium cells.It is expressed in 100% of smooth muscle cells of the neointima,while the control group and distant organs has none of the expression of β-galactosidase.Conclusion:Through the mediation of recombinant adenovirus,Adex1SRLacZL gene can be expressed with high transferring efficiency in thickening neointima,which is good target cells for gene therapy.
, 百拇医药
Key words Animals,transgenic;Beta-galactosidase
基因治疗是将外源性目的基因,高效率地转染至体内靶细胞,通过基因表达,达到治疗的目的。已有研究表明,血管平滑肌细胞(VSMC)具有摄取和表达外源性基因的功能[1~3]。血管球囊损伤后,新生内膜中的平滑肌细胞(SMC),从理论上讲,是来自中膜的SMC,其是否也能摄取与表达外源性基因,目前尚未见报道。本实验将重组腺病毒载体介导的β-半乳糖苷酶基因(LacZ),导入新生的血管内膜中,并观察LacZ标记基因在血管球囊损伤后新生内膜中的表达。
1 材料和方法
重组腺病毒载体的制备:腺病毒载体的制作,按文献[4,5]方法,含有LacZ标记基因的腺病毒载体,为人类腺病毒5型。在其腺病毒序列中除去了E1a、E1b和E3区。所获得的重组腺病毒载体携带有LacZ标记基因,其表达产物为特异性β-半乳糖苷酶。
, 百拇医药
犬股动脉粥样硬化模型的制备:1997年5月至10月选取杂种犬6只,雌雄不拘,体重约15 kg。分为对照组与转基因组,各3只。苯巴比妥钠静脉麻醉(30 mg/kg),按Block等[6]的方法,在透视下,经犬右颈外动脉插入4F Fogarty导管至左、右股动脉,充盈气囊0.5 ml,反复剥脱动脉内皮3次。继之结扎颈外动脉,缝合切口,普通饲料喂养4周。
在体血管局部转基因:犬股动脉内皮损伤4周后,苯巴比妥钠麻醉,在透视下,经犬右颈总动脉插入7F双球囊导管分别至左、右股动脉内膜损伤处,充盈双球囊导管,形成导基因间腔。经侧孔用生理盐水冲洗间腔后,转基因组向间腔内注入0.5 ml含1×109 pfu/ml的重组腺病毒载体介导的LacZ标记基因。留置30分钟后,再将其抽出,之后松开气囊,恢复血流。对照组:向间腔内注入不含LacZ标记基因的腺病毒空载载体。其他操作同转基因组,普通饲料喂养7天。
组织化学分析:基因转染后7天,注射过量的苯巴比妥钠处死动物。迅速取出双侧股动脉,用磷酸盐缓冲液(PBS)冲洗后,以2%福尔马林和0.2%戊二醛固定30分钟。将标本放入x-Gal染色液中,在37℃恒温箱中孵育6小时后再以2%福尔马林和0.2%戊二醛固定24小时。经脱水、石蜡包埋、切片、苏木素伊红复染,以镜下观察到蓝染的细胞为β-半乳糖苷酶表达阳性。同样采集动物的心、肝、脾、肺、肾等主要脏器,用同样方法处理。最后镜下观察。
, 百拇医药
2 结果
在腺病毒载体介导的LacZ标记基因转染血管7天后,经x-Gal染色,显微镜下观察显示:股动脉内皮损伤后新生内膜中,增厚内膜全层的SMC均能良好地表达β-半乳糖苷酶,全层SMC均被蓝染。在内弹力膜下方,中膜浅层亦有大量被蓝染的细胞。部分修复的内皮细胞亦被蓝染(图1),β-半乳糖苷酶表达阳性。而导入不含LacZ标记基因的空载腺病毒对照组,在股动脉内膜增厚的部位未见蓝染的细胞(图2),β-半乳糖苷酶表达阴性。经重组腺病毒载体介导的LacZ标记基因,在血管新生内膜的SMC中仍能高效地转染并表达。

图1 内膜拉伤后4周 Lac Z标记基因转染后7天(x-Gal染色+苏木素伊红染色×117)

, 百拇医药
图2 内膜拉伤后4周,内膜明显增生(x-Gal染色+苏木素伊红染色×117)
而对照组心、肝、脾、肺、肾等脏器,均未显示β-半乳糖苷酶的表达,x-Gal染色阴性。
3 讨论
如何将外源性基因高效地导入体内靶细胞,是基因治疗的关键。但必须有能高效转染的载体。腺病毒载体,具有复制缺陷、高效转染等优点,被视为有希望的载体。已有报道:正常兔髂动脉,内皮细胞完整状态时,外源性β-半乳糖苷酶基因表达仅局限于内皮细胞。球囊损伤致内皮细胞剥脱后,明显促进中层SMC转染。而在动脉粥样硬化的血管,其转染效率明显降低。本实验将重组腺病毒载体介导的LacZ标记基因,导入血管球囊损伤后内膜明显增厚的部位,且脱落的内皮细胞已有部分修复。但在重组腺病毒载体的介导下,修复的内皮细胞仍可表达外源性基因。新生内膜中的SMC仍可高效地转染并表达外源性基因。部分中膜SMC亦可转染并表达外源性基因。提示:外源性基因在重组腺病毒载体的介导下,不仅可以高效地转染内皮细胞剥脱后正常动脉中膜SMC,且对动脉粥样硬化,内膜明显增厚的血管亦能高效地转染。新生内膜中的SMC仍为基因治疗的靶细胞。重组腺病毒载体在基因治疗方面具有独特的优越性。
, 百拇医药
作者简介:祁哲 女 43岁 副主任医师 硕士
参考文献
1 Nabel EG,Pompilli VJ,Plartz GE,et al.Gene transfer and vascular disease.Cardiovasc Res,1994,28:445—452.
2 Guzman RJ,Lemarchand P,Crystal KG,et al.Effective and selective adenovirus-mediated gene transfer into vascular neointima.Circulation,1993,88:2838—2848.
3 Lee SW,Trapnell BC,Rade JJ,et al.In vivo adenoviral vectormediated gene transfer in balloon-injured rat carotid arteries.Circ Res,1993,73:797—807.
, 百拇医药
4 Li JJ,Veno H,Pan Y,et al.Percutaneous transluminal gene transfer into canine myocardium in vivo by replication defective adenovirus.Cardiovasc Res,1995,30:97—105.
5 Li JJ,Veno H,Tomita H,et al.Adenovirus mediated arterial gene transfer does not require prior injures for submaximal gene expression.Gene Ther,1995,2:351—354.
6 Block PC,Banghman KI,Pasterank RC,et al.Transluminal angioplasty:correlation of morphologic and angiographic findings in an experimental model.Circulation,1980,61:778—785.
(收稿:1998-05-11 修回:1998-08-27), 百拇医药