血管内皮生长因子合成肽的设计与合成
作者:杨西川 王大章 郑光勇 房思炼
单位:610041 华西医科大学口腔医学院颌面外科学教研室;(杨西川现在重庆第三军医大学大坪医院颌面整形外科工作)
关键词:抗原表位;血管内皮生长因子;人工合成肽;计算机
华西口腔医学杂志990119 摘要 目的:预测血管内皮生长因子(VEGF)连续性表位,利用VEGF合成肽制备抗VEGF合成肽单克隆抗体。方法:根据VEGF189氨基酸序列,采用抗原指数方案及Goldkey软件,预测VEGF表位,确定合成肽序列,在430 A固相自动肽合成仪上合成。结果:VEGF氨基端1~26残基被确定为合成肽序列并合成。结论:VEGF抗原表位的预测与合成,为利用VEGF合成肽制备抗VEGF合成肽单克隆抗体提供了一条有效的途径。
Design and Synthesizing of Human Vascular Endothelial
, 百拇医药
Growth Factor(VEGF) Peptide
Yang Xichuan, Wang Dazhang, Zheng Guangyong, et al
Department of Oral and Maxillofacial
College of Stomatology, West China University of Medical Sciences
Abstract Objective: To predict continuous epitopes of VEGF using synthetic peptide of VEGF as antigen to produce anti-VEGF-peptide monoclonal antibody.Methods: According to amino sequence of VEGF189, antigen index program and Goldkey soft were used to predict VEGF epitopes, and the peptide containing one of predicted epitopes was synthesized by 430A Peptide Synthesizer.Results: The NH2-terminal 1~26 amino acid sequence of VEGF was determined as synthetic peptide and synthesized.Conclusion: The predicted epitope of VEGF was synthesized, which provided an effective method when lacking of VEGF.
, http://www.100md.com
Key words: antigen epitope VEGF synthetic peptide cemputer
实体瘤的生长及转移依赖新生血管的形成[1],许多实体瘤细胞均有血管内皮生长因子(VEGF)的过量表达[2,3]。业已证明,VEGF在肿瘤血管生成过程中起关键作用[4],利用VEGF单抗抑制VEGF活性可显著抑制实体瘤的生长[5]。但VEGF来源困难。本研究旨在利用合成肽技术,设计与合成人VEGF合成肽,为用以制备抗VEGF单抗提供一条新的有效途径。已知VEGF由于其mRNA剪接方式的不同,存在5种VEGF变异体,即VEGF121、VEGF165、VEGF145、VEGF189、VEGF206。后3种与肝素有很高亲和力,细胞分泌后直接保留在细胞膜肝素样分子上,或储存在细胞间质内,仅VEGF121、VEGF165为可溶性蛋白,易扩散到达靶细胞,与VEGF的生物学活性密切相关,两者不同之处可能是受体识别的不同,生物学性质未见有差异[6]。VEGF165的110、123、163位氨基酸为碱性氨基酸,可能与肝素结合相关[7]。因此,合成肽的设计界定在N-端1~121氨基酸内(各变异体N-端序列均与此相同)。
, http://www.100md.com
1 材料和方法
1.1 人VEGF189氨基酸序列
APMAEGGGQNHHEVVKFMDVYQRSYCHPIETLVDIFQEYPDEIEYIFKPSCVPLM
RCGGCCNDEGLECVPTEESNITMQIMRIKPHQGQHIGEMSFLQHNKCECRPKKDR
ARQEKKSVRGKGKGQKRKRKKSRYKSWSVPCGPCSERRKHLFVQDPQTCKCSCK
NTDSRCKARQLELNERTCRCDKPRR
1.2 合成肽的设计
采用抗原指数方案[8]和Goldkey软件中亲水方案、易接近度方案及蛋白质二级结构预测方案,进行综合分析、判断。
, 百拇医药
1.3 合成肽的合成、鉴定
采用固相化学合成法在430A肽合成仪(Applied-Biosystems PE公司,美国)上合成。用fmoc氨基酸为原料,采用固定羧基端向氨基端递增的方式。最后用氟化氢(HF)法切除保护基及树脂,反应2小时后,抽尽HF得脱保护基产品与树脂的混合物,以乙酸乙酯加0.1%乙酸反复萃取,分离后冷冻抽干,获得粗肽产物。用Sephadex G-10将肽与盐及保护基分开。以1%的醋酸为洗脱液,柱床体积350 ml。粗肽溶于2%醋酸,流速20 ml/h。脱盐后的粗肽用高压液相色谱法进一步纯化。反复收集HPLC中的最大峰,冷冻抽干,再经HPLC呈单峰。鉴定用Bio Focus-3000毛细电泳仪(Bio-RAD公司,美国)区带电泳法进行。氨基酸组份分析仪(Beckmen 3000,美国)上进行组份分析。
2 结 果
2.1 合成肽的设计
, http://www.100md.com
抗原指数方案(10残基窗口)、亲水方案(7残基窗口)、表面可及方案(7残基窗口)与蛋白质二级结构预测方案运算结果分别见图1~3,表1。结果共发现6个连续性表位,标为:P1(10~22),P2(27~36),P3(39~49),P4(66~75),P5(78~95),P6(103~112)。VEGF第75位氨基酸为谷氨酰胺,系糖基化位点,多糖可能掩盖该位点,故P4可不考虑。为增加成功率,首选N-端的P1,因末端比中间更柔韧、更亲水。结合VEGF二级结构,21~25有一β-转角,因转角常在蛋白质和多肽中作识别位点[9],故合成肽应设计为P1 0~25,已知肽段长度与抗原性呈正比,最终合成肽确定为N-端1~26残基(26位系半胱氨酸,为与载体蛋白的共价结合点)。
表1 VEGF表位预测结果 方案
预测的抗原表位
抗原指数方案
, 百拇医药
10~19
27~36
40~49
66~75
82~91
103~112
亲水方案
15~21
31~37
42~48
76~82
91~97
易接近度方案
, 百拇医药
7~13
18~24
36~42
70~76
84~90
107~113
综合判断方案
10~22
27~36
39~49
66~75
78~95
103~112
, 百拇医药
图1 抗原指数方案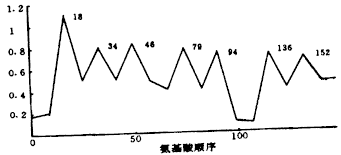
图2 亲水方案
图3 易接近方案
2.2 合成肽鉴定
毛细管电泳分析结果见图4。经积分运算,主峰面积占总面积97.4%,其合成效率为97.4%,氨基酸组份分析结果显示与理论预测值相符。
图4 VEGF合成肽毛细管电泳图
3 讨 论
, http://www.100md.com
本文主要采用抗原指数方案,结合亲水方案、易接近度方案、二级结构预测方案等进行多参数综合分析,设计了VEGF中一段多肽为合成序列,该多肽制备的单抗被证明有生物学活性,说明其序列包含有VEGF的功能位点,或VEGF单克隆抗体与VEGF结合后对其功能位点有空间位阻作用。尽管目前蛋白构象特征尚无法从一级结构中完全获得,表位预测也局限在连续性位点,但表位预测工作在分子生物学领域仍具有重要意义,如对多肽疫苗的设计,分子识别位点的研究,单抗的筛选等都是有效的辅助手段。本文所用的抗原指数方案,最初用于病毒蛋白的表位预测,作者首次用于非病毒蛋白表位预测,结果提示该方案可能具有较大的应用范围,结合多参数综合判断,成功率可能更高。近来,文献报道[9]一种新的多参数预测方案,预测效率达47.4%。可以预想,随着越来越多的蛋白质晶体空间结构的揭示,抗原表位预测工作也必臻完善。
本课题由国家自然科学基金资助(编号 395707687)
参考文献
, http://www.100md.com
1 Folkman J, Klagsbrun M. Angiogenicfactors. Science, 1987, 235(4787):442~447
2 Brown LF, Berse B. Increased expression of vascular permeability factor(vascular endothelial growth factor) and its receptors in kidney and bladder carcinomas. Am J Pathol,1993,143(5):1255~1262
3 Brown LF, Berse B. Expression of vascular endothelial growth factor and its receptors in adenocarcinomas of the gastroitestinal tract. Cancer Res, 1993,53(19):4727~4735
, 百拇医药
4 Dvorak HF, Sioussat TM. Distribution of vascular endothelial growth factor in tumor bllod vessels. J Exp Med, 1991, 174(5):1275~1278
5 Kim KJ, Li B, Winer J. Inhibition of vascular endothelial growth factor induced angiogenesis suppress tumor growth in vivo. Nature,1993,362(6423):841~844
6 Neufeld G, Cohen T. Similarities and differes between the vascular endothelial growth factor splice variant cancer. Cancer Metastasis Rev,1996,15(2):153~158
, 百拇医药
7 Ferrara N, Houck K. Moleculer and biological properties of the vascular endothlial growth factor family of proteins. Endocr Rev,1992,3(1):18~32
8 Wu Yuzhuang, Zhu Xihua. A new approach for B-cell epitope prprediction in viral proteins. Chin Sci Bull,1995,40:761~764
9 万 涛,孙 涛.蛋白顺序性抗原决定族的多参数综合预测.中国免疫学杂志,1997,13(6):329~333
(1998-09-04收稿), 百拇医药
单位:610041 华西医科大学口腔医学院颌面外科学教研室;(杨西川现在重庆第三军医大学大坪医院颌面整形外科工作)
关键词:抗原表位;血管内皮生长因子;人工合成肽;计算机
华西口腔医学杂志990119 摘要 目的:预测血管内皮生长因子(VEGF)连续性表位,利用VEGF合成肽制备抗VEGF合成肽单克隆抗体。方法:根据VEGF189氨基酸序列,采用抗原指数方案及Goldkey软件,预测VEGF表位,确定合成肽序列,在430 A固相自动肽合成仪上合成。结果:VEGF氨基端1~26残基被确定为合成肽序列并合成。结论:VEGF抗原表位的预测与合成,为利用VEGF合成肽制备抗VEGF合成肽单克隆抗体提供了一条有效的途径。
Design and Synthesizing of Human Vascular Endothelial
, 百拇医药
Growth Factor(VEGF) Peptide
Yang Xichuan, Wang Dazhang, Zheng Guangyong, et al
Department of Oral and Maxillofacial
College of Stomatology, West China University of Medical Sciences
Abstract Objective: To predict continuous epitopes of VEGF using synthetic peptide of VEGF as antigen to produce anti-VEGF-peptide monoclonal antibody.Methods: According to amino sequence of VEGF189, antigen index program and Goldkey soft were used to predict VEGF epitopes, and the peptide containing one of predicted epitopes was synthesized by 430A Peptide Synthesizer.Results: The NH2-terminal 1~26 amino acid sequence of VEGF was determined as synthetic peptide and synthesized.Conclusion: The predicted epitope of VEGF was synthesized, which provided an effective method when lacking of VEGF.
, http://www.100md.com
Key words: antigen epitope VEGF synthetic peptide cemputer
实体瘤的生长及转移依赖新生血管的形成[1],许多实体瘤细胞均有血管内皮生长因子(VEGF)的过量表达[2,3]。业已证明,VEGF在肿瘤血管生成过程中起关键作用[4],利用VEGF单抗抑制VEGF活性可显著抑制实体瘤的生长[5]。但VEGF来源困难。本研究旨在利用合成肽技术,设计与合成人VEGF合成肽,为用以制备抗VEGF单抗提供一条新的有效途径。已知VEGF由于其mRNA剪接方式的不同,存在5种VEGF变异体,即VEGF121、VEGF165、VEGF145、VEGF189、VEGF206。后3种与肝素有很高亲和力,细胞分泌后直接保留在细胞膜肝素样分子上,或储存在细胞间质内,仅VEGF121、VEGF165为可溶性蛋白,易扩散到达靶细胞,与VEGF的生物学活性密切相关,两者不同之处可能是受体识别的不同,生物学性质未见有差异[6]。VEGF165的110、123、163位氨基酸为碱性氨基酸,可能与肝素结合相关[7]。因此,合成肽的设计界定在N-端1~121氨基酸内(各变异体N-端序列均与此相同)。
, http://www.100md.com
1 材料和方法
1.1 人VEGF189氨基酸序列
APMAEGGGQNHHEVVKFMDVYQRSYCHPIETLVDIFQEYPDEIEYIFKPSCVPLM
RCGGCCNDEGLECVPTEESNITMQIMRIKPHQGQHIGEMSFLQHNKCECRPKKDR
ARQEKKSVRGKGKGQKRKRKKSRYKSWSVPCGPCSERRKHLFVQDPQTCKCSCK
NTDSRCKARQLELNERTCRCDKPRR
1.2 合成肽的设计
采用抗原指数方案[8]和Goldkey软件中亲水方案、易接近度方案及蛋白质二级结构预测方案,进行综合分析、判断。
, 百拇医药
1.3 合成肽的合成、鉴定
采用固相化学合成法在430A肽合成仪(Applied-Biosystems PE公司,美国)上合成。用fmoc氨基酸为原料,采用固定羧基端向氨基端递增的方式。最后用氟化氢(HF)法切除保护基及树脂,反应2小时后,抽尽HF得脱保护基产品与树脂的混合物,以乙酸乙酯加0.1%乙酸反复萃取,分离后冷冻抽干,获得粗肽产物。用Sephadex G-10将肽与盐及保护基分开。以1%的醋酸为洗脱液,柱床体积350 ml。粗肽溶于2%醋酸,流速20 ml/h。脱盐后的粗肽用高压液相色谱法进一步纯化。反复收集HPLC中的最大峰,冷冻抽干,再经HPLC呈单峰。鉴定用Bio Focus-3000毛细电泳仪(Bio-RAD公司,美国)区带电泳法进行。氨基酸组份分析仪(Beckmen 3000,美国)上进行组份分析。
2 结 果
2.1 合成肽的设计
, http://www.100md.com
抗原指数方案(10残基窗口)、亲水方案(7残基窗口)、表面可及方案(7残基窗口)与蛋白质二级结构预测方案运算结果分别见图1~3,表1。结果共发现6个连续性表位,标为:P1(10~22),P2(27~36),P3(39~49),P4(66~75),P5(78~95),P6(103~112)。VEGF第75位氨基酸为谷氨酰胺,系糖基化位点,多糖可能掩盖该位点,故P4可不考虑。为增加成功率,首选N-端的P1,因末端比中间更柔韧、更亲水。结合VEGF二级结构,21~25有一β-转角,因转角常在蛋白质和多肽中作识别位点[9],故合成肽应设计为P1 0~25,已知肽段长度与抗原性呈正比,最终合成肽确定为N-端1~26残基(26位系半胱氨酸,为与载体蛋白的共价结合点)。
表1 VEGF表位预测结果 方案
预测的抗原表位
抗原指数方案
, 百拇医药
10~19
27~36
40~49
66~75
82~91
103~112
亲水方案
15~21
31~37
42~48
76~82
91~97
易接近度方案
, 百拇医药
7~13
18~24
36~42
70~76
84~90
107~113
综合判断方案
10~22
27~36
39~49
66~75
78~95
103~112

, 百拇医药
图1 抗原指数方案

图2 亲水方案

图3 易接近方案
2.2 合成肽鉴定
毛细管电泳分析结果见图4。经积分运算,主峰面积占总面积97.4%,其合成效率为97.4%,氨基酸组份分析结果显示与理论预测值相符。

图4 VEGF合成肽毛细管电泳图
3 讨 论
, http://www.100md.com
本文主要采用抗原指数方案,结合亲水方案、易接近度方案、二级结构预测方案等进行多参数综合分析,设计了VEGF中一段多肽为合成序列,该多肽制备的单抗被证明有生物学活性,说明其序列包含有VEGF的功能位点,或VEGF单克隆抗体与VEGF结合后对其功能位点有空间位阻作用。尽管目前蛋白构象特征尚无法从一级结构中完全获得,表位预测也局限在连续性位点,但表位预测工作在分子生物学领域仍具有重要意义,如对多肽疫苗的设计,分子识别位点的研究,单抗的筛选等都是有效的辅助手段。本文所用的抗原指数方案,最初用于病毒蛋白的表位预测,作者首次用于非病毒蛋白表位预测,结果提示该方案可能具有较大的应用范围,结合多参数综合判断,成功率可能更高。近来,文献报道[9]一种新的多参数预测方案,预测效率达47.4%。可以预想,随着越来越多的蛋白质晶体空间结构的揭示,抗原表位预测工作也必臻完善。
本课题由国家自然科学基金资助(编号 395707687)
参考文献
, http://www.100md.com
1 Folkman J, Klagsbrun M. Angiogenicfactors. Science, 1987, 235(4787):442~447
2 Brown LF, Berse B. Increased expression of vascular permeability factor(vascular endothelial growth factor) and its receptors in kidney and bladder carcinomas. Am J Pathol,1993,143(5):1255~1262
3 Brown LF, Berse B. Expression of vascular endothelial growth factor and its receptors in adenocarcinomas of the gastroitestinal tract. Cancer Res, 1993,53(19):4727~4735
, 百拇医药
4 Dvorak HF, Sioussat TM. Distribution of vascular endothelial growth factor in tumor bllod vessels. J Exp Med, 1991, 174(5):1275~1278
5 Kim KJ, Li B, Winer J. Inhibition of vascular endothelial growth factor induced angiogenesis suppress tumor growth in vivo. Nature,1993,362(6423):841~844
6 Neufeld G, Cohen T. Similarities and differes between the vascular endothelial growth factor splice variant cancer. Cancer Metastasis Rev,1996,15(2):153~158
, 百拇医药
7 Ferrara N, Houck K. Moleculer and biological properties of the vascular endothlial growth factor family of proteins. Endocr Rev,1992,3(1):18~32
8 Wu Yuzhuang, Zhu Xihua. A new approach for B-cell epitope prprediction in viral proteins. Chin Sci Bull,1995,40:761~764
9 万 涛,孙 涛.蛋白顺序性抗原决定族的多参数综合预测.中国免疫学杂志,1997,13(6):329~333
(1998-09-04收稿), 百拇医药