肥厚性瘢痕中TGF-β基因表达和蛋白产物的定量研究
作者:武继祥 吴宗耀 曹佳
单位:400038 重庆,第三军医大学西南医院康复理疗科(吴继祥、吴宗耀,预防系分子毒理教研室(曹佳)
关键词:瘢痕;肥厚性;生长因子;蛋白质
New Page 2
【摘 要】 目的 检测肥厚性瘢痕中TGF-β基因和蛋白产物,探讨它在肥厚性瘢痕形成中的作用。方法 运用原位杂交、免疫组化和图像分析。结果 TGF-β基因表达和蛋白产物明显增加,平均积分光密度是正常皮肤的12倍。结论 TGF-β的过量表达和蛋白产物聚积可能是诱导肥厚性瘢痕形成的重要原因。
【中图号】 R619.6
Quantitative study on gene expression and protein of transforming
, http://www.100md.com
growth factor-β in hypertrophic scar
WU Jixiang,WU Zongyao,CAO Jia.Department of Physical Medicine and Rehabilitation,SouthwestHospital,Third Military Medical University,Chongqing 400038
【Abstract】 Objective The gene expression and protein of TGF-β and its effect in formation of hypertrophic scar were investigated.Methods In situ hybrydization,immunohistochemistry and image analysis were used in the study.Results The gene expression and protein of TGF-β in HTS were greatly increased as compared with those of normal skin.The average integral optical density of mRNA of TGF-β increased by 12 fold(P<0.001) of normal skin.Conclusion These findings suggested that the overexpression and protein of TGF-β may be one possible cause for the formation of hypertrophic scar.
, 百拇医药
【Key words】 Scars,hypertrophic Growth factor Proteins
肥厚性瘢痕(hypertropric scar,HTS)是烧伤和创伤愈合后局部胶原等细胞外基质过度增生而形成的病理结构,其病因和发病机理尚不清楚,临床上也无确切有效的防治方法[1]。TGF-β促使成纤维细胞增殖,增加胶原等细胞外基质的合成,是重要的致纤维化因子[2]。有文献报道培养的瘢痕成纤维细胞TGF-β表达显著增高, 表明TGF-β的异常表达与HTS的形成密切相关[3]。目前TGF-β在HTS中的作用已有一些报道,但原位观察HTS组织中TGF-β表达和蛋白含量的定量分析极少。为此我们用原位杂交、免疫组化和图像分析原位观察及定量分析了HTS组织中TGF-β表达和蛋白含量,探讨了它在HTS形成中的作用。
1 材料和方法
, http://www.100md.com
1.1 标本
HTS 24例,男16例,女8例, 年龄10~44岁。均为烧伤后0.5~2年的瘢痕,经病理切片证实为增生期HTS,正常皮肤(NS) 6例取自外科手术,取材后立即置液氮保存。
1.2 主要材料
TGF-β质粒由美国Howoard Hughes Medical Institute G.I.Bell教授惠赠,探针长度为1.8 Kb。TGF-β多抗为Santa Cruz公司产品。免疫组化试剂盒购于迈新公司,地高辛配基标记检测试剂盒购自宝灵曼公司,EcoRI、BamHI、蛋白酶K购自华美生物公司,其余试剂均为国产分析纯。
1.3 方法
1.3.1 制备探针:按常规TGF-β质粒转入大肠杆菌JM109并扩增,碱裂解法大量抽提质粒,透析袋电泳洗脱法制备质粒探针,按药盒说明书用地高辛随机引物法标记探针,标记探针置-20 ℃备用。
, 百拇医药
1.3.2 原位杂交方法:所有标本均做冰冻切片,片厚20 μm,用体积分数为4%的多聚甲醛固定30 min,PBS漂洗10 min×2,蛋白酶K(100 μg/ml) 37 ℃消化30 min,PBS和2×SSC各漂洗10 min,入杂交液45 ℃杂交24 h。杂交后依次用4×SSC、2×SSC、1×SSC、0.5×SSC和PBS各漂洗10 min,再进行地高辛-碱性磷酸酶显色反应。阳性杂交信号为蓝紫色。阴性对照(杂交液中不含探针)无色。
1.3.3 免疫组织化学:HTS和NS石蜡切片常规脱蜡,系列酒精至水,用0.01 mol/L PBS漂洗切片后,每张切片加试剂A(过氧化酶阻断剂)1滴,室温下15 min。用0.01 mol/L PBS漂洗3次,加试剂B(体积分数为10%的阻断血清)1滴,作用15 min。擦干切片,分别加入一抗(1∶100抗鼠TGF-β1抗体),4 ℃冰箱过夜。0.01 mol/L PBS漂洗3次,加试剂C(生物素标记的二抗)1滴,作用15 min,用0.01 mol/L PBS漂洗3次,加试剂D(链霉素抗生物素蛋白过氧化酶溶液)1滴,作用15 min。每张切片加DAB染液50 μl,染色15 min左右,镜检后中止染色。常规脱水、透明,DPX封片。
, http://www.100md.com
1.3.4 图像半定量分析:采用CMIAS真彩色图像分析系统 (空军总医院生物医学工程研究所产品),检测HTS和NS原位杂交切片,在放大20倍下随机选取4个测定区域,按一定阈值分割阳性细胞,测定HTS和NS中TGF-β表达的平均积分吸光度(AIA)和面密度值,所得资料用t检验进行统计学处理。
2 结果
2.1 原位杂交结果
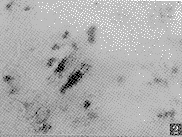
HTS组织中TGF-βmRNA表达明显增强,强阳性颗粒成群分布于胶原结节中,从细胞形态看阳性细胞主要为成纤维细胞。NS中TGF-β表达弱而少,偶见有TGF-β表达弱阳性的成纤维细胞散在分布于真皮(图1~4)。阴性对照切片中未见阳性颗粒。

, 百拇医药
图1 HTS组织胶原结节中TGF-β阳性颗粒 原位杂交×200
图2 HTS组织中TGF-β阳性细胞 原位杂交×400
图3 HTS组织中TGF-β阳性的血管内皮 原位杂交×400
图4 NS组织中TGF-β阳性颗粒弱而少 原位杂交×100
2.2 免疫组织化学结果
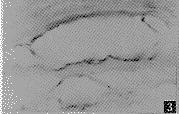
HTS组织中TGF-β阳性细胞明显增加,阳性细胞主要分布于胶原结节,在表皮下也有较多的阳性细胞。一些血管内皮呈TGF-β阳性反应。从细胞形态看多数细胞为成纤维细胞,阳性颗粒较粗大,分布于细胞浆内。NS组织中TGF-β阳性细胞很少(图5~8)。


, 百拇医药
图5 HTS组织胶原结节中TGF-β阳性颗粒 免疫组化×100
图6 HTS组织中TGF-β阳性细胞 免疫组化×400
图7 HTS组织中TGF-β阳性的血管内皮 免疫组化×400
图8 NS组织中未见TGF-β阳性颗粒 免疫组化×100
2.3 图像半定量分析
在HTS组织中TGF-βmRNA面密度和平均积分吸光度(AIA)较NS明显增加(P<0.001),结果见表1。
表1 HTS和NS TGF-β表达的图像
分析结果(n=18,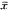 ±s)
±s)
, 百拇医药
组别
面密度值(×10-3/μm2)
TGF-β
AIA
TGF-β
NS
1.67±0.09
104±19
HTS
9.75±0.35***
1 313±110***
, 百拇医药
注:与NS比较* * *P<0.001
3 讨论
TGF-β是调节创伤愈合和组织纤维化的主要生长因子,相对分子质量为585×103,为具有多种生物学功能的蛋白多肽物质,它在创伤愈合的所有阶段均发挥了重要的作用[4],Robert等[5]发现在创面基质中含有丰富的TGF-β,它促进成纤维细胞合成和分泌胶原等细胞外基质成份,加速创面的愈合,但它的过度作用则可能诱导瘢痕的形成。本研究结果显示TGF-β在HTS组织中表达明显增强,平均积分吸光度是NS的12倍(P<0.001)。强阳性颗粒成群分布于胶原结节,主要为阳性反应的成纤维细胞。免疫细胞化学亦证实HTS组织中含大量TGF-β阳性颗粒,提示TGF-β的过量表达和蛋白产物的聚积可能跟HTS形成密切相关[6]。TGF-β表达阳性颗粒和蛋白产物主要见于胶原结节,表明胶原结节是胶原代谢最活跃的区域,TGF-β可能通过旁分泌和自分泌机制分泌,调节局部胶原的代谢,影响创伤愈合和瘢痕的形成。
, 百拇医药
TGF-β在HTS形成中的作用已有了一些研究。Zhang等[7]检测了HTS组织中TGF-β和Ⅰ、Ⅲ胶原基因的表达,发现它们的表达均明显增高,认为TGF-β促进HTSⅠ、Ⅲ胶原基因的表达和胶原的合成,导致胶原的聚积。但有文献报道[8]TGF-β对HTS组织胶原产量无明显影响,在加入TGF-β抗体后瘢痕组织胶原含量也无明显变化,提示TGF-β对HTS胶原合成无明显影响。另一方面局部胶原能否聚积尚取决于胶原降解的水平。目前TGF-β在HTS中的研究多限于其对胶原表达和合成的调控,而对TGF-β影响HTS胶原降解的研究较少。胶原酶是胶原降解的关键酶,胶原酶合成减少或酶的活性下降均可影响胶原的降解。为此作者曾检测了HTS组织中胶原酶活性及胶原降解,发现胶原酶活性明显降低,胶原降解减少,表明胶原降解不足可能是HTS形成的主要原因[9]。Overall等[10]观察了TGF-β对牙龈成纤维细胞胶原酶和TIMP表达的作用,也发现TGF-β抑制胶原酶的表达, 明显上调TIMP的表达,影响酶的活性。这些结果表明TGF-β抑制胶原酶表达和酶活性,阻止胶原降解,可能是它诱导HTS形成的又一重要原因。因此在创伤愈合过程中运用抑制TGF-β表达与活性的方法,可能有助于HTS的防治。
, 百拇医药
参考文献
1 Tredget EE,Nedelec B,Scott PG,et al.Hypertrophic scars,keloids,and contractures:the cellular and molecular basis for therapy.Surg Clin North Am,1997,77:701-731.
2 Kovacs EJ,DiPietro LA.Fibrogenic cytokines and connective tissue production.FASEB J,1994,8:854-861.
3 Ghahary A,Shen YJ,Scott PG,et al.Expression of mRNA for transforming growth factor-β1 is reduced in hypertrophic scar and normal dermal fibroblasts following serial passage in vitro.J Invest Dermatol,1994,103:684-689.
, 百拇医药
4 Clark RAF.Biology of dermal wound repair.Dermatol Clins,1993,11:647-666.
5 Roberts AB,Sporn MB,Assoian RK,et al.Transforming growth factor type β ragid induction of fibrosis and aniogensis in vivo and stimulation of collagen formation in vitro.Proc Natl Acad Sci USA,1986,83:4167-4176.
6 Ghahary A,Shen YJ,Scott PG,et al.Immunolocalization of TGF-beta 1 in human hypertrophic scar and normal dermal tissues. Cytokine,1995,7:184-188.
, 百拇医药
7 Zhang K,Garner W,Cohen L.et al.Increased types Ⅰ and Ⅲ collagen and transforming growth factor-beta mRNA and protein in hypertrophic burn scar.J Invest Dermatol,1995,104:750-758.
8 Younai S,Nichter LS,Willisz T,et al.Modulation of collagen synthesis by transforming growth factor-β in keliod and hypertrophic scar fibroblasts. Ann Plast Surg,1994,33:148-154.
9 武继祥,吴宗耀,陈德英.肥厚性瘢痕组织中胶原酶表达和活性的实验研究.中华物理医学杂志,1998,20:99-101.
10 Overall CM,Wrana JL,Sodek J.Independent regulation of collagenase,72-KDa progelatinase,and metalloendopro-teinase inhibitor expression in human fibroblasts by transforming growth factor-β.J Biol Chem,1989,264:1860-1869.
收稿 1998-08-25
修回 1998-11-30, http://www.100md.com
单位:400038 重庆,第三军医大学西南医院康复理疗科(吴继祥、吴宗耀,预防系分子毒理教研室(曹佳)
关键词:瘢痕;肥厚性;生长因子;蛋白质
New Page 2
【摘 要】 目的 检测肥厚性瘢痕中TGF-β基因和蛋白产物,探讨它在肥厚性瘢痕形成中的作用。方法 运用原位杂交、免疫组化和图像分析。结果 TGF-β基因表达和蛋白产物明显增加,平均积分光密度是正常皮肤的12倍。结论 TGF-β的过量表达和蛋白产物聚积可能是诱导肥厚性瘢痕形成的重要原因。
【中图号】 R619.6
Quantitative study on gene expression and protein of transforming
, http://www.100md.com
growth factor-β in hypertrophic scar
WU Jixiang,WU Zongyao,CAO Jia.Department of Physical Medicine and Rehabilitation,SouthwestHospital,Third Military Medical University,Chongqing 400038
【Abstract】 Objective The gene expression and protein of TGF-β and its effect in formation of hypertrophic scar were investigated.Methods In situ hybrydization,immunohistochemistry and image analysis were used in the study.Results The gene expression and protein of TGF-β in HTS were greatly increased as compared with those of normal skin.The average integral optical density of mRNA of TGF-β increased by 12 fold(P<0.001) of normal skin.Conclusion These findings suggested that the overexpression and protein of TGF-β may be one possible cause for the formation of hypertrophic scar.
, 百拇医药
【Key words】 Scars,hypertrophic Growth factor Proteins
肥厚性瘢痕(hypertropric scar,HTS)是烧伤和创伤愈合后局部胶原等细胞外基质过度增生而形成的病理结构,其病因和发病机理尚不清楚,临床上也无确切有效的防治方法[1]。TGF-β促使成纤维细胞增殖,增加胶原等细胞外基质的合成,是重要的致纤维化因子[2]。有文献报道培养的瘢痕成纤维细胞TGF-β表达显著增高, 表明TGF-β的异常表达与HTS的形成密切相关[3]。目前TGF-β在HTS中的作用已有一些报道,但原位观察HTS组织中TGF-β表达和蛋白含量的定量分析极少。为此我们用原位杂交、免疫组化和图像分析原位观察及定量分析了HTS组织中TGF-β表达和蛋白含量,探讨了它在HTS形成中的作用。
1 材料和方法
, http://www.100md.com
1.1 标本
HTS 24例,男16例,女8例, 年龄10~44岁。均为烧伤后0.5~2年的瘢痕,经病理切片证实为增生期HTS,正常皮肤(NS) 6例取自外科手术,取材后立即置液氮保存。
1.2 主要材料
TGF-β质粒由美国Howoard Hughes Medical Institute G.I.Bell教授惠赠,探针长度为1.8 Kb。TGF-β多抗为Santa Cruz公司产品。免疫组化试剂盒购于迈新公司,地高辛配基标记检测试剂盒购自宝灵曼公司,EcoRI、BamHI、蛋白酶K购自华美生物公司,其余试剂均为国产分析纯。
1.3 方法
1.3.1 制备探针:按常规TGF-β质粒转入大肠杆菌JM109并扩增,碱裂解法大量抽提质粒,透析袋电泳洗脱法制备质粒探针,按药盒说明书用地高辛随机引物法标记探针,标记探针置-20 ℃备用。
, 百拇医药
1.3.2 原位杂交方法:所有标本均做冰冻切片,片厚20 μm,用体积分数为4%的多聚甲醛固定30 min,PBS漂洗10 min×2,蛋白酶K(100 μg/ml) 37 ℃消化30 min,PBS和2×SSC各漂洗10 min,入杂交液45 ℃杂交24 h。杂交后依次用4×SSC、2×SSC、1×SSC、0.5×SSC和PBS各漂洗10 min,再进行地高辛-碱性磷酸酶显色反应。阳性杂交信号为蓝紫色。阴性对照(杂交液中不含探针)无色。
1.3.3 免疫组织化学:HTS和NS石蜡切片常规脱蜡,系列酒精至水,用0.01 mol/L PBS漂洗切片后,每张切片加试剂A(过氧化酶阻断剂)1滴,室温下15 min。用0.01 mol/L PBS漂洗3次,加试剂B(体积分数为10%的阻断血清)1滴,作用15 min。擦干切片,分别加入一抗(1∶100抗鼠TGF-β1抗体),4 ℃冰箱过夜。0.01 mol/L PBS漂洗3次,加试剂C(生物素标记的二抗)1滴,作用15 min,用0.01 mol/L PBS漂洗3次,加试剂D(链霉素抗生物素蛋白过氧化酶溶液)1滴,作用15 min。每张切片加DAB染液50 μl,染色15 min左右,镜检后中止染色。常规脱水、透明,DPX封片。
, http://www.100md.com
1.3.4 图像半定量分析:采用CMIAS真彩色图像分析系统 (空军总医院生物医学工程研究所产品),检测HTS和NS原位杂交切片,在放大20倍下随机选取4个测定区域,按一定阈值分割阳性细胞,测定HTS和NS中TGF-β表达的平均积分吸光度(AIA)和面密度值,所得资料用t检验进行统计学处理。
2 结果
2.1 原位杂交结果
HTS组织中TGF-βmRNA表达明显增强,强阳性颗粒成群分布于胶原结节中,从细胞形态看阳性细胞主要为成纤维细胞。NS中TGF-β表达弱而少,偶见有TGF-β表达弱阳性的成纤维细胞散在分布于真皮(图1~4)。阴性对照切片中未见阳性颗粒。




, 百拇医药
图1 HTS组织胶原结节中TGF-β阳性颗粒 原位杂交×200
图2 HTS组织中TGF-β阳性细胞 原位杂交×400
图3 HTS组织中TGF-β阳性的血管内皮 原位杂交×400
图4 NS组织中TGF-β阳性颗粒弱而少 原位杂交×100
2.2 免疫组织化学结果
HTS组织中TGF-β阳性细胞明显增加,阳性细胞主要分布于胶原结节,在表皮下也有较多的阳性细胞。一些血管内皮呈TGF-β阳性反应。从细胞形态看多数细胞为成纤维细胞,阳性颗粒较粗大,分布于细胞浆内。NS组织中TGF-β阳性细胞很少(图5~8)。




, 百拇医药
图5 HTS组织胶原结节中TGF-β阳性颗粒 免疫组化×100
图6 HTS组织中TGF-β阳性细胞 免疫组化×400
图7 HTS组织中TGF-β阳性的血管内皮 免疫组化×400
图8 NS组织中未见TGF-β阳性颗粒 免疫组化×100
2.3 图像半定量分析
在HTS组织中TGF-βmRNA面密度和平均积分吸光度(AIA)较NS明显增加(P<0.001),结果见表1。
表1 HTS和NS TGF-β表达的图像
分析结果(n=18,
, 百拇医药
组别
面密度值(×10-3/μm2)
TGF-β
AIA
TGF-β
NS
1.67±0.09
104±19
HTS
9.75±0.35***
1 313±110***
, 百拇医药
注:与NS比较* * *P<0.001
3 讨论
TGF-β是调节创伤愈合和组织纤维化的主要生长因子,相对分子质量为585×103,为具有多种生物学功能的蛋白多肽物质,它在创伤愈合的所有阶段均发挥了重要的作用[4],Robert等[5]发现在创面基质中含有丰富的TGF-β,它促进成纤维细胞合成和分泌胶原等细胞外基质成份,加速创面的愈合,但它的过度作用则可能诱导瘢痕的形成。本研究结果显示TGF-β在HTS组织中表达明显增强,平均积分吸光度是NS的12倍(P<0.001)。强阳性颗粒成群分布于胶原结节,主要为阳性反应的成纤维细胞。免疫细胞化学亦证实HTS组织中含大量TGF-β阳性颗粒,提示TGF-β的过量表达和蛋白产物的聚积可能跟HTS形成密切相关[6]。TGF-β表达阳性颗粒和蛋白产物主要见于胶原结节,表明胶原结节是胶原代谢最活跃的区域,TGF-β可能通过旁分泌和自分泌机制分泌,调节局部胶原的代谢,影响创伤愈合和瘢痕的形成。
, 百拇医药
TGF-β在HTS形成中的作用已有了一些研究。Zhang等[7]检测了HTS组织中TGF-β和Ⅰ、Ⅲ胶原基因的表达,发现它们的表达均明显增高,认为TGF-β促进HTSⅠ、Ⅲ胶原基因的表达和胶原的合成,导致胶原的聚积。但有文献报道[8]TGF-β对HTS组织胶原产量无明显影响,在加入TGF-β抗体后瘢痕组织胶原含量也无明显变化,提示TGF-β对HTS胶原合成无明显影响。另一方面局部胶原能否聚积尚取决于胶原降解的水平。目前TGF-β在HTS中的研究多限于其对胶原表达和合成的调控,而对TGF-β影响HTS胶原降解的研究较少。胶原酶是胶原降解的关键酶,胶原酶合成减少或酶的活性下降均可影响胶原的降解。为此作者曾检测了HTS组织中胶原酶活性及胶原降解,发现胶原酶活性明显降低,胶原降解减少,表明胶原降解不足可能是HTS形成的主要原因[9]。Overall等[10]观察了TGF-β对牙龈成纤维细胞胶原酶和TIMP表达的作用,也发现TGF-β抑制胶原酶的表达, 明显上调TIMP的表达,影响酶的活性。这些结果表明TGF-β抑制胶原酶表达和酶活性,阻止胶原降解,可能是它诱导HTS形成的又一重要原因。因此在创伤愈合过程中运用抑制TGF-β表达与活性的方法,可能有助于HTS的防治。
, 百拇医药
参考文献
1 Tredget EE,Nedelec B,Scott PG,et al.Hypertrophic scars,keloids,and contractures:the cellular and molecular basis for therapy.Surg Clin North Am,1997,77:701-731.
2 Kovacs EJ,DiPietro LA.Fibrogenic cytokines and connective tissue production.FASEB J,1994,8:854-861.
3 Ghahary A,Shen YJ,Scott PG,et al.Expression of mRNA for transforming growth factor-β1 is reduced in hypertrophic scar and normal dermal fibroblasts following serial passage in vitro.J Invest Dermatol,1994,103:684-689.
, 百拇医药
4 Clark RAF.Biology of dermal wound repair.Dermatol Clins,1993,11:647-666.
5 Roberts AB,Sporn MB,Assoian RK,et al.Transforming growth factor type β ragid induction of fibrosis and aniogensis in vivo and stimulation of collagen formation in vitro.Proc Natl Acad Sci USA,1986,83:4167-4176.
6 Ghahary A,Shen YJ,Scott PG,et al.Immunolocalization of TGF-beta 1 in human hypertrophic scar and normal dermal tissues. Cytokine,1995,7:184-188.
, 百拇医药
7 Zhang K,Garner W,Cohen L.et al.Increased types Ⅰ and Ⅲ collagen and transforming growth factor-beta mRNA and protein in hypertrophic burn scar.J Invest Dermatol,1995,104:750-758.
8 Younai S,Nichter LS,Willisz T,et al.Modulation of collagen synthesis by transforming growth factor-β in keliod and hypertrophic scar fibroblasts. Ann Plast Surg,1994,33:148-154.
9 武继祥,吴宗耀,陈德英.肥厚性瘢痕组织中胶原酶表达和活性的实验研究.中华物理医学杂志,1998,20:99-101.
10 Overall CM,Wrana JL,Sodek J.Independent regulation of collagenase,72-KDa progelatinase,and metalloendopro-teinase inhibitor expression in human fibroblasts by transforming growth factor-β.J Biol Chem,1989,264:1860-1869.
收稿 1998-08-25
修回 1998-11-30, http://www.100md.com