耐力运动对大鼠骨骼肌细胞葡萄糖运载体的影响
作者:杨晓冰 吴毅 李益明 李云霞 占飞 朱尚权 张新堂 平蓓芳
单位:200040 上海医科大学附属华山医院康复医学科(杨晓冰、吴毅、李云霞、占飞),糖尿病研究室(李益明);中国科学院上海生化所(朱尚权、张新堂、平蓓芳)
关键词:运动;单糖转运蛋白类;肌;大鼠
New Page 2
【摘 要】 目的 研究耐力运动对大鼠骨骼肌细胞葡萄糖运载体4(GT4)的影响。方法 将SD大鼠随机分为二组:对照组和耐力运动组。耐力运动组大鼠进行6周游泳训练。制备GT4羧基端12肽的多克隆抗体。以Western印迹法对二组大鼠骨骼肌细胞GT4含量进行检测,同时检测大鼠血清胰岛素和血糖浓度。结果 大鼠经过6周耐力运动,与对照组大鼠相比,骨骼肌细胞GT4含量增加35.0%(P<0.01)。结论 耐力运动可增加骨骼肌细胞内GT4含量,从而提高肌细胞对葡萄糖的摄取和利用。
, 百拇医药
【中图号】 G804.2
Endurance exercise on glucose transporter in skeletal muscle of rats
YANG Xiaobing,WU Yi,LI Yiming,et al.Department of Rehabilitation Medicine,Affiliated Huashan Hospital,Shanghai Medical University,Shanghai 200040
【Abstract】 Objective To investigate the effect of endurance exercise on skeletal muscle cell glucose transporter 4 (GT4).Methods SD rats were randomly divided into two groups:endurance exercise group and control group.The rats in the former group were submitted to swim for 6 weeks.The polyclonal antibody against GT4 was obtained by immunizing rabbits and skeletal muscle GT4 was detected by Western blot analysis in both group rats.Results After six weeks of exercise training, skeletal muscle GT4 increased 35.0% in the experimental rats as compared with control ones(P<0.01).Conclusion Exercise training can increase GT4 in the skeletal muscle,which may be one of the mechanisms for enhancing the glucose transport and uptake by skeletal muscle.
, 百拇医药
【Key words】 Exercise Monosaccharide transport proteins Muscle Rats
运动训练可增加骨骼肌细胞对葡萄糖的摄取和利用,但其作用机制目前还未完全阐明。研究表明,骨骼肌细胞葡萄糖的跨膜转运是骨骼肌细胞利用葡萄糖的关键步骤,也是主要的限速步骤。在哺乳动物中,这一过程是由细胞膜上的葡萄糖运载体(glucose transporter,GT)参与并通过易化扩散来完成的[1]。在目前已查明的五种GT中,骨骼肌组织中存在两种,即GT1和GT4,前者活性低,只在基础状态下起作用。后者活性高,是骨骼肌细胞的主要的葡萄糖运载体。有关运动训练对骨骼肌细胞GT4的影响目前国内未见报道。本实验的目的通过观察耐力运动对大鼠骨骼肌细胞GT4含量的影响,探讨运动提高骨骼肌细胞对葡萄糖摄取能力的可能机制,为临床上采用运动疗法改善机体糖代谢提供理论依据。
1 材料和方法
, 百拇医药
1.1 实验动物
雄性Sprague-Dawley大鼠(体质量180~220 g),购自上海医科大学动物部。随机分成二组:对照组和耐力运动组,每组6只。耐力运动组按Ploug方法[2]进行游泳训练:水温保持35 ℃左右,水深50 cm,每只大鼠有200 cm2的活动面积以保证大鼠持续活动,每周游泳5 d,共6周,前两周每天游泳40 min,以后每天游泳60 min。对照组不进行运动,余同耐力运动组。
1.2 大鼠骨骼肌细胞GT4的测定
1.2.1 多克隆抗体的制备:采用James法[3]制备GT4的多克隆抗体。先是用Merrifield固相合成法制备GT4羧基端12肽(Thr-Glu-Leu-Glu-Tyr-Ile-Gly-Pro-Asp-Glu-Asn-Asp),以灭活的伤寒杆菌菌壳为载体,用福氏完全佐剂乳化,制备免疫原,免疫新西兰大白兔,4周及7周各加强1次。用ELISA法测大白兔血清抗体滴度,获满意结果后,将兔处死取血清。经饱和硫酸铵沉淀,纯化,透析,冷冻干燥,得GT4羧基端12肽多克隆抗体干粉。
, http://www.100md.com
1.2.2 大鼠骨骼肌细胞膜的制备:用改良 Klips方法[4]制备大鼠骨骼肌细胞膜。二组大鼠实验到期后腹腔内注射质量浓度为30 g/L戊巴比妥钠(50 mg/kg体质量)麻醉处死,解剖后肢股四头肌,肌肉约为10~15 g,浸至0 ℃缓冲液A(250 mmol/L Sucrose,50 mmol/L Tris,0.2 mmol/L EDTA,pH7.4)中,剪碎,匀浆,匀浆液以1 200×g离心10 min(4 ℃),保留上清,沉淀加入缓冲液A如上重复匀浆离心,保留上清,两次上清混合以9 000×g离心10 min(4 ℃),取上清以190 000×g超速离心1 h(4 ℃),取沉淀,加入少量缓冲液A后用玻璃匀浆器匀浆至均一,得骨骼肌细胞膜悬浊液,分装后置于-70 ℃保存待用。膜蛋白浓度用Lowery改良法[5]测定。
1.2.3 用Western印迹法检测骨骼肌细胞GT4含量:取大鼠骨骼肌细胞膜50 μg,用缓冲液A稀至相同体积,加入等体积的2倍浓度样品溶液(0.1 mol/L Tris-HCL,pH 6.8;体积分数为20%的Glycerol;质量浓度为20 g/L的SDS;Bromophenol blue 0.005%;体积分数为10%的2-Mercaptoethanol),在沸水内煮5 min,以9 000×g离心10 min,取相同体积上清液在质量浓度为100 g/L的聚丙烯酰胺的胶上进行SDS凝胶电泳,随后转移至硝酸纤维素(NC)膜上,NC膜与含质量浓度为50 g/L的脱脂奶粉的PBS水浴摇床温育1 h(37 ℃),然后加入多克隆抗体过夜(4 ℃)。洗涤后与HRP标记的羊抗兔IgG水浴摇床温育2 h(37 ℃),充分洗涤后与ECL(增强化学发光剂,购自英国Amersham公司)反应1 min,即刻与Kodak底片曝光,洗片后进行扫描(岛津双波长薄层扫描仪)定量。以正常对照组骨骼肌细胞GT4的含量为100作为标准,计算耐力运动组GT4的相对含量。
, 百拇医药
1.3 生化指标的检测
实验前后测二组尾静脉全血糖和血清胰岛素浓度,血糖浓度用快速血糖仪(美国强生公司产品,one touch Ⅱ型)检测,血清胰岛素浓度用放免法(中国华西糖尿病科技开发研究所试剂盒)测定。
1.4 统计学处理
数据以均数±标准差(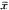 ±s)表示,组间差异采用t检验。
±s)表示,组间差异采用t检验。
2 结果
2.1 耐力运动对大鼠体质量、血糖和血清胰岛素的影响
运动训练后运动组大鼠的体质量与正常组相比,明显减少(P<0.01),而耐力运动前后耐力运动组血糖和血清胰岛素无显著变化,与正常对照组比较,也无明显差异,见表1。
, 百拇医药
表1 实验前后大鼠血糖和血清胰岛素
的变化(n=6,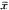 ±s)
±s)
组别
体质量变化(g)
血糖(mmol/L)
血清胰岛素(mU/L)
开始
结束
开始
结束
, 百拇医药
开始
结束
对照组
182.8
±12.3
307.7
±10.1
4.02
±0.48
3.95
±0.36
9.26
±0.73
, 百拇医药
9.72
±0.57
耐力
运动组
183.7
±6.1
281.8
±18.4*
4.28
±0.56
4.21
±0.44
9.40
, 百拇医药
±0.40
9.94
±0.73
注:与正常对照组比较*P<0.01
2.2 耐力运动对大鼠骨骼肌细胞GT4的影响
Western印迹法显示耐力运动组大鼠骨骼肌细胞GT4含量较对照组明显增加,定量测定表明耐力运动组大鼠骨骼肌细胞GT4含量较对照组增加35.0%(P<0.01)(图1)。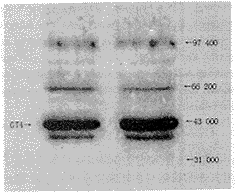
注:C 对照组 E 运动组
, 百拇医药 图1 Western blot法检测二组大鼠骨骼肌细胞GT4含量的比较
3 讨论
GT4主要存在于对胰岛素敏感的骨骼肌和脂肪组织中,在基础状态下主要位于细胞内,但在胰岛素或肌肉收缩刺激下,细胞内的GT4转位至细胞外膜上,从而发挥其生理作用,介导细胞外葡萄糖进入细胞内[6]。由于GT4对糖代谢中意义重大,近年来对GT4的研究越来越广泛,多项研究表明,耐力运动后骨骼肌细胞GT4含量增加从30%至2倍不等,这主要与运动方式及肌肉取材不同有关[2,7,8]。本研究取大鼠的大腿股四头肌作为研究对象,以游泳作为耐力运动的方式,结果表明,大鼠骨骼肌细胞GT4含量在耐力运动后增加35%,与上述研究相符。Rodnick等[9]以大鼠踩轮运动5周来观察耐力运动对GT4及葡萄糖转运能力的影响,发现在运动后肘肌GT4含量增加了51%,跖肌增加34%,而比目鱼肌无明显变化。不同骨骼肌中GT4含量对运动反应的不同主要与肌纤维的类型有关,其中Ⅰ型和Ⅱa型肌纤维富含GT4,IIb型肌纤维含GT4的量较少,不同骨骼肌含有肌纤维类型不一致,因此对运动的反应也不一致。
, http://www.100md.com
耐力运动可使机体产生一系列适应性改变,包括酶的适应改变,如己糖激酶、糖原合成酶和呼吸链上线粒体酶等含量的增多,从而增加骨骼肌储存和氧化糖的能力。GT4的增加同样也是这种适应性改变的一个部分,这与GT4受到肌肉收缩等一些内在因素的共同调节有关;已有研究表明,耐力运动可提高大鼠骨骼肌GT4 mRNA的含量,说明耐力运动通过翻译前水平,即提高GT4基因转录的作用来提高细胞GT4的含量[10]。骨骼肌GT4含量的增加对肌肉适应耐力运动,具有重要的生理意义。失神经肌肉的研究也表明,如果无肌肉的收缩,骨骼肌细胞中的GT4含量、氧化酶和葡萄糖转运能力均下降[11],进一步证实肌肉收缩是促进骨骼肌GT4表达的一项重要的调节因素。
另外,尽管耐力运动可增加骨骼肌毛细血管的开放数量,使每一肌细胞上的毛细血管数量增加,通过局部血流的增多使骨骼肌对葡萄糖摄取率增加,但研究表明骨骼肌GT4的含量与肌细胞最大葡萄糖转运能力呈正相关关系,因此,GT4含量的增加是骨骼肌对葡萄糖摄取率增加的主要原因,局部血流的增多只起辅助作用,这显示骨骼肌细胞GT4在葡萄糖转运和摄取中占有重要地位,是主要的葡萄糖运载体。
, http://www.100md.com
实验结果显示,尽管大鼠骨骼肌细胞GT4含量增加,提高了骨骼肌细胞对葡萄糖的摄取,但运动前后大鼠血糖浓度并未降低,这是由于在一个正常的有机整体中,血糖受到多种机制的共同调节,当血糖水平下降时,可通过肝糖原分解和糖异生作用产生内源性葡萄糖,另外还通过饮食摄入更多的糖、脂肪等,以增加外原性葡萄糖。并且神经系统也有强大的调节功能,以维持血糖在正常水平。
目前研究表明,许多代谢疾病,如糖尿病、肥胖症等均表现为外周组织(主要是骨骼肌和脂肪组织)对胰岛素的抵抗,其中骨骼肌细胞GT4含量减少、活性降低是产生胰岛素抵抗的重要因素之一[12]。耐力运动是改善上述代谢性疾病的重要治疗手段之一。通过本实验研究证实,耐力运动可提高骨骼肌细胞GT4 含量,加强骨骼肌细胞对葡萄糖的摄取和转运,从而为上述代谢性疾病的运动疗法提供一定的理论依据。有关这方面的研究,有待进一步深入。
本课题为国家自然科学基金资助项目(No.39600170)
, 百拇医药
参考文献
1 Fink P,Wallace P,Brechtel G,et al.Evidence that glucose transport is rate limiting for in vivo glucose uptake.Metabolism,1992,41:897-903.
2 Ploug T,Stallknecht BN,Pedersen D,et al.Effect of endurance training on glucose transport capacity and glucose tranporter expression in rat skeletal muscle.Am J Physiol,1990,259:778-786.
3 James D,Strube M,Mueckler M,et al.Molecular cloning and characterization of an insulin-regulatable glucose transporter.Nature,1989,338:83-87.
, 百拇医药
4 Klip A,Ramlal T,Young AJ,et al.Insulin-induced translocation of glucose transporters in rat hindlimb muscles.FEBS Lett,1987,244:224-230.
5 Lowery OH,Rosebrough HJ,Farr AL,et al.Protein measurement with the folinphenol reagent,J Biol Chem,1951,193:265-275.
6 Douen AG,Ramlal T,Rastogi S,et al.Evidence for distinct intracellular insulin and exercise-recruitable transporter pools in skeletal muscle.J Bio Chem,1990,265:13427-13430.
, 百拇医药
7 Rodnick KJ,Holloszy JO,Mondon CE,et al.Effects of exercise training on insulin-regulatable glucose-transporter protein levels in rat skeletal muscle.Diabetes,1990,39:1425-1429.
8 Friedman JE,Sherman WM,Reed MJ,et al.Exercise training increases glucose transporter protein GT4 in skeletal muscle of obese Zucker rats.FEBS Lett,1990,268:13-16.
9 Rodnick KJ,Henriksen EJ,James DE,et al.Exercise training, glucose transporters, and glucose transport in rat skeletal muscles.Am J Physiol,1992,262:c9-c11.
, 百拇医药
10 吴毅,李益明,胡永善,等.耐力运动对大鼠骨骼肌葡萄糖运载体基因表达的调节作用.中国康复医学杂志,1997,12:149-152.
11 Henriksen EJ,Rodnick KJ,Mondon CE,et al.Effect of denervation or unweighting on GT4 protein in rat soleus muscle.J Appl Physiol,1991,70:2322-2327.
12 Garvey WT,Huecksteadt TP,Birnbaum MJ.Pretranslational suppression of an insulin-resposive glucose transporter in rats with diabetes mellitus.Science,1989,245:60-63.
收稿 1998-09-02
修回 1998-11-30, 百拇医药
单位:200040 上海医科大学附属华山医院康复医学科(杨晓冰、吴毅、李云霞、占飞),糖尿病研究室(李益明);中国科学院上海生化所(朱尚权、张新堂、平蓓芳)
关键词:运动;单糖转运蛋白类;肌;大鼠
New Page 2
【摘 要】 目的 研究耐力运动对大鼠骨骼肌细胞葡萄糖运载体4(GT4)的影响。方法 将SD大鼠随机分为二组:对照组和耐力运动组。耐力运动组大鼠进行6周游泳训练。制备GT4羧基端12肽的多克隆抗体。以Western印迹法对二组大鼠骨骼肌细胞GT4含量进行检测,同时检测大鼠血清胰岛素和血糖浓度。结果 大鼠经过6周耐力运动,与对照组大鼠相比,骨骼肌细胞GT4含量增加35.0%(P<0.01)。结论 耐力运动可增加骨骼肌细胞内GT4含量,从而提高肌细胞对葡萄糖的摄取和利用。
, 百拇医药
【中图号】 G804.2
Endurance exercise on glucose transporter in skeletal muscle of rats
YANG Xiaobing,WU Yi,LI Yiming,et al.Department of Rehabilitation Medicine,Affiliated Huashan Hospital,Shanghai Medical University,Shanghai 200040
【Abstract】 Objective To investigate the effect of endurance exercise on skeletal muscle cell glucose transporter 4 (GT4).Methods SD rats were randomly divided into two groups:endurance exercise group and control group.The rats in the former group were submitted to swim for 6 weeks.The polyclonal antibody against GT4 was obtained by immunizing rabbits and skeletal muscle GT4 was detected by Western blot analysis in both group rats.Results After six weeks of exercise training, skeletal muscle GT4 increased 35.0% in the experimental rats as compared with control ones(P<0.01).Conclusion Exercise training can increase GT4 in the skeletal muscle,which may be one of the mechanisms for enhancing the glucose transport and uptake by skeletal muscle.
, 百拇医药
【Key words】 Exercise Monosaccharide transport proteins Muscle Rats
运动训练可增加骨骼肌细胞对葡萄糖的摄取和利用,但其作用机制目前还未完全阐明。研究表明,骨骼肌细胞葡萄糖的跨膜转运是骨骼肌细胞利用葡萄糖的关键步骤,也是主要的限速步骤。在哺乳动物中,这一过程是由细胞膜上的葡萄糖运载体(glucose transporter,GT)参与并通过易化扩散来完成的[1]。在目前已查明的五种GT中,骨骼肌组织中存在两种,即GT1和GT4,前者活性低,只在基础状态下起作用。后者活性高,是骨骼肌细胞的主要的葡萄糖运载体。有关运动训练对骨骼肌细胞GT4的影响目前国内未见报道。本实验的目的通过观察耐力运动对大鼠骨骼肌细胞GT4含量的影响,探讨运动提高骨骼肌细胞对葡萄糖摄取能力的可能机制,为临床上采用运动疗法改善机体糖代谢提供理论依据。
1 材料和方法
, 百拇医药
1.1 实验动物
雄性Sprague-Dawley大鼠(体质量180~220 g),购自上海医科大学动物部。随机分成二组:对照组和耐力运动组,每组6只。耐力运动组按Ploug方法[2]进行游泳训练:水温保持35 ℃左右,水深50 cm,每只大鼠有200 cm2的活动面积以保证大鼠持续活动,每周游泳5 d,共6周,前两周每天游泳40 min,以后每天游泳60 min。对照组不进行运动,余同耐力运动组。
1.2 大鼠骨骼肌细胞GT4的测定
1.2.1 多克隆抗体的制备:采用James法[3]制备GT4的多克隆抗体。先是用Merrifield固相合成法制备GT4羧基端12肽(Thr-Glu-Leu-Glu-Tyr-Ile-Gly-Pro-Asp-Glu-Asn-Asp),以灭活的伤寒杆菌菌壳为载体,用福氏完全佐剂乳化,制备免疫原,免疫新西兰大白兔,4周及7周各加强1次。用ELISA法测大白兔血清抗体滴度,获满意结果后,将兔处死取血清。经饱和硫酸铵沉淀,纯化,透析,冷冻干燥,得GT4羧基端12肽多克隆抗体干粉。
, http://www.100md.com
1.2.2 大鼠骨骼肌细胞膜的制备:用改良 Klips方法[4]制备大鼠骨骼肌细胞膜。二组大鼠实验到期后腹腔内注射质量浓度为30 g/L戊巴比妥钠(50 mg/kg体质量)麻醉处死,解剖后肢股四头肌,肌肉约为10~15 g,浸至0 ℃缓冲液A(250 mmol/L Sucrose,50 mmol/L Tris,0.2 mmol/L EDTA,pH7.4)中,剪碎,匀浆,匀浆液以1 200×g离心10 min(4 ℃),保留上清,沉淀加入缓冲液A如上重复匀浆离心,保留上清,两次上清混合以9 000×g离心10 min(4 ℃),取上清以190 000×g超速离心1 h(4 ℃),取沉淀,加入少量缓冲液A后用玻璃匀浆器匀浆至均一,得骨骼肌细胞膜悬浊液,分装后置于-70 ℃保存待用。膜蛋白浓度用Lowery改良法[5]测定。
1.2.3 用Western印迹法检测骨骼肌细胞GT4含量:取大鼠骨骼肌细胞膜50 μg,用缓冲液A稀至相同体积,加入等体积的2倍浓度样品溶液(0.1 mol/L Tris-HCL,pH 6.8;体积分数为20%的Glycerol;质量浓度为20 g/L的SDS;Bromophenol blue 0.005%;体积分数为10%的2-Mercaptoethanol),在沸水内煮5 min,以9 000×g离心10 min,取相同体积上清液在质量浓度为100 g/L的聚丙烯酰胺的胶上进行SDS凝胶电泳,随后转移至硝酸纤维素(NC)膜上,NC膜与含质量浓度为50 g/L的脱脂奶粉的PBS水浴摇床温育1 h(37 ℃),然后加入多克隆抗体过夜(4 ℃)。洗涤后与HRP标记的羊抗兔IgG水浴摇床温育2 h(37 ℃),充分洗涤后与ECL(增强化学发光剂,购自英国Amersham公司)反应1 min,即刻与Kodak底片曝光,洗片后进行扫描(岛津双波长薄层扫描仪)定量。以正常对照组骨骼肌细胞GT4的含量为100作为标准,计算耐力运动组GT4的相对含量。
, 百拇医药
1.3 生化指标的检测
实验前后测二组尾静脉全血糖和血清胰岛素浓度,血糖浓度用快速血糖仪(美国强生公司产品,one touch Ⅱ型)检测,血清胰岛素浓度用放免法(中国华西糖尿病科技开发研究所试剂盒)测定。
1.4 统计学处理
数据以均数±标准差(
2 结果
2.1 耐力运动对大鼠体质量、血糖和血清胰岛素的影响
运动训练后运动组大鼠的体质量与正常组相比,明显减少(P<0.01),而耐力运动前后耐力运动组血糖和血清胰岛素无显著变化,与正常对照组比较,也无明显差异,见表1。
, 百拇医药
表1 实验前后大鼠血糖和血清胰岛素
的变化(n=6,
组别
体质量变化(g)
血糖(mmol/L)
血清胰岛素(mU/L)
开始
结束
开始
结束
, 百拇医药
开始
结束
对照组
182.8
±12.3
307.7
±10.1
4.02
±0.48
3.95
±0.36
9.26
±0.73
, 百拇医药
9.72
±0.57
耐力
运动组
183.7
±6.1
281.8
±18.4*
4.28
±0.56
4.21
±0.44
9.40
, 百拇医药
±0.40
9.94
±0.73
注:与正常对照组比较*P<0.01
2.2 耐力运动对大鼠骨骼肌细胞GT4的影响
Western印迹法显示耐力运动组大鼠骨骼肌细胞GT4含量较对照组明显增加,定量测定表明耐力运动组大鼠骨骼肌细胞GT4含量较对照组增加35.0%(P<0.01)(图1)。

注:C 对照组 E 运动组
, 百拇医药 图1 Western blot法检测二组大鼠骨骼肌细胞GT4含量的比较
3 讨论
GT4主要存在于对胰岛素敏感的骨骼肌和脂肪组织中,在基础状态下主要位于细胞内,但在胰岛素或肌肉收缩刺激下,细胞内的GT4转位至细胞外膜上,从而发挥其生理作用,介导细胞外葡萄糖进入细胞内[6]。由于GT4对糖代谢中意义重大,近年来对GT4的研究越来越广泛,多项研究表明,耐力运动后骨骼肌细胞GT4含量增加从30%至2倍不等,这主要与运动方式及肌肉取材不同有关[2,7,8]。本研究取大鼠的大腿股四头肌作为研究对象,以游泳作为耐力运动的方式,结果表明,大鼠骨骼肌细胞GT4含量在耐力运动后增加35%,与上述研究相符。Rodnick等[9]以大鼠踩轮运动5周来观察耐力运动对GT4及葡萄糖转运能力的影响,发现在运动后肘肌GT4含量增加了51%,跖肌增加34%,而比目鱼肌无明显变化。不同骨骼肌中GT4含量对运动反应的不同主要与肌纤维的类型有关,其中Ⅰ型和Ⅱa型肌纤维富含GT4,IIb型肌纤维含GT4的量较少,不同骨骼肌含有肌纤维类型不一致,因此对运动的反应也不一致。
, http://www.100md.com
耐力运动可使机体产生一系列适应性改变,包括酶的适应改变,如己糖激酶、糖原合成酶和呼吸链上线粒体酶等含量的增多,从而增加骨骼肌储存和氧化糖的能力。GT4的增加同样也是这种适应性改变的一个部分,这与GT4受到肌肉收缩等一些内在因素的共同调节有关;已有研究表明,耐力运动可提高大鼠骨骼肌GT4 mRNA的含量,说明耐力运动通过翻译前水平,即提高GT4基因转录的作用来提高细胞GT4的含量[10]。骨骼肌GT4含量的增加对肌肉适应耐力运动,具有重要的生理意义。失神经肌肉的研究也表明,如果无肌肉的收缩,骨骼肌细胞中的GT4含量、氧化酶和葡萄糖转运能力均下降[11],进一步证实肌肉收缩是促进骨骼肌GT4表达的一项重要的调节因素。
另外,尽管耐力运动可增加骨骼肌毛细血管的开放数量,使每一肌细胞上的毛细血管数量增加,通过局部血流的增多使骨骼肌对葡萄糖摄取率增加,但研究表明骨骼肌GT4的含量与肌细胞最大葡萄糖转运能力呈正相关关系,因此,GT4含量的增加是骨骼肌对葡萄糖摄取率增加的主要原因,局部血流的增多只起辅助作用,这显示骨骼肌细胞GT4在葡萄糖转运和摄取中占有重要地位,是主要的葡萄糖运载体。
, http://www.100md.com
实验结果显示,尽管大鼠骨骼肌细胞GT4含量增加,提高了骨骼肌细胞对葡萄糖的摄取,但运动前后大鼠血糖浓度并未降低,这是由于在一个正常的有机整体中,血糖受到多种机制的共同调节,当血糖水平下降时,可通过肝糖原分解和糖异生作用产生内源性葡萄糖,另外还通过饮食摄入更多的糖、脂肪等,以增加外原性葡萄糖。并且神经系统也有强大的调节功能,以维持血糖在正常水平。
目前研究表明,许多代谢疾病,如糖尿病、肥胖症等均表现为外周组织(主要是骨骼肌和脂肪组织)对胰岛素的抵抗,其中骨骼肌细胞GT4含量减少、活性降低是产生胰岛素抵抗的重要因素之一[12]。耐力运动是改善上述代谢性疾病的重要治疗手段之一。通过本实验研究证实,耐力运动可提高骨骼肌细胞GT4 含量,加强骨骼肌细胞对葡萄糖的摄取和转运,从而为上述代谢性疾病的运动疗法提供一定的理论依据。有关这方面的研究,有待进一步深入。
本课题为国家自然科学基金资助项目(No.39600170)
, 百拇医药
参考文献
1 Fink P,Wallace P,Brechtel G,et al.Evidence that glucose transport is rate limiting for in vivo glucose uptake.Metabolism,1992,41:897-903.
2 Ploug T,Stallknecht BN,Pedersen D,et al.Effect of endurance training on glucose transport capacity and glucose tranporter expression in rat skeletal muscle.Am J Physiol,1990,259:778-786.
3 James D,Strube M,Mueckler M,et al.Molecular cloning and characterization of an insulin-regulatable glucose transporter.Nature,1989,338:83-87.
, 百拇医药
4 Klip A,Ramlal T,Young AJ,et al.Insulin-induced translocation of glucose transporters in rat hindlimb muscles.FEBS Lett,1987,244:224-230.
5 Lowery OH,Rosebrough HJ,Farr AL,et al.Protein measurement with the folinphenol reagent,J Biol Chem,1951,193:265-275.
6 Douen AG,Ramlal T,Rastogi S,et al.Evidence for distinct intracellular insulin and exercise-recruitable transporter pools in skeletal muscle.J Bio Chem,1990,265:13427-13430.
, 百拇医药
7 Rodnick KJ,Holloszy JO,Mondon CE,et al.Effects of exercise training on insulin-regulatable glucose-transporter protein levels in rat skeletal muscle.Diabetes,1990,39:1425-1429.
8 Friedman JE,Sherman WM,Reed MJ,et al.Exercise training increases glucose transporter protein GT4 in skeletal muscle of obese Zucker rats.FEBS Lett,1990,268:13-16.
9 Rodnick KJ,Henriksen EJ,James DE,et al.Exercise training, glucose transporters, and glucose transport in rat skeletal muscles.Am J Physiol,1992,262:c9-c11.
, 百拇医药
10 吴毅,李益明,胡永善,等.耐力运动对大鼠骨骼肌葡萄糖运载体基因表达的调节作用.中国康复医学杂志,1997,12:149-152.
11 Henriksen EJ,Rodnick KJ,Mondon CE,et al.Effect of denervation or unweighting on GT4 protein in rat soleus muscle.J Appl Physiol,1991,70:2322-2327.
12 Garvey WT,Huecksteadt TP,Birnbaum MJ.Pretranslational suppression of an insulin-resposive glucose transporter in rats with diabetes mellitus.Science,1989,245:60-63.
收稿 1998-09-02
修回 1998-11-30, 百拇医药