溴氰菊酯对大鼠脑细胞DNA的损伤作用
作者:牛玉杰 石年 严红 刘毓谷
单位:牛玉杰 河北医科大学公共卫生学院劳动卫生学教研室 石家庄 050017石年 严红 刘毓谷 同济医科大学环境毒理教研室
关键词:除虫菊酯类/毒性;谷氨酸盐类/代谢;天门冬氨酸/代谢;脑;大鼠
河北医科大学学报990201 摘 要 目的 研究溴氰菊酯(DM)对大鼠脑细胞DNA的损伤作用。方法 用流式细胞仪观察了DM处理后大鼠脑细胞DNA片段化的发生情况;用荧光染色法观察了DM作用后大鼠分离脑细胞核的形态变化。结果 用流式细胞仪进行检测,发现DM可以使大鼠脑组织皮层、海马和小脑部位DNA片段化的细胞数明显增加;同时DM可以使分离的脑细胞DNA受到损伤, 细胞核出现染色质浓缩、边缘不整齐、碎裂或环状等类似凋亡的形态学改变。结论 DM可以损伤脑细胞的DNA,有可能诱发神经细胞的凋亡。
中图号 TQ456.3
, http://www.100md.com
DAMAGING EFFECT OF DELTAMETHRIN ON DNA OF RAT NEURAL CELLS
Niu Yujie
Department of Occupational Health, the School of Public Health,Hebei Medical University (Shijiazhuang 050017)
Shi Nian Yan Hong Liu Yugu
Department of Environmental Toxicology,Tongji Medical University
ABSTRACT Objective To study the damaging effects of deltamethrin(DM) on the DNA of rat neural cells.Methods With flow cytometry,the DNA fragmentation by DM in rat brain was measured.The morphological changes of nucleus by DM on rat dissociated neural cells were observed with fluorescent nuclear staining. Results Under the effect of DM, the number of DNA fragmental cells in cerebral cortex, hippocampus and cerebellum significantly increased,and the DNA of dissociated neural cells appeared some morphological changes like apoptosis. Conclusion DM may elicit apoptosis of rat neural cells through the DNA damage.
, 百拇医药
MeSH pyrethrins/tox;glutamate/metab;aspartic acid/metab;brain;rats
溴氰菊酯(Deltamethrin,DM) 是拟除虫菊酯类农药的一种,因其具有杀虫谱广、低残留等优点,广泛应用于防治农业害虫、仓储害虫等方面。近年来,拟除虫菊酯对哺乳动物神经毒性的问题日益受到人们的关注。哺乳动物DM急性中毒时主要表现为中枢神经系统的强烈兴奋性症状,其发生发展和脑内兴奋性氨基酸(excitatory amino acid,EAA) 递质含量(主要是谷氨酸)有很好的相关性[1];用谷氨酸N-甲基-D-门冬氨酸(N-methyl-D-aspartic acid,NMDA)受体特异性阻断剂MK-801可以有效拮抗DM所致的兴奋性神经毒性[2] ,提示DM可能通过兴奋性神经递质产生其神经毒性作用。
中枢神经系统内EAA的变化,可以造成神经细胞的多种损伤,并可以诱发神经细胞凋亡。神经细胞发生凋亡时,DNA结构受到损害,出现特有的形态变化如染色质浓缩、细胞核碎裂、片段化、电泳呈现“梯状”条带等。有研究表明EAA与细胞凋亡有密切关系[3]。本文发现DM可使大鼠脑组织中谷氨酸含量增加,且突触前膜谷氨酸释放增多,突触间隙谷氨酸聚积[4]。在此基础上,本文观察了DM对大鼠脑细胞DNA的损伤作用,以便为探讨DM和神经细胞凋亡的关系,揭示DM神经毒作用的机理打下基础。
, http://www.100md.com
1 材料和方法
1.1 材料:①溴氰菊酯,法国罗素.优克福公司产品,纯度>98.0%;DMEM培养基、胎牛血清为Gbico公司产品;胰蛋白酶、溴化乙啶(EB)、丫啶橙(AO)为Sigma公司产品;其它试剂均为国产分析纯。② PM-10ADS 荧光显微镜(日本Olympus公司产品);FACS 420型流式细胞仪(美国Becton-Dickinson公司产品)。
1.2 方法
1.2.1 应用流式细胞仪检测脑细胞DNA的损伤
1.2.1.1 雄性Wistar大鼠,体质量180~220 g,由同济医科大学实验动物中心提供。DM先用二甲亚砜溶解,再用蒸馏水稀释成所需浓度的混悬液。将动物随机分为2组,每组6只,进行如下处理:①对照组,腹腔注射给予1%浓度的二甲亚砜;②DM处理组,腹腔注射给予20 mg/kg体质量的DM。所有动物均于处理后1小时断头处死,取出脑组织,冰盘上分离出大脑皮层、海马和小脑,剔除软脑膜和血管,70%乙醇固定24小时以上。
, 百拇医药
1.2.1.2 将待测脑组织制成1×109/L的单细胞悬液,加入EB染液(浓度为10 μg/ml,内含1 mg/ml的柠檬酸钠,0.546 mg/ml的NaCl和0.01 mg/ml的RNAase,pH=7.2~7.6),4℃冰箱内反应30分钟,即可上机分析。
1.2.1.3 用FACS 420型流式细胞仪进行检测。检测条件为2W氩离子激光器,输出功率300 mW,激发波长488 nm,发射波长605 nm。测量数据和图形输入HP-300 Consort 30计算机,应用相应软件进行处理。测定前以鸡血红细胞调整仪器的CV值在5.0%以内。
1.2.1.4 以发生DNA片段化的细胞数占观察细胞的百分率为检测指标,同时观察细胞内DNA的平均荧光强度。
1.2.2 分离脑细胞DNA损伤的形态观察
, 百拇医药 1.2.2.1 单细胞悬液的制备参照Dildy和Leslie[5]介绍的方法进行。取新生Wistar大鼠(1~3天,由同济医科大学实验动物中心提供)断头处死,剥离出全部脑组织,剔除软脑膜和血管, 用Hanks液冲洗两遍, 置小烧杯中剪碎, 加入0.25%胰蛋白酶,于37℃恒温水浴中震荡消化20分钟,消化过程中不断通入95%O2和5%CO2的混合气体(60个气泡/min)。消化结束后过200 目筛网,滤液1 000 r/min离心5分钟,再用Hanks液洗一次, 最后用含10%胎牛血清的DMEM培养基制成单细胞悬液,调整细胞密度为2×109/L。用台盼蓝染色检查细胞存活率,要求不低于95%。
1.2.2.2 取上述制备好的单细胞悬液,加入终浓度为200 nmol/L的DM,37℃温育,不断通入95%O2和5%CO2的混合气体(60个气泡/min)。分别于加入DM后15、30、60、120分钟时取细胞悬液进行涂片,将涂片在室温下自然干燥,用1∶10 000的AO染色,荧光显微镜下观察细胞核形态的变化。
, 百拇医药
1.2.2.3 预试验时用DM处理分离的脑细胞,于不同时间点涂片进行观察,发现30分钟以前很少有凋亡现象发生。每个时间点涂片3张,每张涂片观察5个视野,每个视野不少于10个细胞;随着时间的延长,细胞核开始出现凋亡的形态变化。当时间延长至2.5小时,用台盼蓝染色,发现细胞自然死亡率超过10%,故以2小时为观察时限。
2 结果
2.1 DM对DNA损伤的流式细胞仪检测:用DM处理大鼠后,皮层、海马和小脑组织中, 出现凋亡峰的细胞明显增多(图1),表现为DNA片段化阳性细胞率显著高于对照组(P<0.01)。同时,胞内DNA平均荧光强度下降,以皮层最为明显,说明DNA断裂后,结合EB的能力下降,从而使其荧光强度有所降低,见表1。
表1 溴氰菊酯对DNA损伤的流式细胞分析
Table 1 Damage of DM on the DNA in rat brain
, 百拇医药
(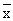 ±s) Gronp
±s) Gronp
Rate of Sub G0/G1 cells
Average fluorescence
Cortex
Hippocampus
Cerebellum
Cortex
Hippocampus
Cerebellum
, 百拇医药 Control
2.1±0.4
2.2±0.5
2.5±0.8
47.0±1.6
48.2±1.8
46.2±1.9
DM
13.7±1.4**
16.2±2.7**
8.0±0.8**
, 百拇医药
34.8±11.0*
40.0±8.4
43.6±7.7
Comparison with control *P<0.05 (Bilateral t test) **P<0.01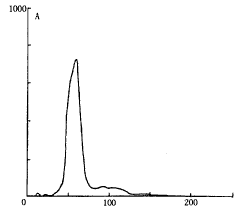
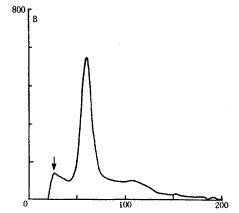
图1 DNA损伤的流式细胞检测 A 正常的DNA组方图 B DM处理后,有凋亡峰出现,箭头所指即为凋亡峰
Figure 1 DNA histogram analysed by FCM A Normal control DNA histogram B DM treatment,solid arrow represents Ap peak
, 百拇医药
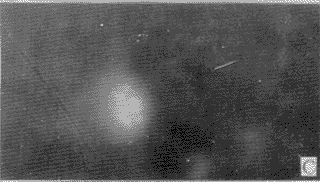
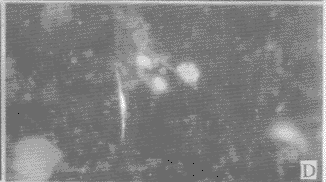
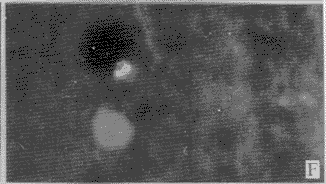
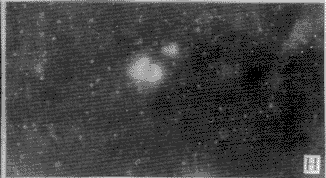
2.2 DM对分离脑细胞DNA的损伤:正常情况下胞核染色近似圆形,边缘清楚,染色均匀(图2-A)。当细胞发生凋亡时,细胞核染色体凝集成块,着色较重,且细胞缩小,因核膜仍然存在,故DNA虽然碎裂,但仍集中在一起。图2-B显示细胞核碎裂成3块,图2-C显示细胞核碎裂成多块;图2-D显示染色质开始浓缩,边缘不整齐;图2-E显示染色质浓缩,靠近核膜,从而形成环状DNA;图2-F~H可见凋亡小体的形成过程,染色质浓缩,边缘不整,图9可见凋亡小体从细胞核分裂出来。



, 百拇医药
A 正常形态的DNA,×200 (孵育15分钟)
B DNA细胞核碎裂为3块,×400 (孵育60分钟)
C 细胞核碎裂为多部分,但尚未形成凋亡小体,×400 (孵育30分钟)
D 凋亡细胞染色体凝集成块,边缘不整齐,×200 (孵育30分钟)
E 染色质靠近核膜,形成环状DNA,×400 (孵育90分钟)
F 染色质浓缩,可见凋亡小体的形成过程,×200 (孵育60分钟)
G 染色质浓缩,可见凋亡小体的形成过程,×400 (孵育120分钟)
H 凋亡小体从细胞核分裂出来,×200 (孵育120分钟)
, 百拇医药
图2 DM对分离神经细胞DNA的损伤(AO染色)A DNA in normal state,×200(incubated 15 min)
B DNA broke into three pieces,×400(incubated 60 min)
C DNA broke into many pieces,×400(incubated 30 min)
D Early stage of apoptotic cells,×200(incubated 30 min)
E A ring-like shape DNA,×400(incubated 90 min)
F Early stage of apoptotic cells, ×200(incubated 60 min)
, 百拇医药
G Early stage of apoptotic cells, ×400(incubated 120 min)
H Apoptotic body separated from nuclear, ×200(incubated 120 min)
Figure 2 Damage of DM on the DNA in rat dissociated neural cells(Stained by AO)
3 讨论
生长、分化和死亡是细胞生命活动的正常过程。死亡分为坏死和凋亡两种方式。近年来,凋亡已成为生命科学及细胞学研究的又一个热点。
本研究发现,DM作用于分离的脑细胞后,使其细胞核的形态发生变化,出现凋亡的形态学特征;用FCM进行检测, 如果细胞DNA发生损伤时,DNA片段化并降解,则在DNA组方图中,表现为G0/G1期峰之前出现一个低于G0/G1期DNA含量的亚二倍体峰,又叫凋亡峰(AP峰)。正常细胞仅有G0/G1期、S期、G2/M期, AP峰的出现,说明细胞中DNA碎裂为片段[6]。 DM处理后,脑细胞有凋亡峰出现,细胞片段化的百分率明显上升;以上结果说明DM很可能损害脑细胞的DNA,诱导神经细胞出现凋亡。
, http://www.100md.com
凋亡的诱导机理十分复杂,目前仍不十分明了。DM作为一种外来化合物,诱导神经细胞出现凋亡可能有以下几种途径:①脑内谷氨酸含量增加:有证据表明,兴奋性氨基酸递质和凋亡有密切关系[3]。用谷氨酸受体拮抗剂MK-801可以有效地拮抗海人酸(一种拟谷氨酸的强力兴奋性神经毒物)诱导的细胞凋亡[7],说明兴奋性神经递质谷氨酸可以诱导神经细胞出现凋亡。作者研究发现DM可以使大鼠脑组织中谷氨酸的含量增加, 且突触前膜释放增多,造成谷氨酸在突触间隙的堆积[4]。因此DM导致的大鼠脑组织中谷氨酸含量增加,可能是DM诱导神经细胞凋亡的重要因素;②神经细胞内Ca2+浓度的升高:DM可以明显升高神经细胞内Ca2+的浓度,而Ca2+浓度的升高可以激活Ca2+依赖性的DNA内切酶,使DNA降解,发生片段化,从而诱发凋亡;③自由基的作用:氧化应激和凋亡有密切关系[7],本文作者发现,DM可以明显增加大鼠脑组织中丙二醛(MDA)的含量,显著抑制超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶 (GSH-Px)的活性,并显著降低脑组织中谷胱甘肽的含量,说明DM可以损害大鼠脑组织中抗氧化系统的功能,使自由基含量增加,大鼠脑组织处于氧化应激状态,从而使神经细胞出现凋亡。④一氧化氮合酶(nitric oxide synthase,NOS)的激活:本文作者曾观察到,DM可以激活大鼠脑组织皮层、海马和小脑中的NOS,使脑组织内一氧化氮(NO)含量升高[9]。NO本身是一种自由基,可以直接造成DNA损伤,或通过脱氨基作用,或与超氧阴离子生成更具毒性的自由基,造成DNA损伤。另外有观点认为,NO也可以抑制细胞的凋亡现象[10]。因此,NO在DM诱导神经细胞凋亡中的作用机理有待进一步深入的研究。
, http://www.100md.com
凋亡的机理十分复杂,本文只是根据自己的研究,就DM诱导脑细胞凋亡的可能机理进行了初步探讨,其确切的机理应该进行更加深入的研究。另外,凋亡的确定,需要从形态学、生物化学、分子生物学等多方面加以验证,本文只从两个方面初步研究,仅能说明DM有可能诱发脑细胞凋亡。凋亡的肯定还需要进一步研究证实。(本文图2见插图第3页)
注:国家自然科学基金重点课题(No:39430110)
参考文献
1.谢卓丘,童英,冯致英,等.溴氰菊酯对大鼠脊髓中递质氨基酸含量的影响. 卫生毒理学杂志, 1987,1(1):12
2.Chugh YA, Sankaranaryanan A, Sharma PL. MK-801 antagonizes the lethal action of centrally and peripherally administered cypermethrin in mice and rats. J Pharm Pharmacol, 1992,44:521
, 百拇医药
3.Kato H, Araki T, Kogure K.Role of the excitatoxic mechanism in the development of neurnal damage of following repeated brief cerebral ischemia in the gerbil: protective effects of MK-801 and pentobartal. Brain Res, 1990,516:175
4.牛玉杰,石年,李龙,等.拟除虫菊酯对大鼠脑组织谷氨酸和天门冬氨酸含量的影响.河北医科大学学报,1999,20(1):1
5.Dilday JE, Leslie SW.Ethanol inhibits NMDA-induced increase in free intracellular Ca2+ in dissociated brain cells.Brain Res.1989,499(3):383
, 百拇医药
6.Ormerod GM.Flow cytometry.Oxford UK.Information Press, 1994.48~51
7.Kure S, Tominavea T, Yoshimoto T, et al. Glutamate triggers innernucleosomal DNA cleavage in neuronal cells. Biochem Biophys Res Common, 1991,179:39
8.惠宏襄,赵小宁,金明,等.自由基与细胞凋亡.生物化学与生物物理进展,1996,23(1):12
9.牛玉杰,石年,吴爱国,等.溴氰菊酯对大鼠中枢神经系统一氧化氮合酶活性的影响.卫生毒理学杂志,1997,11(2):75
10.Genaro AM, Horlclano S, Alvarez A, et al. Splenic B lymophocyte programmed cell death is prevented by nitric oxide release through mechanisms involing sustained Bcl-2 levels. J Clin Invest, 1995,95:1884
(1998-07-30 收稿), 百拇医药
单位:牛玉杰 河北医科大学公共卫生学院劳动卫生学教研室 石家庄 050017石年 严红 刘毓谷 同济医科大学环境毒理教研室
关键词:除虫菊酯类/毒性;谷氨酸盐类/代谢;天门冬氨酸/代谢;脑;大鼠
河北医科大学学报990201 摘 要 目的 研究溴氰菊酯(DM)对大鼠脑细胞DNA的损伤作用。方法 用流式细胞仪观察了DM处理后大鼠脑细胞DNA片段化的发生情况;用荧光染色法观察了DM作用后大鼠分离脑细胞核的形态变化。结果 用流式细胞仪进行检测,发现DM可以使大鼠脑组织皮层、海马和小脑部位DNA片段化的细胞数明显增加;同时DM可以使分离的脑细胞DNA受到损伤, 细胞核出现染色质浓缩、边缘不整齐、碎裂或环状等类似凋亡的形态学改变。结论 DM可以损伤脑细胞的DNA,有可能诱发神经细胞的凋亡。
中图号 TQ456.3
, http://www.100md.com
DAMAGING EFFECT OF DELTAMETHRIN ON DNA OF RAT NEURAL CELLS
Niu Yujie
Department of Occupational Health, the School of Public Health,Hebei Medical University (Shijiazhuang 050017)
Shi Nian Yan Hong Liu Yugu
Department of Environmental Toxicology,Tongji Medical University
ABSTRACT Objective To study the damaging effects of deltamethrin(DM) on the DNA of rat neural cells.Methods With flow cytometry,the DNA fragmentation by DM in rat brain was measured.The morphological changes of nucleus by DM on rat dissociated neural cells were observed with fluorescent nuclear staining. Results Under the effect of DM, the number of DNA fragmental cells in cerebral cortex, hippocampus and cerebellum significantly increased,and the DNA of dissociated neural cells appeared some morphological changes like apoptosis. Conclusion DM may elicit apoptosis of rat neural cells through the DNA damage.
, 百拇医药
MeSH pyrethrins/tox;glutamate/metab;aspartic acid/metab;brain;rats
溴氰菊酯(Deltamethrin,DM) 是拟除虫菊酯类农药的一种,因其具有杀虫谱广、低残留等优点,广泛应用于防治农业害虫、仓储害虫等方面。近年来,拟除虫菊酯对哺乳动物神经毒性的问题日益受到人们的关注。哺乳动物DM急性中毒时主要表现为中枢神经系统的强烈兴奋性症状,其发生发展和脑内兴奋性氨基酸(excitatory amino acid,EAA) 递质含量(主要是谷氨酸)有很好的相关性[1];用谷氨酸N-甲基-D-门冬氨酸(N-methyl-D-aspartic acid,NMDA)受体特异性阻断剂MK-801可以有效拮抗DM所致的兴奋性神经毒性[2] ,提示DM可能通过兴奋性神经递质产生其神经毒性作用。
中枢神经系统内EAA的变化,可以造成神经细胞的多种损伤,并可以诱发神经细胞凋亡。神经细胞发生凋亡时,DNA结构受到损害,出现特有的形态变化如染色质浓缩、细胞核碎裂、片段化、电泳呈现“梯状”条带等。有研究表明EAA与细胞凋亡有密切关系[3]。本文发现DM可使大鼠脑组织中谷氨酸含量增加,且突触前膜谷氨酸释放增多,突触间隙谷氨酸聚积[4]。在此基础上,本文观察了DM对大鼠脑细胞DNA的损伤作用,以便为探讨DM和神经细胞凋亡的关系,揭示DM神经毒作用的机理打下基础。
, http://www.100md.com
1 材料和方法
1.1 材料:①溴氰菊酯,法国罗素.优克福公司产品,纯度>98.0%;DMEM培养基、胎牛血清为Gbico公司产品;胰蛋白酶、溴化乙啶(EB)、丫啶橙(AO)为Sigma公司产品;其它试剂均为国产分析纯。② PM-10ADS 荧光显微镜(日本Olympus公司产品);FACS 420型流式细胞仪(美国Becton-Dickinson公司产品)。
1.2 方法
1.2.1 应用流式细胞仪检测脑细胞DNA的损伤
1.2.1.1 雄性Wistar大鼠,体质量180~220 g,由同济医科大学实验动物中心提供。DM先用二甲亚砜溶解,再用蒸馏水稀释成所需浓度的混悬液。将动物随机分为2组,每组6只,进行如下处理:①对照组,腹腔注射给予1%浓度的二甲亚砜;②DM处理组,腹腔注射给予20 mg/kg体质量的DM。所有动物均于处理后1小时断头处死,取出脑组织,冰盘上分离出大脑皮层、海马和小脑,剔除软脑膜和血管,70%乙醇固定24小时以上。
, 百拇医药
1.2.1.2 将待测脑组织制成1×109/L的单细胞悬液,加入EB染液(浓度为10 μg/ml,内含1 mg/ml的柠檬酸钠,0.546 mg/ml的NaCl和0.01 mg/ml的RNAase,pH=7.2~7.6),4℃冰箱内反应30分钟,即可上机分析。
1.2.1.3 用FACS 420型流式细胞仪进行检测。检测条件为2W氩离子激光器,输出功率300 mW,激发波长488 nm,发射波长605 nm。测量数据和图形输入HP-300 Consort 30计算机,应用相应软件进行处理。测定前以鸡血红细胞调整仪器的CV值在5.0%以内。
1.2.1.4 以发生DNA片段化的细胞数占观察细胞的百分率为检测指标,同时观察细胞内DNA的平均荧光强度。
1.2.2 分离脑细胞DNA损伤的形态观察
, 百拇医药 1.2.2.1 单细胞悬液的制备参照Dildy和Leslie[5]介绍的方法进行。取新生Wistar大鼠(1~3天,由同济医科大学实验动物中心提供)断头处死,剥离出全部脑组织,剔除软脑膜和血管, 用Hanks液冲洗两遍, 置小烧杯中剪碎, 加入0.25%胰蛋白酶,于37℃恒温水浴中震荡消化20分钟,消化过程中不断通入95%O2和5%CO2的混合气体(60个气泡/min)。消化结束后过200 目筛网,滤液1 000 r/min离心5分钟,再用Hanks液洗一次, 最后用含10%胎牛血清的DMEM培养基制成单细胞悬液,调整细胞密度为2×109/L。用台盼蓝染色检查细胞存活率,要求不低于95%。
1.2.2.2 取上述制备好的单细胞悬液,加入终浓度为200 nmol/L的DM,37℃温育,不断通入95%O2和5%CO2的混合气体(60个气泡/min)。分别于加入DM后15、30、60、120分钟时取细胞悬液进行涂片,将涂片在室温下自然干燥,用1∶10 000的AO染色,荧光显微镜下观察细胞核形态的变化。
, 百拇医药
1.2.2.3 预试验时用DM处理分离的脑细胞,于不同时间点涂片进行观察,发现30分钟以前很少有凋亡现象发生。每个时间点涂片3张,每张涂片观察5个视野,每个视野不少于10个细胞;随着时间的延长,细胞核开始出现凋亡的形态变化。当时间延长至2.5小时,用台盼蓝染色,发现细胞自然死亡率超过10%,故以2小时为观察时限。
2 结果
2.1 DM对DNA损伤的流式细胞仪检测:用DM处理大鼠后,皮层、海马和小脑组织中, 出现凋亡峰的细胞明显增多(图1),表现为DNA片段化阳性细胞率显著高于对照组(P<0.01)。同时,胞内DNA平均荧光强度下降,以皮层最为明显,说明DNA断裂后,结合EB的能力下降,从而使其荧光强度有所降低,见表1。
表1 溴氰菊酯对DNA损伤的流式细胞分析
Table 1 Damage of DM on the DNA in rat brain
, 百拇医药
(
 ±s) Gronp
±s) GronpRate of Sub G0/G1 cells
Average fluorescence
Cortex
Hippocampus
Cerebellum
Cortex
Hippocampus
Cerebellum
, 百拇医药 Control
2.1±0.4
2.2±0.5
2.5±0.8
47.0±1.6
48.2±1.8
46.2±1.9
DM
13.7±1.4**
16.2±2.7**
8.0±0.8**
, 百拇医药
34.8±11.0*
40.0±8.4
43.6±7.7
Comparison with control *P<0.05 (Bilateral t test) **P<0.01


图1 DNA损伤的流式细胞检测 A 正常的DNA组方图 B DM处理后,有凋亡峰出现,箭头所指即为凋亡峰
Figure 1 DNA histogram analysed by FCM A Normal control DNA histogram B DM treatment,solid arrow represents Ap peak
, 百拇医药
2.2 DM对分离脑细胞DNA的损伤:正常情况下胞核染色近似圆形,边缘清楚,染色均匀(图2-A)。当细胞发生凋亡时,细胞核染色体凝集成块,着色较重,且细胞缩小,因核膜仍然存在,故DNA虽然碎裂,但仍集中在一起。图2-B显示细胞核碎裂成3块,图2-C显示细胞核碎裂成多块;图2-D显示染色质开始浓缩,边缘不整齐;图2-E显示染色质浓缩,靠近核膜,从而形成环状DNA;图2-F~H可见凋亡小体的形成过程,染色质浓缩,边缘不整,图9可见凋亡小体从细胞核分裂出来。








, 百拇医药
A 正常形态的DNA,×200 (孵育15分钟)
B DNA细胞核碎裂为3块,×400 (孵育60分钟)
C 细胞核碎裂为多部分,但尚未形成凋亡小体,×400 (孵育30分钟)
D 凋亡细胞染色体凝集成块,边缘不整齐,×200 (孵育30分钟)
E 染色质靠近核膜,形成环状DNA,×400 (孵育90分钟)
F 染色质浓缩,可见凋亡小体的形成过程,×200 (孵育60分钟)
G 染色质浓缩,可见凋亡小体的形成过程,×400 (孵育120分钟)
H 凋亡小体从细胞核分裂出来,×200 (孵育120分钟)
, 百拇医药
图2 DM对分离神经细胞DNA的损伤(AO染色)A DNA in normal state,×200(incubated 15 min)
B DNA broke into three pieces,×400(incubated 60 min)
C DNA broke into many pieces,×400(incubated 30 min)
D Early stage of apoptotic cells,×200(incubated 30 min)
E A ring-like shape DNA,×400(incubated 90 min)
F Early stage of apoptotic cells, ×200(incubated 60 min)
, 百拇医药
G Early stage of apoptotic cells, ×400(incubated 120 min)
H Apoptotic body separated from nuclear, ×200(incubated 120 min)
Figure 2 Damage of DM on the DNA in rat dissociated neural cells(Stained by AO)
3 讨论
生长、分化和死亡是细胞生命活动的正常过程。死亡分为坏死和凋亡两种方式。近年来,凋亡已成为生命科学及细胞学研究的又一个热点。
本研究发现,DM作用于分离的脑细胞后,使其细胞核的形态发生变化,出现凋亡的形态学特征;用FCM进行检测, 如果细胞DNA发生损伤时,DNA片段化并降解,则在DNA组方图中,表现为G0/G1期峰之前出现一个低于G0/G1期DNA含量的亚二倍体峰,又叫凋亡峰(AP峰)。正常细胞仅有G0/G1期、S期、G2/M期, AP峰的出现,说明细胞中DNA碎裂为片段[6]。 DM处理后,脑细胞有凋亡峰出现,细胞片段化的百分率明显上升;以上结果说明DM很可能损害脑细胞的DNA,诱导神经细胞出现凋亡。
, http://www.100md.com
凋亡的诱导机理十分复杂,目前仍不十分明了。DM作为一种外来化合物,诱导神经细胞出现凋亡可能有以下几种途径:①脑内谷氨酸含量增加:有证据表明,兴奋性氨基酸递质和凋亡有密切关系[3]。用谷氨酸受体拮抗剂MK-801可以有效地拮抗海人酸(一种拟谷氨酸的强力兴奋性神经毒物)诱导的细胞凋亡[7],说明兴奋性神经递质谷氨酸可以诱导神经细胞出现凋亡。作者研究发现DM可以使大鼠脑组织中谷氨酸的含量增加, 且突触前膜释放增多,造成谷氨酸在突触间隙的堆积[4]。因此DM导致的大鼠脑组织中谷氨酸含量增加,可能是DM诱导神经细胞凋亡的重要因素;②神经细胞内Ca2+浓度的升高:DM可以明显升高神经细胞内Ca2+的浓度,而Ca2+浓度的升高可以激活Ca2+依赖性的DNA内切酶,使DNA降解,发生片段化,从而诱发凋亡;③自由基的作用:氧化应激和凋亡有密切关系[7],本文作者发现,DM可以明显增加大鼠脑组织中丙二醛(MDA)的含量,显著抑制超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶 (GSH-Px)的活性,并显著降低脑组织中谷胱甘肽的含量,说明DM可以损害大鼠脑组织中抗氧化系统的功能,使自由基含量增加,大鼠脑组织处于氧化应激状态,从而使神经细胞出现凋亡。④一氧化氮合酶(nitric oxide synthase,NOS)的激活:本文作者曾观察到,DM可以激活大鼠脑组织皮层、海马和小脑中的NOS,使脑组织内一氧化氮(NO)含量升高[9]。NO本身是一种自由基,可以直接造成DNA损伤,或通过脱氨基作用,或与超氧阴离子生成更具毒性的自由基,造成DNA损伤。另外有观点认为,NO也可以抑制细胞的凋亡现象[10]。因此,NO在DM诱导神经细胞凋亡中的作用机理有待进一步深入的研究。
, http://www.100md.com
凋亡的机理十分复杂,本文只是根据自己的研究,就DM诱导脑细胞凋亡的可能机理进行了初步探讨,其确切的机理应该进行更加深入的研究。另外,凋亡的确定,需要从形态学、生物化学、分子生物学等多方面加以验证,本文只从两个方面初步研究,仅能说明DM有可能诱发脑细胞凋亡。凋亡的肯定还需要进一步研究证实。(本文图2见插图第3页)
注:国家自然科学基金重点课题(No:39430110)
参考文献
1.谢卓丘,童英,冯致英,等.溴氰菊酯对大鼠脊髓中递质氨基酸含量的影响. 卫生毒理学杂志, 1987,1(1):12
2.Chugh YA, Sankaranaryanan A, Sharma PL. MK-801 antagonizes the lethal action of centrally and peripherally administered cypermethrin in mice and rats. J Pharm Pharmacol, 1992,44:521
, 百拇医药
3.Kato H, Araki T, Kogure K.Role of the excitatoxic mechanism in the development of neurnal damage of following repeated brief cerebral ischemia in the gerbil: protective effects of MK-801 and pentobartal. Brain Res, 1990,516:175
4.牛玉杰,石年,李龙,等.拟除虫菊酯对大鼠脑组织谷氨酸和天门冬氨酸含量的影响.河北医科大学学报,1999,20(1):1
5.Dilday JE, Leslie SW.Ethanol inhibits NMDA-induced increase in free intracellular Ca2+ in dissociated brain cells.Brain Res.1989,499(3):383
, 百拇医药
6.Ormerod GM.Flow cytometry.Oxford UK.Information Press, 1994.48~51
7.Kure S, Tominavea T, Yoshimoto T, et al. Glutamate triggers innernucleosomal DNA cleavage in neuronal cells. Biochem Biophys Res Common, 1991,179:39
8.惠宏襄,赵小宁,金明,等.自由基与细胞凋亡.生物化学与生物物理进展,1996,23(1):12
9.牛玉杰,石年,吴爱国,等.溴氰菊酯对大鼠中枢神经系统一氧化氮合酶活性的影响.卫生毒理学杂志,1997,11(2):75
10.Genaro AM, Horlclano S, Alvarez A, et al. Splenic B lymophocyte programmed cell death is prevented by nitric oxide release through mechanisms involing sustained Bcl-2 levels. J Clin Invest, 1995,95:1884
(1998-07-30 收稿), 百拇医药