甲状腺乳头状癌端粒酶活性的研究*
作者:黄雄飞 张鹏飞 程金妹 林英 杨代兴
单位:黄雄飞 张鹏飞 杨代兴 (福建医科大学病理解剖学教研室 福州 350004); 程金妹 林英 (福建医科大学附属第一医院耳鼻咽喉研究所)
关键词:甲状腺肿瘤;端粒酶;诊断
福建医科大学学报990201
目的 通过检测甲状腺乳头状癌中的端粒酶活性,探讨其在甲状腺乳头状癌中潜在的临床价值。方法 采用TRAP-PCR-ELISA定量及TRAP-PCR银染定性法,对49份甲状腺组织进行端粒酶活性的分析。结果 23例甲状腺乳头状癌组织中端粒酶阳性率为86.9%,其活性水平与组织学分级无关,病灶越大,年龄越大,病期越晚,端粒酶活性水平越高,淋巴结转移者高于无转移者。10例甲状腺正常组织端粒酶皆为阴性。8例甲状腺滤泡性腺瘤和8例甲状腺肿端粒酶阳性率均为12.5%。结论 端粒酶是特异性较强的恶性肿瘤标记物,可作为甲状腺乳头状癌辅助诊断的良好指标,对端粒酶的深入研究将有助于发展新的肿瘤诊断和治疗方法。
, http://www.100md.com
Detection of Telomerase Activity in Papillary Thyroid Carcinoma
Huang Xiongfei Zhang Pengfei
(Department of Pathology)
Cheng Jinmei
(Institute of Otorhinolaryngology,The Affiliated First Hospital,Fujian Medical University,Fuzhou,350004)
Objective To detect the telomerase activity in human papillary thyroid carcinoma,and investigate its potential clinical valuation.Methods A total of 49 human thyroid tissue specimens were examined by the techniques of TRAP-PCR-ELISA and TRAP- silver staining.Results Positive rate of telomerase activity detected in 23 papillary thyroid carcinoma(86.9%) was significantly higher in comparison to that in 8 follicular adenomas(12.5%) and in 8 goiters(12.5%).No telomerase activity in 10 normal thyroid tissues was detected.The levels of telomerase activity in papillary thyroid cancer patients with larger tumor elder age,higher stage and with lymph node metastases had higher levels of telomerase aetivity,showed no correlation with histological grades.Conclusion Telomerase may be a good biomarker,helpful to the diagnosis of papillary thyroid carcinoma.
, 百拇医药
Key words thyroid carcinoma;telomerase;diagnosis
目前许多学者认为,端粒酶的激活和端粒长度的稳定是肿瘤细胞的永生化所必需[1]。人正常体细胞和良性病变组织中端粒酶常阴性,而大多数恶性肿瘤端粒酶呈阳性,端粒酶的激活可能是肿瘤发生过程的关键性步骤。甲状腺乳头状癌(papillary thyroid cancinoma,PTC)是最常见的甲状腺恶性肿瘤,好发于年轻女性,肿瘤生长较缓慢,具强烈的局部淋巴结转移倾向。临床上术前确诊比较困难。笔者采用TRAP-PCR-ELISA定量及TRAP-PCR银染定性方法,对PTC和甲状腺良性病变进行检测,探讨端粒酶在PTC中的表达情况及其临床意义,并探讨其在肿瘤诊断和治疗方面的应用前景。
1 材料与方法
1.1 标本来源 手术切除的23例甲状腺乳头状癌组织,8例甲状腺滤泡性腺瘤,8例甲状腺肿,10例甲状腺正常组织,均来自福建医科大学附属第一医院。所有的标本术后均经过病理验证。
, http://www.100md.com
1.2 试剂 端粒酶 PCR ELISA检测试剂盒(Boehrimger Manheim),阳性对照为肿瘤细胞293细胞株(端粒酶检测试剂盒提供)。
1.3 标本制备 标本于冰上用眼科剪剪成薄片后加入裂解液100~200μl,混匀,置4℃1~2h,15000r/min离心15min,吸取上清,置-30℃保存备用,同时测定蛋白含量。
1.4 TRAP-PCR-ELISA 参考张行等方法[2]将标本提取液进行PCR扩增,将PCR产物进行杂交和ELISA检测,在酶标仪上读取波长450 nm的吸光度A值。
1.5 聚丙烯酰胺凝胶电泳 取PCR产物进行12%非变性聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳条件为180V80 min。
1.6 统计分析 采用SAS软件包行多元方差分析,P<0.05有统计学意义。
, 百拇医药
2 结 果
2.1 甲状腺组织端粒酶活性的定性分析见表1。端粒酶活性阳性标本经PCR扩增形成6个核苷酸重复片段,在银染的SDS-PAGE凝胶上形成等距离梯形条带图谱(附图)。
表1 甲状腺组织端粒酶阳性检出率比较(n,%) 甲状腺组织
n
阳 性
正常
10
0(0)
甲状腺肿
8
1(12.5)
, 百拇医药
滤泡性腺瘤
8
1(12.5)
乳头状癌
23
20(86.9)*
与正常组织相比,*:P<0.05(下表同).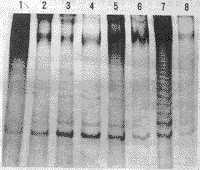
附图 甲状腺组织端粒酶活性的定性检测
1. 正常组织; 2.甲状腺肿; 3~5.乳头状癌; 6.滤泡性腺瘤; 7.阳性对照; 8.阴性对照
, http://www.100md.com 2.2 甲状腺组织中端粒酶活性水平的定量分析
2.2.1 PTC组的端粒酶活性明显高于甲状腺良性病变组和正常组(表2)。
表2 甲状腺组织中端粒酶活性水平比较 甲状腺组织
n
A值
正常
10
0.021
±
0.039
甲状腺肿
8
, http://www.100md.com
0.046
±
0.054
滤泡性腺瘤
8
0.044
±
0.050
乳头状癌
23
0.213
±
0.110*
, http://www.100md.com
2.2.2 端粒酶活性水平与PTC的病灶大小、年龄、组织学分级及病理分期
[3]、淋巴结转移的关系见表3。
表3 端粒酶在PTC不同临床分组中的活性水平 临床资料
A值
年龄(岁)
<45
0.157±0.052
≥45
0.287±0.126*
病灶大小(cm)
, http://www.100md.com
<1.5
0.145±0.036
≥1.5
0.297±0.119**
淋巴结转移
无
0.155±0.041
有
0.291±0.127**
组织学分级
Ⅰ~Ⅱ
0.196±0.105
, http://www.100md.com
Ⅲ~Ⅳ
0.267±0.121
病理分期
Ⅰ~Ⅱ
0.149±0.038
Ⅲ~Ⅳ
0.358±0.093**
*:P<0.05,**:P<0.01.
3 讨 论
近年来的研究表明,端粒及端粒酶在细胞衰老及恶性肿瘤形成机制中起着重要的作用。端粒是真核细胞线性染色体末端由TTAGGG重复序列及相关蛋白组成的复合结构,具有保护端区,维持染色体完整的作用。在细胞分裂过程中,由于线性DNA分子的滞后链5'末端不能完全复制,导致端粒重复片段的丢失。端粒的缩短能够限制细胞的增殖能力,因此端粒被认为是细胞的“有丝分裂钟”,是决定细胞衰老的分子标志[4]。端粒酶是由RNA和蛋白质组成的核糖核酸蛋白酶。蛋白质组分具有逆转录酶的作用,能以自身RNA为模板合成端粒序列并使其连接于染色体的端粒末端。正常体细胞分裂了一定次数后逐渐衰老,而肿瘤细胞由于端粒酶的激活维持了端粒长度的稳定,使细胞增殖逃脱了端粒长度的束缚,从而使细胞获得永生[5]。
, 百拇医药
正常组织仅生殖细胞和部分造血干细胞显示弱的端粒酶活性,良性病变绝大多数无端粒酶活性,而在恶性肿瘤中端粒酶活性检出率高达84%~
95%。由于端粒酶活性和肿瘤细胞间存在如此高的相关性,端粒酶被认为是目前最具特异性和普遍性的肿瘤标记物,它的检测不仅是肿瘤深化研究的手段,而且具有潜在的临床价值[6]。
本实验检测了23例PTC的端粒酶活性,阳性率为86.7%,显著高于16例甲状腺良性病变的端粒酶检出率(12.5%);10例正常组织中皆未发现有端粒酶表达。因此端粒酶的检测可作为PTC鉴别诊断的很有意义的辅助手段之一。
本实验采用的检测方法是改良的TRAP-PCR-ELISA。与传统的TRAP方法相比,具有定性、定量、特异敏感、简易快速、可避免同位素污染的优点。应用这种方法对脱落细胞或穿刺极微量的细胞来检测端粒酶活性已获得满意的结果[2]。因此将这种方法应用于甲状腺细针穿刺组织细胞的检测,结合病理检查不仅可有效地提高术前诊断的准确性,也可作为术后复发的依据之一。Umbricht等的研究也表明,应用甲状腺细针穿刺组织检测端粒酶活性的可行性,认为有助于病人的术前评估[7]。
, 百拇医药
端粒酶活性可能与肿瘤的某些生物学行为有关。Hiyama等[8]通过对乳腺癌的研究发现,端粒酶阳性者病灶较大,淋巴结转移率高,预后差,且晚期病人端粒酶活性阳性率明显高于早期病人。本实验发现PTC端粒酶活性水平与组织学分级无关,病灶越大,年龄越大,病期越晚,端粒酶活性水平越高,淋巴结转移者高于无转移者,显示端粒酶活性可作为判断PTC恶性程度、转移潜能的良好的参考指标,但能否作为一个独立的判断预后的指标还有待深入研究。
由于端粒酶特异地表达于各种肿瘤细胞,又是肿瘤细胞无限增殖能力所需,端粒酶被认为是研究肿瘤治疗的理想靶点[9]。研究表明,反义核苷酸、反义肽苷酸、核酶、核苷类似物以及细胞分化诱导剂等都可在不同程度上抑制端粒酶的活性。这些研究成果已显示出良好的应用前景,必将为肿瘤治疗提供新的有效方法,为人类最终战胜肿瘤带来了希望。
(本实验在浙江医科大学肿瘤研究所完成,得到张行老师和黄成刚老师的悉心指导,诚致感谢!)
, http://www.100md.com
*:福建省自然科学基金资助课题(C96043)
参考文献
1 Hiyama E,Kodama T,Shinbara K,et al.Telomerase activity is detected in pancreatic cancer but not in benign tumors.Cancer Res, 1997;57:326
2 张 行,应可净,蔡心涵,等.纤维支气管镜直视下肺刷落细胞端粒酶活性的检测.中华肿瘤杂志, 1998;20:431
3 陈忠丰,沈铭昌,郭慕依(主编).实用外科病理学.上海:上海医科大学出版社,1997∶681
4 Allsopp RC,Vaziri H,Patterson C,et al.Telomere length predicts replicative capacity of human fibroblasts.Proc Natl Acad USA,1992;89:10114
, 百拇医药
5 Feng J,Funk WD,Wang S,et al.The RNA component of human telomerase.Science,1995;269:1236
6 Kim NW,Piatyzek MA, Prowse KR,et al.Specific association of human telomerase activity with immortal cells and cancer.Science,1994;266:2011
7 Umbricht CB,Saji M;Westra WH,et al.Telomerase activity:A marker to distinguish follicular thyroid adenoma from carcinoma.Cancer Res,1997;57:2144
8 Hiyama E,Collahan L,Kataoka T,et al.Telomerase activity in human breast tumors.J Natl Cancer Inst,1996;88:116
9 Marx J.Chromosome end catch fire.Science,1994;265:1656
(收稿:1999-02-03 修回:1999-03-31), 百拇医药
单位:黄雄飞 张鹏飞 杨代兴 (福建医科大学病理解剖学教研室 福州 350004); 程金妹 林英 (福建医科大学附属第一医院耳鼻咽喉研究所)
关键词:甲状腺肿瘤;端粒酶;诊断
福建医科大学学报990201
目的 通过检测甲状腺乳头状癌中的端粒酶活性,探讨其在甲状腺乳头状癌中潜在的临床价值。方法 采用TRAP-PCR-ELISA定量及TRAP-PCR银染定性法,对49份甲状腺组织进行端粒酶活性的分析。结果 23例甲状腺乳头状癌组织中端粒酶阳性率为86.9%,其活性水平与组织学分级无关,病灶越大,年龄越大,病期越晚,端粒酶活性水平越高,淋巴结转移者高于无转移者。10例甲状腺正常组织端粒酶皆为阴性。8例甲状腺滤泡性腺瘤和8例甲状腺肿端粒酶阳性率均为12.5%。结论 端粒酶是特异性较强的恶性肿瘤标记物,可作为甲状腺乳头状癌辅助诊断的良好指标,对端粒酶的深入研究将有助于发展新的肿瘤诊断和治疗方法。
, http://www.100md.com
Detection of Telomerase Activity in Papillary Thyroid Carcinoma
Huang Xiongfei Zhang Pengfei
(Department of Pathology)
Cheng Jinmei
(Institute of Otorhinolaryngology,The Affiliated First Hospital,Fujian Medical University,Fuzhou,350004)
Objective To detect the telomerase activity in human papillary thyroid carcinoma,and investigate its potential clinical valuation.Methods A total of 49 human thyroid tissue specimens were examined by the techniques of TRAP-PCR-ELISA and TRAP- silver staining.Results Positive rate of telomerase activity detected in 23 papillary thyroid carcinoma(86.9%) was significantly higher in comparison to that in 8 follicular adenomas(12.5%) and in 8 goiters(12.5%).No telomerase activity in 10 normal thyroid tissues was detected.The levels of telomerase activity in papillary thyroid cancer patients with larger tumor elder age,higher stage and with lymph node metastases had higher levels of telomerase aetivity,showed no correlation with histological grades.Conclusion Telomerase may be a good biomarker,helpful to the diagnosis of papillary thyroid carcinoma.
, 百拇医药
Key words thyroid carcinoma;telomerase;diagnosis
目前许多学者认为,端粒酶的激活和端粒长度的稳定是肿瘤细胞的永生化所必需[1]。人正常体细胞和良性病变组织中端粒酶常阴性,而大多数恶性肿瘤端粒酶呈阳性,端粒酶的激活可能是肿瘤发生过程的关键性步骤。甲状腺乳头状癌(papillary thyroid cancinoma,PTC)是最常见的甲状腺恶性肿瘤,好发于年轻女性,肿瘤生长较缓慢,具强烈的局部淋巴结转移倾向。临床上术前确诊比较困难。笔者采用TRAP-PCR-ELISA定量及TRAP-PCR银染定性方法,对PTC和甲状腺良性病变进行检测,探讨端粒酶在PTC中的表达情况及其临床意义,并探讨其在肿瘤诊断和治疗方面的应用前景。
1 材料与方法
1.1 标本来源 手术切除的23例甲状腺乳头状癌组织,8例甲状腺滤泡性腺瘤,8例甲状腺肿,10例甲状腺正常组织,均来自福建医科大学附属第一医院。所有的标本术后均经过病理验证。
, http://www.100md.com
1.2 试剂 端粒酶 PCR ELISA检测试剂盒(Boehrimger Manheim),阳性对照为肿瘤细胞293细胞株(端粒酶检测试剂盒提供)。
1.3 标本制备 标本于冰上用眼科剪剪成薄片后加入裂解液100~200μl,混匀,置4℃1~2h,15000r/min离心15min,吸取上清,置-30℃保存备用,同时测定蛋白含量。
1.4 TRAP-PCR-ELISA 参考张行等方法[2]将标本提取液进行PCR扩增,将PCR产物进行杂交和ELISA检测,在酶标仪上读取波长450 nm的吸光度A值。
1.5 聚丙烯酰胺凝胶电泳 取PCR产物进行12%非变性聚丙烯酰胺凝胶电泳(SDS-PAGE),电泳条件为180V80 min。
1.6 统计分析 采用SAS软件包行多元方差分析,P<0.05有统计学意义。
, 百拇医药
2 结 果
2.1 甲状腺组织端粒酶活性的定性分析见表1。端粒酶活性阳性标本经PCR扩增形成6个核苷酸重复片段,在银染的SDS-PAGE凝胶上形成等距离梯形条带图谱(附图)。
表1 甲状腺组织端粒酶阳性检出率比较(n,%) 甲状腺组织
n
阳 性
正常
10
0(0)
甲状腺肿
8
1(12.5)
, 百拇医药
滤泡性腺瘤
8
1(12.5)
乳头状癌
23
20(86.9)*
与正常组织相比,*:P<0.05(下表同).

附图 甲状腺组织端粒酶活性的定性检测
1. 正常组织; 2.甲状腺肿; 3~5.乳头状癌; 6.滤泡性腺瘤; 7.阳性对照; 8.阴性对照
, http://www.100md.com 2.2 甲状腺组织中端粒酶活性水平的定量分析
2.2.1 PTC组的端粒酶活性明显高于甲状腺良性病变组和正常组(表2)。
表2 甲状腺组织中端粒酶活性水平比较 甲状腺组织
n
A值
正常
10
0.021
±
0.039
甲状腺肿
8
, http://www.100md.com
0.046
±
0.054
滤泡性腺瘤
8
0.044
±
0.050
乳头状癌
23
0.213
±
0.110*
, http://www.100md.com
2.2.2 端粒酶活性水平与PTC的病灶大小、年龄、组织学分级及病理分期
[3]、淋巴结转移的关系见表3。
表3 端粒酶在PTC不同临床分组中的活性水平 临床资料
A值
年龄(岁)
<45
0.157±0.052
≥45
0.287±0.126*
病灶大小(cm)
, http://www.100md.com
<1.5
0.145±0.036
≥1.5
0.297±0.119**
淋巴结转移
无
0.155±0.041
有
0.291±0.127**
组织学分级
Ⅰ~Ⅱ
0.196±0.105
, http://www.100md.com
Ⅲ~Ⅳ
0.267±0.121
病理分期
Ⅰ~Ⅱ
0.149±0.038
Ⅲ~Ⅳ
0.358±0.093**
*:P<0.05,**:P<0.01.
3 讨 论
近年来的研究表明,端粒及端粒酶在细胞衰老及恶性肿瘤形成机制中起着重要的作用。端粒是真核细胞线性染色体末端由TTAGGG重复序列及相关蛋白组成的复合结构,具有保护端区,维持染色体完整的作用。在细胞分裂过程中,由于线性DNA分子的滞后链5'末端不能完全复制,导致端粒重复片段的丢失。端粒的缩短能够限制细胞的增殖能力,因此端粒被认为是细胞的“有丝分裂钟”,是决定细胞衰老的分子标志[4]。端粒酶是由RNA和蛋白质组成的核糖核酸蛋白酶。蛋白质组分具有逆转录酶的作用,能以自身RNA为模板合成端粒序列并使其连接于染色体的端粒末端。正常体细胞分裂了一定次数后逐渐衰老,而肿瘤细胞由于端粒酶的激活维持了端粒长度的稳定,使细胞增殖逃脱了端粒长度的束缚,从而使细胞获得永生[5]。
, 百拇医药
正常组织仅生殖细胞和部分造血干细胞显示弱的端粒酶活性,良性病变绝大多数无端粒酶活性,而在恶性肿瘤中端粒酶活性检出率高达84%~
95%。由于端粒酶活性和肿瘤细胞间存在如此高的相关性,端粒酶被认为是目前最具特异性和普遍性的肿瘤标记物,它的检测不仅是肿瘤深化研究的手段,而且具有潜在的临床价值[6]。
本实验检测了23例PTC的端粒酶活性,阳性率为86.7%,显著高于16例甲状腺良性病变的端粒酶检出率(12.5%);10例正常组织中皆未发现有端粒酶表达。因此端粒酶的检测可作为PTC鉴别诊断的很有意义的辅助手段之一。
本实验采用的检测方法是改良的TRAP-PCR-ELISA。与传统的TRAP方法相比,具有定性、定量、特异敏感、简易快速、可避免同位素污染的优点。应用这种方法对脱落细胞或穿刺极微量的细胞来检测端粒酶活性已获得满意的结果[2]。因此将这种方法应用于甲状腺细针穿刺组织细胞的检测,结合病理检查不仅可有效地提高术前诊断的准确性,也可作为术后复发的依据之一。Umbricht等的研究也表明,应用甲状腺细针穿刺组织检测端粒酶活性的可行性,认为有助于病人的术前评估[7]。
, 百拇医药
端粒酶活性可能与肿瘤的某些生物学行为有关。Hiyama等[8]通过对乳腺癌的研究发现,端粒酶阳性者病灶较大,淋巴结转移率高,预后差,且晚期病人端粒酶活性阳性率明显高于早期病人。本实验发现PTC端粒酶活性水平与组织学分级无关,病灶越大,年龄越大,病期越晚,端粒酶活性水平越高,淋巴结转移者高于无转移者,显示端粒酶活性可作为判断PTC恶性程度、转移潜能的良好的参考指标,但能否作为一个独立的判断预后的指标还有待深入研究。
由于端粒酶特异地表达于各种肿瘤细胞,又是肿瘤细胞无限增殖能力所需,端粒酶被认为是研究肿瘤治疗的理想靶点[9]。研究表明,反义核苷酸、反义肽苷酸、核酶、核苷类似物以及细胞分化诱导剂等都可在不同程度上抑制端粒酶的活性。这些研究成果已显示出良好的应用前景,必将为肿瘤治疗提供新的有效方法,为人类最终战胜肿瘤带来了希望。
(本实验在浙江医科大学肿瘤研究所完成,得到张行老师和黄成刚老师的悉心指导,诚致感谢!)
, http://www.100md.com
*:福建省自然科学基金资助课题(C96043)
参考文献
1 Hiyama E,Kodama T,Shinbara K,et al.Telomerase activity is detected in pancreatic cancer but not in benign tumors.Cancer Res, 1997;57:326
2 张 行,应可净,蔡心涵,等.纤维支气管镜直视下肺刷落细胞端粒酶活性的检测.中华肿瘤杂志, 1998;20:431
3 陈忠丰,沈铭昌,郭慕依(主编).实用外科病理学.上海:上海医科大学出版社,1997∶681
4 Allsopp RC,Vaziri H,Patterson C,et al.Telomere length predicts replicative capacity of human fibroblasts.Proc Natl Acad USA,1992;89:10114
, 百拇医药
5 Feng J,Funk WD,Wang S,et al.The RNA component of human telomerase.Science,1995;269:1236
6 Kim NW,Piatyzek MA, Prowse KR,et al.Specific association of human telomerase activity with immortal cells and cancer.Science,1994;266:2011
7 Umbricht CB,Saji M;Westra WH,et al.Telomerase activity:A marker to distinguish follicular thyroid adenoma from carcinoma.Cancer Res,1997;57:2144
8 Hiyama E,Collahan L,Kataoka T,et al.Telomerase activity in human breast tumors.J Natl Cancer Inst,1996;88:116
9 Marx J.Chromosome end catch fire.Science,1994;265:1656
(收稿:1999-02-03 修回:1999-03-31), 百拇医药