n-3脂肪酸的免疫及代谢调理作用
作者:张 斌
单位:南京军区总医院 解放军普通外科研究所(南京,210002)
关键词:n-3脂肪酸;免疫;代谢
肠外与肠内营养990217 张 斌综述 黎介寿审校
中图法分类号 R392
传统的营养配方中,不饱和脂肪酸以n-6聚不饱和脂肪酸 (polyunsaturated fatty acid,PUFA) 为主要来源,但目前n-3 PUFA已引起了人们的极大关注。一些动物及临床实验证明,在创伤、感染等应激状态下,富含n-3 PUFA(如鱼油)的营养支持,可使体重丢失减少,维持较好的细胞免疫反应,死亡率明显下降〔1,2〕。此外,膳食鱼油对心血管、肝、肾、肠道等组织器官也具有保护作用。作为一种特殊的营养素,n-3 PUFA对机体的调节作用非常广泛。本文就其对免疫及代谢的调理作用作一综述。
, 百拇医药
1 n-3 PUFA的免疫调理作用
创伤、感染等应激反应,可致机体的体液及细胞免疫系统产生损害,如中性粒细胞的杀菌功能受抑制,调理吞噬作用受损,巨噬细胞功能改变,循环中IgG、IgA、IgM水平下降,T淋巴细胞丝裂原反应及淋巴因子介导的反应均显著减弱,以及抗原提呈能力受损等。动物及临床研究都表明〔3,4〕,膳食鱼油或静脉营养中添加n-3 PUFA可避免这些免疫功能的损伤,增加机体抗应激和抗感染能力。至于 n-3 PUFA产生这些作用的机制,目前认为主要是影响花生四烯酸(arachidonic acid,AA)代谢及改变细胞膜磷脂结构,进而影响细胞功能。
1. 1 对免疫细胞花生四烯酸代谢的影响 Cathcart等人〔5~7〕的研究发现,应用n-3 PUFA 2周以上,可使细胞或组织中AA与廿烷五烯酸(eicosapentaenoic acid,EPA)的比例显著下降,表明n-3 PUFA可能以竞争方式对AA的代谢产生了影响。他们发现喂食鱼油的小鼠同喂食玉米油及椰子油的小鼠相比,其腹膜巨噬细胞释放PGE2、TXA2 的数量明显减小。在另外一些感染模型中,同样发现肝内Kupffer细胞、肺巨噬细胞〔8〕、脾细胞〔9〕产生PGE2的水平也明显降低。这些与休克、感染、器官功能衰竭有关的炎性介质是n-6 PUFA的代谢产物。n-3 PUFA可竞争性地抑制AA的代谢,改变代谢产物的类型,产生一些效能不高的“3系列”的前列腺素 (PGE3、PIG3)及“5系列”的白三烯 (LBT5),进而减轻机体的炎性反应,保护免疫系统不受损害,如附图所示。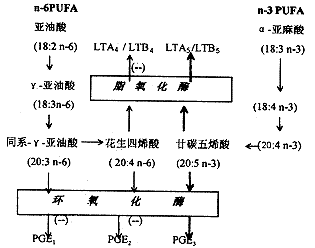
, 百拇医药
附图 n-3 PUFA抑制AA代谢的示意图
Figure Inhibition of AA metabolism by n-3 PUFA
1. 2 对细胞因子产生的影响 膳食脂肪的改变不仅对白细胞前列腺素的释放产生影响,而且炎性介质、细胞因子的调控也受到影响。Erdres等〔10〕发现食用n-3 PUFA的健康志愿者的外周血单核细胞在体外细菌刺激下,除PGE2释放减少外,TNF及IL-1(α和β)分泌也显著减少;Meydani〔11〕则从类似实验中证实了IL-6及IL-2的分泌也发生同样变化。大部分学者认为, n-3 PUFA的这一作用机制,是由于它改变了白细胞、巨噬细胞细胞膜的流动性,使其由受体及信号传导途径介导的对外部刺激的感应性及反应能力下降,导致整个细胞免疫活性的降低。这个外部刺激并不包括PGE2。但另有研究显示,PGE2对细胞因子的生成具有负反馈调节作用。n-3 PUFA既然能抑制PGE2释放,则会促进细胞因子产生。 Hardardottir及 Kinsella〔12〕在他们的腹膜巨噬细胞的体外实验中验证了这一结论。但必须指出的一点是:他们采用的细胞具有较高的同源性,缺乏邻种细胞间相互作用所产生的介质的刺激反应,因而不能代表整体水平。很多实验结果虽已经暗示n-3 PUFA对细胞因子产生能力的抑制可能导致全身性的细胞因子释放减少,但是在动物模型及临床创伤感染的病人身上,尚缺乏介导这一改变的直接证据。
, 百拇医药
2 n-3 PUFA的代谢调理作用
摄食富含n-3 PUFA的脂肪不仅可改变血浆及细胞膜的脂质构成,而且还参与了机体的代谢。在机体感染、创伤后,n-3 PUFA能减轻发热反应,降低机体的能量代谢。此外,对脂肪、糖、蛋白质的代谢都具有一定的调理作用。
2.1 对脂肪代谢的影响 由于注意到喜食鱼油的爱斯基摩人几乎没有心血管疾病的发生,于是人们对鱼油在心血管及血脂方面的影响产生了兴趣。在大量的动物实验及临床研究中,均发现鱼油具有降低血液中甘油三酯、胆固醇及非酯化脂肪酸的水平的作用,但其机制尚不明确。Geelen〔13〕等认为n-3 PUFA的降脂作用主要与减少肝脂合成有关。他们在实验研究中发现,喂食n-3 PUFA的大鼠,肝乙酰辅酶A羧化酶、脂肪酸合成酶及酰基转移酶的活性,都受到不同程度的抑制。而Harris〔14〕在其临床研究中发现给高脂血症病人服食鱼油3周,其内源性的脂蛋白酯酶(LPL)和肝脂酶(HL)的活性分别增加了62%及68%。因此,他们强调n-3 PUFA的降脂作用可能基于对血脂的分解及清除增加。n-3 PUFA对脂代谢调节作用的另一方面是对脂蛋白合成的不同影响。有研究资料表明〔15,16〕,鱼油可显著降低肝低密度脂蛋白(LDL)、极低密度脂蛋白(VLDL)的合成及结合受体的活性,而高密度脂蛋白(HDL)结合受体的活性则增加,这在一定程度上增加了机体清除血脂的能力。由于血脂的减少及脂蛋白与脂肪的结合力下降,机体对脂肪的利用也减少。Rustan等人证明,给大鼠喂食6.5%n-3 PUFA,在能量消耗无明显增加的同时,平均呼吸商(RQ)却大幅度上升,表明机体减少了脂肪氧化而转向增加氧化葡萄糖供能。
, 百拇医药
2. 2 对糖代谢的影响 n-3 PUFA对糖代谢影响的研究最早始于1967年,Mouratoff〔17〕等人发现n-3 PUFA能降低糖尿病的发生率。在后来的研究中,人们又证明它可增加胰岛素的结合力和反应性,提高胰岛素的活性。Ling〔18〕给喂食5周鱼油或大豆油的大鼠注射IL-1,结果发现前组大鼠血中胰岛素及葡萄糖水平明显低于后组,表明n-3 PUFA可减轻应激时的高胰岛素及高糖血症。有人认为,这是由于机体在感染、创伤等应激状态下, 环氧化酶、 脂氧化酶及磷脂酶产物具有第二信使的作用,可刺激胰岛素的过度分泌,而鱼油则在不同程度上抑制了这些产物的生成〔19〕。至于对葡萄糖吸收的调节,在不同组织则不尽相同。给糖尿病大鼠喂食鱼油,可使小肠对葡萄糖的摄取减少,最大转运速率(Vmax)下降近50%〔20〕。而在肌肉、脂肪等周围组织,对葡萄糖的摄取则增加,起到对全身血糖的清除作用。有人证明,这与n-3 PUFA能增加葡萄糖载体4(GLuT4)的活性及迁移有关〔21〕。n-3 PUFA对葡萄糖的氧化利用也有一定影响。在应激及糖尿病等病理状态下,血中甘油三酯及脂肪酸水平增高,由于葡萄糖-脂肪酸循环的存在,机体优先利用脂肪,使糖的氧化受到抑制,n-3 PUFA则可逆转这一现象。此外,它对葡萄糖氧化中的一些关键酶,如6-磷酸葡萄糖酶及6-磷酸葡萄糖脱氢酶也具有一定的调节作用〔22〕。
, http://www.100md.com
2 .3 对蛋白代谢的影响 脂肪强于葡萄糖的供能作用,使之在临床营养支持中的应用越来越广泛。由于对危重病人营养支持的主要目的是促进蛋白合成,特别是对于担负重要功能的脏器及免疫防御组织。因此,脂肪乳剂的节氮作用及对免疫系统的影响,是判断其优劣的重要指标 。 Alexander〔1〕及Teo〔23〕的研究显示,同样应用于烧伤后的豚鼠或大鼠,与亚油酸、红花油相比,鱼油在减轻体重丢失、促进白蛋白合成,维持氮平衡、降低代谢率及促进免疫反应方面都有突出的优点。n-3 PUFA影响蛋白质代谢的机制尚不清楚,可能与其减轻PGE2及炎性细胞因子对机体的作用有关。
3 n-3 PUFA在营养支持中的应用前景及尚待解决的问题
n-3 PUFA营养支持治疗作用的一个重要特点,就是它在细胞及机体功能水平诱导的改变较为持久。在停用10周后,其对炎性细胞因子及PGE2释放的抑制作用仍然存在〔10〕。所以对于重症感染、慢性炎症等一些炎性介质持续释放的疾病,n-3 PUFA将是极为有效的免疫调理营养素。此外,在感染状态下,机体常常存在代谢紊乱,营养配方或膳食中添加n-3 PUFA,可有利于减轻胰岛素抵抗、高脂血症及维持氮平衡。然而,n-3 PUFA在这类病人中的应用也存在一些问题,尚需进一步研究。如在何时及多久需要对炎性介质进行调控,而又不阻断其对机体的有益作用?何种免疫细胞是确实需要调控的靶细胞?如何确定补给的时限及确切的组成比例才能预防疾病的有害影响,而又不抑制机体正常的免疫反应?如何减轻n-3 PUFA的脂质过氧化反应,减少氧自由基的产生?等等。随着研究的进一步深入及制剂技术的改进,n-3 PUFA有望获得更为广阔的应用前景。
, http://www.100md.com
参考文献
1 ALexander JW,Saito H,Trocki O et al.The improtance of lipid type in the diet after burn injury.Ann Surg,1986,204:1
2 Barton RG,Wells CL,Carlson A et al .Dietary omega-3 fatty acids decreases mortality and kupffer cell prostaglandin E2 preduction in a rat model of chronic sepsis.J Trauma,1991,31:768
3 Ertel W,Morrison MH.Ayala A et al.Modulation of macrophage membrane phospholipids by n-3 polyunsaturated fatty acids increases interleukin-1 release and prevents suppression of cellular immunity following hemorrhagic shock .Arch Surg,1993,128:15
, 百拇医药
4 Daly JM,Lieberman MD,Goldfine J et al.Enteral nutrition with supplemental arginine,RNA,and omega-3 fatty acids in patients after operation:immunologic,metabolic,and clinical outcome.Surgery,1992,112:56
5 Cathcart ES,Leslie CA,Meydani SN et al. A fish oil diet retards experimental amyloidosis,modulates lymphocyte function,and decreases macrophage arachidonate metabolism in mice.J Immunol,1987,139:1850
6 Hardardottir I,Whelan J,Kinsella JE.Kinetics of tumor necrosis factor and prostaglandin production by murine resident peritoneal macrophages as affected by dietary n-3 polyunsaturated fatty acids.Immunology,1992,76:572
, http://www.100md.com
7 Brouard C,Pascaud M.Effects of moderate dietary supplementations with n-3 fatty acids on macrophage and lymphocyte phospholipids and macrophage eicosanoid synthesis in the rat. Biochim Biophys Acta,1990,1047:19
8 Meydani SN,Shapiro AC,Meydani M et al.Lung eicosanoid synthesis is affected by age ,dietary fat and vitamin E.J Nutr,1992,122:1627
9 Peck MD,Li Z,Pressman BC.Lymphocyte membrane anisotropy is affected by dietary lipids and is correlated with the lymphocyte blastogenic response to LPS.Surg Forum,1992,43:19
, http://www.100md.com
10 Endres S.Ghorbani R,Kelleg VE et al.The effect of dietary supplementation with n-3 polyunsaturated fatty acids on the synthesis of interleukin-1 and tumor necrosis factor by mononuclear cells.N Engl J Med,1989,320:265
11 Meydani SN.Modulation of cytokine production by dietary polyunsaturated fatty acids.Dietary Lipids Cytokines,1992,200:189
12 Hardardottir I,Kinsella JE.Increasing the dietary n-3 to n-6 polyunsatnrated fatty acids ratio increases tumor necrosis factor production by murine residentperitoneal maerophages.J Nutr,1992,122:1942
, 百拇医药
13 Geelen MJ,Schoots WJ,Bijleveld C et al.Dietary medium-chain fatty acid raise and (n-3) polyunsaturated fatty acdis lower hepatic triacyglycerol synthesis in rats.J Nutr,1995,125:2449
14 Harris WS,Lu G,Rambjor GS et al.Influence of n-3 fatty acid supplementation on the endogenous activities of plasma lipases.Am J Clin Nutr,1997,66:254
15 Topping DL,Illma RJ,Roach PD et al.Modulation of the hypolipidemic effect of fish oils by dietary fiber in rats:studies with rice and wheat bran.J Nutr,1990,120:325
, 百拇医药
16 Bolestrieri GP,Maffi V,Sleima I et al.Fish oil supplementation in patients with heterozygous familial hypercholesteroliemia.Recenti Prog Med,1996,87:107
17 Muratoff GJ,Carroll NV,Scott EM.Diabetes mellitus in Eskimos.J Am Med Assoc,1967,199:961
18 Clandinin MT,Cheema S,Field C et al.Ditary lipids influence insulin action.Ann N Y Acad Sci,1993,683:151
19 Robertson RP.Arachidonic acid metabolite regulation of insulin secretion.Diabetes Metab Rev,1986,2:261
, 百拇医药
20 Love J,Mulvey G,Doring K et al.Feeding an isocaloric omega-3 fatty acid diet reduces the brush border membrane vesicle uptake of glucose in streptozotocin-diabetic rats.Diabetes Res,1994,25:65
21 Sierra P,Ling PR,Istfan NW et al.Fish oil feeding improves muslce glucose uptake in tumor necrosis factor-treated rats.Metabolism,1995,44:1365
22 Chiang MT,Tsai ML.Effect of fish oil on plasma lipoproteins,liver glucose-6-phosphate dehydrogease and glucose-6-phosphatase in rats.Int J Vitam Nutr Res,1995,65:276
23 Teo TC,DeMichele SJ,Selleck KM et al.Administration of structured lipid composed of MCT and fish oil reduces net protein catabolism in enteral fed burned rats.Ann Surg,1989,210:100
(1998-09-25收稿), http://www.100md.com
单位:南京军区总医院 解放军普通外科研究所(南京,210002)
关键词:n-3脂肪酸;免疫;代谢
肠外与肠内营养990217 张 斌综述 黎介寿审校
中图法分类号 R392
传统的营养配方中,不饱和脂肪酸以n-6聚不饱和脂肪酸 (polyunsaturated fatty acid,PUFA) 为主要来源,但目前n-3 PUFA已引起了人们的极大关注。一些动物及临床实验证明,在创伤、感染等应激状态下,富含n-3 PUFA(如鱼油)的营养支持,可使体重丢失减少,维持较好的细胞免疫反应,死亡率明显下降〔1,2〕。此外,膳食鱼油对心血管、肝、肾、肠道等组织器官也具有保护作用。作为一种特殊的营养素,n-3 PUFA对机体的调节作用非常广泛。本文就其对免疫及代谢的调理作用作一综述。
, 百拇医药
1 n-3 PUFA的免疫调理作用
创伤、感染等应激反应,可致机体的体液及细胞免疫系统产生损害,如中性粒细胞的杀菌功能受抑制,调理吞噬作用受损,巨噬细胞功能改变,循环中IgG、IgA、IgM水平下降,T淋巴细胞丝裂原反应及淋巴因子介导的反应均显著减弱,以及抗原提呈能力受损等。动物及临床研究都表明〔3,4〕,膳食鱼油或静脉营养中添加n-3 PUFA可避免这些免疫功能的损伤,增加机体抗应激和抗感染能力。至于 n-3 PUFA产生这些作用的机制,目前认为主要是影响花生四烯酸(arachidonic acid,AA)代谢及改变细胞膜磷脂结构,进而影响细胞功能。
1. 1 对免疫细胞花生四烯酸代谢的影响 Cathcart等人〔5~7〕的研究发现,应用n-3 PUFA 2周以上,可使细胞或组织中AA与廿烷五烯酸(eicosapentaenoic acid,EPA)的比例显著下降,表明n-3 PUFA可能以竞争方式对AA的代谢产生了影响。他们发现喂食鱼油的小鼠同喂食玉米油及椰子油的小鼠相比,其腹膜巨噬细胞释放PGE2、TXA2 的数量明显减小。在另外一些感染模型中,同样发现肝内Kupffer细胞、肺巨噬细胞〔8〕、脾细胞〔9〕产生PGE2的水平也明显降低。这些与休克、感染、器官功能衰竭有关的炎性介质是n-6 PUFA的代谢产物。n-3 PUFA可竞争性地抑制AA的代谢,改变代谢产物的类型,产生一些效能不高的“3系列”的前列腺素 (PGE3、PIG3)及“5系列”的白三烯 (LBT5),进而减轻机体的炎性反应,保护免疫系统不受损害,如附图所示。

, 百拇医药
附图 n-3 PUFA抑制AA代谢的示意图
Figure Inhibition of AA metabolism by n-3 PUFA
1. 2 对细胞因子产生的影响 膳食脂肪的改变不仅对白细胞前列腺素的释放产生影响,而且炎性介质、细胞因子的调控也受到影响。Erdres等〔10〕发现食用n-3 PUFA的健康志愿者的外周血单核细胞在体外细菌刺激下,除PGE2释放减少外,TNF及IL-1(α和β)分泌也显著减少;Meydani〔11〕则从类似实验中证实了IL-6及IL-2的分泌也发生同样变化。大部分学者认为, n-3 PUFA的这一作用机制,是由于它改变了白细胞、巨噬细胞细胞膜的流动性,使其由受体及信号传导途径介导的对外部刺激的感应性及反应能力下降,导致整个细胞免疫活性的降低。这个外部刺激并不包括PGE2。但另有研究显示,PGE2对细胞因子的生成具有负反馈调节作用。n-3 PUFA既然能抑制PGE2释放,则会促进细胞因子产生。 Hardardottir及 Kinsella〔12〕在他们的腹膜巨噬细胞的体外实验中验证了这一结论。但必须指出的一点是:他们采用的细胞具有较高的同源性,缺乏邻种细胞间相互作用所产生的介质的刺激反应,因而不能代表整体水平。很多实验结果虽已经暗示n-3 PUFA对细胞因子产生能力的抑制可能导致全身性的细胞因子释放减少,但是在动物模型及临床创伤感染的病人身上,尚缺乏介导这一改变的直接证据。
, 百拇医药
2 n-3 PUFA的代谢调理作用
摄食富含n-3 PUFA的脂肪不仅可改变血浆及细胞膜的脂质构成,而且还参与了机体的代谢。在机体感染、创伤后,n-3 PUFA能减轻发热反应,降低机体的能量代谢。此外,对脂肪、糖、蛋白质的代谢都具有一定的调理作用。
2.1 对脂肪代谢的影响 由于注意到喜食鱼油的爱斯基摩人几乎没有心血管疾病的发生,于是人们对鱼油在心血管及血脂方面的影响产生了兴趣。在大量的动物实验及临床研究中,均发现鱼油具有降低血液中甘油三酯、胆固醇及非酯化脂肪酸的水平的作用,但其机制尚不明确。Geelen〔13〕等认为n-3 PUFA的降脂作用主要与减少肝脂合成有关。他们在实验研究中发现,喂食n-3 PUFA的大鼠,肝乙酰辅酶A羧化酶、脂肪酸合成酶及酰基转移酶的活性,都受到不同程度的抑制。而Harris〔14〕在其临床研究中发现给高脂血症病人服食鱼油3周,其内源性的脂蛋白酯酶(LPL)和肝脂酶(HL)的活性分别增加了62%及68%。因此,他们强调n-3 PUFA的降脂作用可能基于对血脂的分解及清除增加。n-3 PUFA对脂代谢调节作用的另一方面是对脂蛋白合成的不同影响。有研究资料表明〔15,16〕,鱼油可显著降低肝低密度脂蛋白(LDL)、极低密度脂蛋白(VLDL)的合成及结合受体的活性,而高密度脂蛋白(HDL)结合受体的活性则增加,这在一定程度上增加了机体清除血脂的能力。由于血脂的减少及脂蛋白与脂肪的结合力下降,机体对脂肪的利用也减少。Rustan等人证明,给大鼠喂食6.5%n-3 PUFA,在能量消耗无明显增加的同时,平均呼吸商(RQ)却大幅度上升,表明机体减少了脂肪氧化而转向增加氧化葡萄糖供能。
, 百拇医药
2. 2 对糖代谢的影响 n-3 PUFA对糖代谢影响的研究最早始于1967年,Mouratoff〔17〕等人发现n-3 PUFA能降低糖尿病的发生率。在后来的研究中,人们又证明它可增加胰岛素的结合力和反应性,提高胰岛素的活性。Ling〔18〕给喂食5周鱼油或大豆油的大鼠注射IL-1,结果发现前组大鼠血中胰岛素及葡萄糖水平明显低于后组,表明n-3 PUFA可减轻应激时的高胰岛素及高糖血症。有人认为,这是由于机体在感染、创伤等应激状态下, 环氧化酶、 脂氧化酶及磷脂酶产物具有第二信使的作用,可刺激胰岛素的过度分泌,而鱼油则在不同程度上抑制了这些产物的生成〔19〕。至于对葡萄糖吸收的调节,在不同组织则不尽相同。给糖尿病大鼠喂食鱼油,可使小肠对葡萄糖的摄取减少,最大转运速率(Vmax)下降近50%〔20〕。而在肌肉、脂肪等周围组织,对葡萄糖的摄取则增加,起到对全身血糖的清除作用。有人证明,这与n-3 PUFA能增加葡萄糖载体4(GLuT4)的活性及迁移有关〔21〕。n-3 PUFA对葡萄糖的氧化利用也有一定影响。在应激及糖尿病等病理状态下,血中甘油三酯及脂肪酸水平增高,由于葡萄糖-脂肪酸循环的存在,机体优先利用脂肪,使糖的氧化受到抑制,n-3 PUFA则可逆转这一现象。此外,它对葡萄糖氧化中的一些关键酶,如6-磷酸葡萄糖酶及6-磷酸葡萄糖脱氢酶也具有一定的调节作用〔22〕。
, http://www.100md.com
2 .3 对蛋白代谢的影响 脂肪强于葡萄糖的供能作用,使之在临床营养支持中的应用越来越广泛。由于对危重病人营养支持的主要目的是促进蛋白合成,特别是对于担负重要功能的脏器及免疫防御组织。因此,脂肪乳剂的节氮作用及对免疫系统的影响,是判断其优劣的重要指标 。 Alexander〔1〕及Teo〔23〕的研究显示,同样应用于烧伤后的豚鼠或大鼠,与亚油酸、红花油相比,鱼油在减轻体重丢失、促进白蛋白合成,维持氮平衡、降低代谢率及促进免疫反应方面都有突出的优点。n-3 PUFA影响蛋白质代谢的机制尚不清楚,可能与其减轻PGE2及炎性细胞因子对机体的作用有关。
3 n-3 PUFA在营养支持中的应用前景及尚待解决的问题
n-3 PUFA营养支持治疗作用的一个重要特点,就是它在细胞及机体功能水平诱导的改变较为持久。在停用10周后,其对炎性细胞因子及PGE2释放的抑制作用仍然存在〔10〕。所以对于重症感染、慢性炎症等一些炎性介质持续释放的疾病,n-3 PUFA将是极为有效的免疫调理营养素。此外,在感染状态下,机体常常存在代谢紊乱,营养配方或膳食中添加n-3 PUFA,可有利于减轻胰岛素抵抗、高脂血症及维持氮平衡。然而,n-3 PUFA在这类病人中的应用也存在一些问题,尚需进一步研究。如在何时及多久需要对炎性介质进行调控,而又不阻断其对机体的有益作用?何种免疫细胞是确实需要调控的靶细胞?如何确定补给的时限及确切的组成比例才能预防疾病的有害影响,而又不抑制机体正常的免疫反应?如何减轻n-3 PUFA的脂质过氧化反应,减少氧自由基的产生?等等。随着研究的进一步深入及制剂技术的改进,n-3 PUFA有望获得更为广阔的应用前景。
, http://www.100md.com
参考文献
1 ALexander JW,Saito H,Trocki O et al.The improtance of lipid type in the diet after burn injury.Ann Surg,1986,204:1
2 Barton RG,Wells CL,Carlson A et al .Dietary omega-3 fatty acids decreases mortality and kupffer cell prostaglandin E2 preduction in a rat model of chronic sepsis.J Trauma,1991,31:768
3 Ertel W,Morrison MH.Ayala A et al.Modulation of macrophage membrane phospholipids by n-3 polyunsaturated fatty acids increases interleukin-1 release and prevents suppression of cellular immunity following hemorrhagic shock .Arch Surg,1993,128:15
, 百拇医药
4 Daly JM,Lieberman MD,Goldfine J et al.Enteral nutrition with supplemental arginine,RNA,and omega-3 fatty acids in patients after operation:immunologic,metabolic,and clinical outcome.Surgery,1992,112:56
5 Cathcart ES,Leslie CA,Meydani SN et al. A fish oil diet retards experimental amyloidosis,modulates lymphocyte function,and decreases macrophage arachidonate metabolism in mice.J Immunol,1987,139:1850
6 Hardardottir I,Whelan J,Kinsella JE.Kinetics of tumor necrosis factor and prostaglandin production by murine resident peritoneal macrophages as affected by dietary n-3 polyunsaturated fatty acids.Immunology,1992,76:572
, http://www.100md.com
7 Brouard C,Pascaud M.Effects of moderate dietary supplementations with n-3 fatty acids on macrophage and lymphocyte phospholipids and macrophage eicosanoid synthesis in the rat. Biochim Biophys Acta,1990,1047:19
8 Meydani SN,Shapiro AC,Meydani M et al.Lung eicosanoid synthesis is affected by age ,dietary fat and vitamin E.J Nutr,1992,122:1627
9 Peck MD,Li Z,Pressman BC.Lymphocyte membrane anisotropy is affected by dietary lipids and is correlated with the lymphocyte blastogenic response to LPS.Surg Forum,1992,43:19
, http://www.100md.com
10 Endres S.Ghorbani R,Kelleg VE et al.The effect of dietary supplementation with n-3 polyunsaturated fatty acids on the synthesis of interleukin-1 and tumor necrosis factor by mononuclear cells.N Engl J Med,1989,320:265
11 Meydani SN.Modulation of cytokine production by dietary polyunsaturated fatty acids.Dietary Lipids Cytokines,1992,200:189
12 Hardardottir I,Kinsella JE.Increasing the dietary n-3 to n-6 polyunsatnrated fatty acids ratio increases tumor necrosis factor production by murine residentperitoneal maerophages.J Nutr,1992,122:1942
, 百拇医药
13 Geelen MJ,Schoots WJ,Bijleveld C et al.Dietary medium-chain fatty acid raise and (n-3) polyunsaturated fatty acdis lower hepatic triacyglycerol synthesis in rats.J Nutr,1995,125:2449
14 Harris WS,Lu G,Rambjor GS et al.Influence of n-3 fatty acid supplementation on the endogenous activities of plasma lipases.Am J Clin Nutr,1997,66:254
15 Topping DL,Illma RJ,Roach PD et al.Modulation of the hypolipidemic effect of fish oils by dietary fiber in rats:studies with rice and wheat bran.J Nutr,1990,120:325
, 百拇医药
16 Bolestrieri GP,Maffi V,Sleima I et al.Fish oil supplementation in patients with heterozygous familial hypercholesteroliemia.Recenti Prog Med,1996,87:107
17 Muratoff GJ,Carroll NV,Scott EM.Diabetes mellitus in Eskimos.J Am Med Assoc,1967,199:961
18 Clandinin MT,Cheema S,Field C et al.Ditary lipids influence insulin action.Ann N Y Acad Sci,1993,683:151
19 Robertson RP.Arachidonic acid metabolite regulation of insulin secretion.Diabetes Metab Rev,1986,2:261
, 百拇医药
20 Love J,Mulvey G,Doring K et al.Feeding an isocaloric omega-3 fatty acid diet reduces the brush border membrane vesicle uptake of glucose in streptozotocin-diabetic rats.Diabetes Res,1994,25:65
21 Sierra P,Ling PR,Istfan NW et al.Fish oil feeding improves muslce glucose uptake in tumor necrosis factor-treated rats.Metabolism,1995,44:1365
22 Chiang MT,Tsai ML.Effect of fish oil on plasma lipoproteins,liver glucose-6-phosphate dehydrogease and glucose-6-phosphatase in rats.Int J Vitam Nutr Res,1995,65:276
23 Teo TC,DeMichele SJ,Selleck KM et al.Administration of structured lipid composed of MCT and fish oil reduces net protein catabolism in enteral fed burned rats.Ann Surg,1989,210:100
(1998-09-25收稿), http://www.100md.com