血红素氧化酶-1mRNA及其蛋白表达在动脉粥样硬化发病中的变化
作者:喻 陆 何作云
单位:400037 重庆市,第三军医大学新桥医院心脏内科
关键词:血红素氧化酶-1;内源性一氧化碳;动脉粥样硬化
血红素氧化酶
【摘要】 目的 研究在动脉粥样硬化发病过程中内源性一氧化碳的合成酶血红素氧化酶-1mRNA和蛋白表达的变化规律。方法 通过原位杂交、免疫组化染色等指标观察动脉粥样硬化发病过程中内源性一氧化碳的合成酶血红素氧化酶-1基因及其蛋白的变化规律。结果 1 发现动脉粥样硬化的发展过程中主动脉及冠状动脉壁的血红素氧化酶-1mRNA表达有逐渐增高的趋势。并且血红素氧化酶-1mRNA主要分布于主动脉和冠状动脉内皮细胞。2 发现在动脉粥样硬化的发展过程中血红素氧化酶-1蛋白在主动脉和冠状动脉壁的表达也有逐渐增高的趋势。并且血红素氧化酶-1免疫组化主要在主动脉和冠状动脉的内皮细胞呈阳性。结论 内源性一氧化碳的合成酶血红素氧化酶-1mRNA及其蛋白表达在动脉粥样硬化发病过程中呈逐渐增高的趋势。
, http://www.100md.com
Expression of Heme Oxygenase-1mRNA and Protein During Atherosclerosis
Yu Lu,He Zuoyun.
Department of Cardiology,the Third Military Medical University of PLA.Congqing 400037
【Abstract】 Objective To research the changes in expression of heme oxygenase-1 (carbon monoxide synthase) mRNA and protein during atherosclerosis development.Methods In situ hybridixation,immunohistochemistry stain were performed.Results 1. the positive score of heme oxygenase-1 mRNA is distributed in endothelial cell of aorta and coronary artery,the expression of heme oxygenase-1 mRNA on aorta and coronary artery raises in atherosclerosis development.2. the positive score of heme oxygenase-1 portein is distributed in endothelial cell of aorta and coronary artery,the expression of heme oxygenase-1 portein on aorta and coronary artery raises in atherosclerosis development.Conclusions The expression of carbon monoxide synthase heme oxygenase-1 mRNA and protein raises in atherosclerosis development.
, 百拇医药
【Key words】 Heme oxygenase-1 Endogenous carbon monoxide Atherosclerosis
尽管150年来国内外学者对动脉粥样硬化的发病进行了大量颇有成效的研究,提出了多种假说,但动脉粥样硬化的发病机制仍欠清楚。内源性一氧化碳及其合成酶血红素氧化酶-1在机体内的作用近年来引起人们的重视。一氧化氮经广泛深入的研究已被证明其在动脉粥样硬化发病中起着重要的作用。内源性一氧化碳是小分子的生物活性气体,其与一氧化氮的分子结构类似。本文采用原位杂交、免疫组化染色等指标,从不同角度研究内源性一氧化碳的合成酶血红素氧化酶-1在动脉粥样硬化发病中的变化。为研究动脉粥样硬化的发病机制及防治探索一条可能的新途径。
材料与方法
1 动脉粥样硬化的动物模型制备及分组
实验动物: 新西兰大白兔雄性,50只,体重0.5~1.1kg,由本校动物所提供。将兔子随机分为5组(对照组及四个实验组),每组10只,分笼饲养,定量给食。对照组食用基础饲料(由本院动物室提供),而实验组添加胆固醇粉1g/天/只。于傍晚给药,于喂养的第2,4,8和12周分别将各实验组的兔颈动脉放血处死。
, http://www.100md.com
2 血红素氧化酶-1免疫组化染色[1]
血红素氧化酶-1单抗由新加坡国立大学龚屏博士惠赠。将主动脉环和心肌及其冠状动脉固定、脱水、石蜡包埋、切片、厚度为6μm。血红素氧化酶-1的抗体稀释度为1/250,其余步骤按常规方法进行。用PBS代替血红素氧化酶-1抗体作为阴性对照。阳性为棕黄色。
3 血红素氧化酶-1mRNA的原位杂交研究[1]
pRH01(血红素氧化酶-1)cDNA质粒由日本Toshisuke教授惠增。经过转化、扩增、抽提与纯化、酶切鉴定后,用宝灵曼的地高辛标记检测试剂盒进行标记。我们分别采用冰冻切片和石蜡切片两种标本进行原位杂交。冻冻切片标本进行原位杂交方法:从液氮中取出主动脉环标本后,用24孔培养板分装标记并作记号。固定,冰冻切片,厚度为30μm,后按常规步骤进行。按每切片10μl,各孔加入杂交液100μl,加盖,于45℃恒温水浴20小时。漂洗,封闭,显色,脱水透明,封片。镜下观察,照相。阴性对照:(1)杂交前用RNase 100μg/ml 37℃ 1小时预处理组织(消化mRNA)切片。(2) 未标记的pRH01cDNA探针进行杂交反应。
, 百拇医药
石蜡切片标本进行原位杂交方法: 将心肌及其冠状动脉石蜡标本切片,厚度为6μm。反复脱蜡至水,按常规步骤进行后,将标记的探针沸水中变性10分钟,-20℃冰浴3分钟,均匀地滴加在组织切片上,加盖硅化盖玻片,100℃变性10分钟,-20℃水浴5分钟,湿盒中37℃ 24~36小时。切片经过反复振洗,酒精脱水,封闭,显色,衬染,脱水透明,封片。阴性对照:(1)杂交前用RNase100μg/ml 37℃ 1小时预处理组织(消化mRNA)切片。(2) 未标记的pRH01 cDNA探针进行杂交反应。
结 果
1 在动脉粥样硬化发病过程中主动脉、冠状动脉血红素氧化酶-1免疫组化染色的变化
1.1 主动脉血红素氧化酶-1免疫组化染色的变化
对照组: 血红素氧化酶-1在主动脉内皮细胞呈扭曲线条状阳性,平滑肌细胞阴性。对照组: 血红素氧化酶-1在主动脉内皮细胞呈阳性。实验组第2周: 血红素氧化酶-1在主动脉内皮细胞呈较强阳性。实验组第4周: 血红素氧化酶-1主动脉内皮细胞呈强阳性。实验组第8周: 血红素氧化酶-1在主动脉内皮细胞呈强阳性反应带。实验组第12周: 血红素氧化酶-1在血管内膜、内膜下有强阳性反应带,管壁内平滑肌有灶片状强阳性(照片1,见封二)。阴性对照:主动脉内皮细胞呈阴性(照片2,见封二)。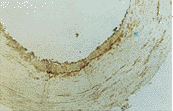
, http://www.100md.com
图1 主A免疫组化强阳性(×100)
图2 主A免疫组化阴性对照(×200)
1.2 冠状动脉及心肌血红素氧化酶-1免疫组化染色的变化
对照组: 血红素氧化酶-1在冠状动脉内皮细胞呈弱阳性反应。实验组第2周: 血红素氧化酶-1在冠状动脉内皮细胞呈局灶性弱阳性反应。心肌间质毛细血管内皮及心肌细胞索周膜阳性。实验组第4周: 血红素氧化酶-1在冠状动脉内皮细胞呈弱阳性反应。血红素氧化酶-1在冠状血管分支内皮细胞呈阳性或弱阳性反应。部分心肌细胞片状阳性。实验组第8周: 血红素氧化酶-1在冠状动脉内皮细胞呈阳性反应。血红素氧化酶-1在心内膜内皮细胞呈阳性。心肌内小血管及毛细血管内皮细胞、心肌细胞索周膜阳性。实验组第12周: 血红素氧化酶-1在冠状动脉内皮细胞呈强阳性。血红素氧化酶-1在冠状动脉内皮细胞呈强阳性(照片3,见封二)。血红素氧化酶-1在心肌内膜内皮细胞呈强阳性反应。阴性对照: 冠状动脉内皮细胞呈阴性。从以上结果可以看出: 1. 在主动脉血红素氧化酶-1蛋白主要分布于主动脉内皮细胞,并随着动脉粥样硬化的逐渐进展蛋白表达强度逐渐增高,到动脉粥样硬化的第12周血红素氧化酶-1在血管内膜、内膜下出现强阳性反应带,并且在血管壁内平滑肌层也出现血红素氧化酶-1呈灶片状强阳性。2. 在冠状动脉血红素氧化酶-1蛋白主要分布于冠状动脉内皮细胞,并随着动脉粥样硬化的逐渐进展蛋白表达强度逐渐增高。另外血红素氧化酶-1蛋白也在心内膜内皮细胞呈阳性反应、在部分心肌细胞呈片状阳性、在心肌间质毛细血管内皮细胞和心肌小血管、毛细血管内皮细胞呈阳性。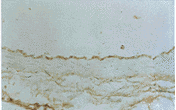
, http://www.100md.com
图3 冠脉HO-1免疫组化强阳性(×200)
2 原位杂交法检测动脉粥样硬化发病过程中主动脉及冠状动脉血红素氧化酶-1mRNA的表达
结果发现血红素氧化酶-1主要分布在主动脉内皮细胞和冠状动脉内皮细胞。在正常情况下主动脉和冠状动脉血红素氧化酶-1mRNA表达较少,随着动脉粥样硬化的发展,在实验组第2周,4周,8周,12周(照片4主动脉原位杂交,见封二。照片5冠状动脉原位杂交,见封二)血红素氧化酶-1mRNA在内皮细胞的表达逐渐增强。阴性对照: 主动脉内皮细胞呈阴性反应(照片6,见封二),冠状动脉内皮细胞呈阴性反应(照片7,见封二)。

, http://www.100md.com
图4 主AHO-1原位杂交内皮细胞极强阳性(×400)
图5 冠状AHO-1原位杂交阳性(×400)
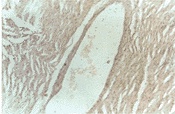
图6 HO-1原位杂交阴性对照(×200)
图7 冠状AHO-1原位杂交阴性寻照(×200)
讨 论
内源性一氧化碳在调节细胞功能和信息传递方面发挥着重要的作用,并且其发挥作用的方式类似于一氧化氮[2]。实验已经证明在脑中一氧化碳是一种新型的神经信使[3]。根据一氧化碳能使血管平滑肌松弛,并且能激活鸟苷酸环化酶,推测一氧化碳在血管紧张度调节中发挥着重要作用[4]。一氧化碳是在细胞内由血红素氧化酶催化血红素形成胆绿素和铁离子的过程中产生的,而且目前研究发现胆绿素及其产物胆红素具有抗氧化作用[5]。血红素氧化酶分为血红素氧化酶-1(诱生型)和血红素氧化酶-2(结构型 不被诱生),它们是内源性一氧化碳合成的限速酶。由于血红素氧化酶-2不被诱生,因此它主要在机体正常生理状态下时发挥作用。而血红素氧化酶-1的可被诱生的性质使其不但在机体正常生理状态下发挥作用,而更主要在机体的其他非正常状态下或应急状态下发挥作用[6]。不同的研究者已经用不同的方法证实血管壁上存在着血红素氧化酶[7]。但在大动脉上血红素氧化酶-1和血红素氧化酶-2的基因及蛋白分布状态国外不同实验室有不同的研究结果。1992年Balla应用Northern杂交观察到主动脉内皮细胞存在着血红素氧化酶基因表达[8]。1993年Verma等的报道在动脉血管壁平滑肌细胞中有较强的血红素氧化酶-2mRNA的表达[9]。同年Jornot报道应用Northern杂交观察到动脉内皮细胞存在血红素氧化酶-1mRNA的表达并且这种表达被二乙基顺丁烯二醇诱生[10]。1994年Ewing应用Northern blot观察到在降主动脉是有血红素氧化酶-1和血红素氧化酶-2mRNA的表达。同时他又应用免疫组化方法观察到血红素氧化酶-2的着色主要在血管内皮细胞和平滑肌层。而血红素氧化酶-1的着色主要在上述细胞的连接点上[11]。而Toshisuke等在1995年的研究时发现在血管平滑肌细胞只有极低水平的血红素氧化酶-2表达,主要是高水平的血红素氧化酶-1mRNA表达,并且这种表达被低氧所诱生[12]。Vulapalli在1996年研究发现肾缺血再灌注能上调该动物的血红素氧化酶-1mRNA的表达。并且应用免疫组化观察到血管的内皮细胞显示血红素氧化酶-1免疫组化染色明显阳性,在心室血红素氧化酶-1免疫反应蛋白也被观察到在不同区域内皮细胞层明显阳性[13]。同年Randa Zakhary发表文章却表达了不同的看法: 即内皮细胞只表达血红素氧化酶-2,而不表达血红素氧化酶-1[14]。Morita[15]研究发现内皮细胞和平滑肌细胞暴露于低氧环境下血红素氧化酶-1mRNA的转录反应不同,低氧增加血红素氧化酶-1mRNA在平滑肌细胞中的水平,而降低血红素氧化酶-1mRN在内皮细胞的水平,并认为血红素氧化酶-1mRNA在内皮细胞和平滑肌细胞的不同的表达可能是因为动脉壁在抵抗外界影响中起不同的作用及不同动物血管内皮细胞及平滑肌细胞表达量不同有关。我们通过免疫组化染色和原位杂交研究发现血红素氧化酶-1主要存在于血管的内皮细胞层,仅在动脉粥样硬化的晚期血红素氧化酶-1蛋白在血管平滑肌细胞出现明显阳性反应。并且发现随着主动脉壁和冠状动脉的内皮和内皮下动脉粥样硬化病变逐渐加重,血红素氧化酶-1的mRNA的表达和血红素氧化酶-1的蛋白表达呈动态进行性增强的发展趋势。1998年5月Wang应用原位杂交方法在人和动物中研究了血红素氧化酶-1在动脉粥样硬化损伤部位的分布状态,也发现血红素氧化酶-1mRNA主要分布于内皮细胞层和损伤部位增厚内膜的泡沫细胞/巨噬细胞[16]。这与我们的观察是一致的。在肾脏缺血再灌注过程中,心脏及降主动脉上的血红素氧化酶-1mRNA表达增高,一氧化碳产生增多。因此一氧化碳及血红素氧化酶在心脏及血管的病理生理过程中也发挥着积极的作用[13]。目前关于内源性一氧化碳在机体中的作用机制尚不清楚。有的研究者认为主要通过激活鸟苷酸环化酶来介导的。也有的研究者发现一氧化碳还可以通过一氧化氮来介导它在体内的生物学效应。还有的学者发现一氧化碳可通过抑制钙内流,改变细胞内钙浓度以产生其生物学效应。Adam则发现一氧化碳能导致角膜细胞内钾离子流动的增加。但在动脉粥样硬化发病过程中内源性一氧化碳如何发挥作用目前尚不得而知。对此我们正在做进一步的研究,并已取得一定的研究成果。
, 百拇医药
参考文献
1 蔡文琴,王泊云,主编.实用免疫细胞化学及核酸分子原位杂交技术.第1版.成都: 四川科技出版社.1994,150
2 Marks GS,Bren JF,Nakafsu BE,et al.Dose carbon monoxide have a physiological function?Trends Phmacol Sci.1991,12:185
3 Verma A,Hirsch DJ,Glau CE,et al.Carbon monoxide: a putative neural messenger.Science.1993,259:381
4 Cook MN,Nakatsu K,Marks GS,et al.Heme oxygenase activity in the adult rat aorta and liver as measured by carbon monoxide formation.Can J.Physiol.Pharmacol.1995,73:515
, http://www.100md.com
5 Grundemar L.Johansson Mb,Ekelund M,et al.Haem oxygenase activity in blood vessel homogenate as measured by carbon monoxide production.Acta Physiol.Scand.1995,152:203
6 Ewing JF,Raju VS,Maines MD.Induction of heart heme oxygenase-1 (HSP32) by hyperthermia possible role in stress-mediated elevation of cyclic 3,5-guanosine monophosphate.J.Pharmacol.Exp.Ther.1994,271:408
7 Zakhary R,Gaine SP,Dinerman JL,et al.Heme oxygenase-2:endothelial and neuronal localization and role in endothelium-dependent relaxation.Proc.Nata.Acad.Sci.USA.1996,93:795
, 百拇医药
8 Gyorgy Balla,Harry S.Jacob,Jozsef Balla,et al.Ferritin: a cytoprotective antioxdant strategem of endothelium.The Journal Biological Chemistry.1992,267:18148
9 Verma A,Hirsch DJ,Glau CE,et al.Carbon monoxide:a putative neural messenger.Science.1993,259:381
10 Jornot L,Junod AF.Variable glutathione levels and expression of antioxidant enzymes in human endothelial cells.Am J.Physiol.1993,264:L482
, http://www.100md.com 11 James F.Ewing,Vulapalli S.Raju,Mahin D.Mains.Inducetion of heart heme oxygenase-1 (HSP32) by hyperthermia:possible role in stress-mediated elevation of cyclic 3,5-guanosine monophosphate.J.Phar.& Exp.Therap.1994,271:408
12 Toshisuke M,Mark A,Perrella ME.Smooth muscle cell derived carbon monoxide is a regulator of vascular cGMP.Proc Natl.Acad.Sci USA.1995,92:1475
13 Vulapalli S.Raju,Main D.Mains.Renal ischemia/reperfusion up-regulates heme oxygenase-1 (HSP32) expression and increases cGMP in rat heart.J.Phar.& Exp.Therap.1996,277:1814
, 百拇医药
14 Randa Z,Sean R,Caine JD.Heme oxygenase-2:endothelial and neccronal localization and role in endothelium dependent relaxation.Proc.Natl.Sci.USA.1996,93:795
15 Morita T,S Kourembanas.Endothelial cell express of vasoconstrictirs and growth factors is regulated by smooth muscle cell-derived carbon monoxide.J.Clin.Invest.1995,96:2676
16 Wang LJ.Lee TS,Pai rc,et al.Expression of heme oxygenase-1 in atherosclerotic lesions.Am.J.Pathol.1998,152(3):711
收稿: 1998-09-18 修回: 1998-12-03, 百拇医药
单位:400037 重庆市,第三军医大学新桥医院心脏内科
关键词:血红素氧化酶-1;内源性一氧化碳;动脉粥样硬化
血红素氧化酶
【摘要】 目的 研究在动脉粥样硬化发病过程中内源性一氧化碳的合成酶血红素氧化酶-1mRNA和蛋白表达的变化规律。方法 通过原位杂交、免疫组化染色等指标观察动脉粥样硬化发病过程中内源性一氧化碳的合成酶血红素氧化酶-1基因及其蛋白的变化规律。结果 1 发现动脉粥样硬化的发展过程中主动脉及冠状动脉壁的血红素氧化酶-1mRNA表达有逐渐增高的趋势。并且血红素氧化酶-1mRNA主要分布于主动脉和冠状动脉内皮细胞。2 发现在动脉粥样硬化的发展过程中血红素氧化酶-1蛋白在主动脉和冠状动脉壁的表达也有逐渐增高的趋势。并且血红素氧化酶-1免疫组化主要在主动脉和冠状动脉的内皮细胞呈阳性。结论 内源性一氧化碳的合成酶血红素氧化酶-1mRNA及其蛋白表达在动脉粥样硬化发病过程中呈逐渐增高的趋势。
, http://www.100md.com
Expression of Heme Oxygenase-1mRNA and Protein During Atherosclerosis
Yu Lu,He Zuoyun.
Department of Cardiology,the Third Military Medical University of PLA.Congqing 400037
【Abstract】 Objective To research the changes in expression of heme oxygenase-1 (carbon monoxide synthase) mRNA and protein during atherosclerosis development.Methods In situ hybridixation,immunohistochemistry stain were performed.Results 1. the positive score of heme oxygenase-1 mRNA is distributed in endothelial cell of aorta and coronary artery,the expression of heme oxygenase-1 mRNA on aorta and coronary artery raises in atherosclerosis development.2. the positive score of heme oxygenase-1 portein is distributed in endothelial cell of aorta and coronary artery,the expression of heme oxygenase-1 portein on aorta and coronary artery raises in atherosclerosis development.Conclusions The expression of carbon monoxide synthase heme oxygenase-1 mRNA and protein raises in atherosclerosis development.
, 百拇医药
【Key words】 Heme oxygenase-1 Endogenous carbon monoxide Atherosclerosis
尽管150年来国内外学者对动脉粥样硬化的发病进行了大量颇有成效的研究,提出了多种假说,但动脉粥样硬化的发病机制仍欠清楚。内源性一氧化碳及其合成酶血红素氧化酶-1在机体内的作用近年来引起人们的重视。一氧化氮经广泛深入的研究已被证明其在动脉粥样硬化发病中起着重要的作用。内源性一氧化碳是小分子的生物活性气体,其与一氧化氮的分子结构类似。本文采用原位杂交、免疫组化染色等指标,从不同角度研究内源性一氧化碳的合成酶血红素氧化酶-1在动脉粥样硬化发病中的变化。为研究动脉粥样硬化的发病机制及防治探索一条可能的新途径。
材料与方法
1 动脉粥样硬化的动物模型制备及分组
实验动物: 新西兰大白兔雄性,50只,体重0.5~1.1kg,由本校动物所提供。将兔子随机分为5组(对照组及四个实验组),每组10只,分笼饲养,定量给食。对照组食用基础饲料(由本院动物室提供),而实验组添加胆固醇粉1g/天/只。于傍晚给药,于喂养的第2,4,8和12周分别将各实验组的兔颈动脉放血处死。
, http://www.100md.com
2 血红素氧化酶-1免疫组化染色[1]
血红素氧化酶-1单抗由新加坡国立大学龚屏博士惠赠。将主动脉环和心肌及其冠状动脉固定、脱水、石蜡包埋、切片、厚度为6μm。血红素氧化酶-1的抗体稀释度为1/250,其余步骤按常规方法进行。用PBS代替血红素氧化酶-1抗体作为阴性对照。阳性为棕黄色。
3 血红素氧化酶-1mRNA的原位杂交研究[1]
pRH01(血红素氧化酶-1)cDNA质粒由日本Toshisuke教授惠增。经过转化、扩增、抽提与纯化、酶切鉴定后,用宝灵曼的地高辛标记检测试剂盒进行标记。我们分别采用冰冻切片和石蜡切片两种标本进行原位杂交。冻冻切片标本进行原位杂交方法:从液氮中取出主动脉环标本后,用24孔培养板分装标记并作记号。固定,冰冻切片,厚度为30μm,后按常规步骤进行。按每切片10μl,各孔加入杂交液100μl,加盖,于45℃恒温水浴20小时。漂洗,封闭,显色,脱水透明,封片。镜下观察,照相。阴性对照:(1)杂交前用RNase 100μg/ml 37℃ 1小时预处理组织(消化mRNA)切片。(2) 未标记的pRH01cDNA探针进行杂交反应。
, 百拇医药
石蜡切片标本进行原位杂交方法: 将心肌及其冠状动脉石蜡标本切片,厚度为6μm。反复脱蜡至水,按常规步骤进行后,将标记的探针沸水中变性10分钟,-20℃冰浴3分钟,均匀地滴加在组织切片上,加盖硅化盖玻片,100℃变性10分钟,-20℃水浴5分钟,湿盒中37℃ 24~36小时。切片经过反复振洗,酒精脱水,封闭,显色,衬染,脱水透明,封片。阴性对照:(1)杂交前用RNase100μg/ml 37℃ 1小时预处理组织(消化mRNA)切片。(2) 未标记的pRH01 cDNA探针进行杂交反应。
结 果
1 在动脉粥样硬化发病过程中主动脉、冠状动脉血红素氧化酶-1免疫组化染色的变化
1.1 主动脉血红素氧化酶-1免疫组化染色的变化
对照组: 血红素氧化酶-1在主动脉内皮细胞呈扭曲线条状阳性,平滑肌细胞阴性。对照组: 血红素氧化酶-1在主动脉内皮细胞呈阳性。实验组第2周: 血红素氧化酶-1在主动脉内皮细胞呈较强阳性。实验组第4周: 血红素氧化酶-1主动脉内皮细胞呈强阳性。实验组第8周: 血红素氧化酶-1在主动脉内皮细胞呈强阳性反应带。实验组第12周: 血红素氧化酶-1在血管内膜、内膜下有强阳性反应带,管壁内平滑肌有灶片状强阳性(照片1,见封二)。阴性对照:主动脉内皮细胞呈阴性(照片2,见封二)。

, http://www.100md.com
图1 主A免疫组化强阳性(×100)

图2 主A免疫组化阴性对照(×200)
1.2 冠状动脉及心肌血红素氧化酶-1免疫组化染色的变化
对照组: 血红素氧化酶-1在冠状动脉内皮细胞呈弱阳性反应。实验组第2周: 血红素氧化酶-1在冠状动脉内皮细胞呈局灶性弱阳性反应。心肌间质毛细血管内皮及心肌细胞索周膜阳性。实验组第4周: 血红素氧化酶-1在冠状动脉内皮细胞呈弱阳性反应。血红素氧化酶-1在冠状血管分支内皮细胞呈阳性或弱阳性反应。部分心肌细胞片状阳性。实验组第8周: 血红素氧化酶-1在冠状动脉内皮细胞呈阳性反应。血红素氧化酶-1在心内膜内皮细胞呈阳性。心肌内小血管及毛细血管内皮细胞、心肌细胞索周膜阳性。实验组第12周: 血红素氧化酶-1在冠状动脉内皮细胞呈强阳性。血红素氧化酶-1在冠状动脉内皮细胞呈强阳性(照片3,见封二)。血红素氧化酶-1在心肌内膜内皮细胞呈强阳性反应。阴性对照: 冠状动脉内皮细胞呈阴性。从以上结果可以看出: 1. 在主动脉血红素氧化酶-1蛋白主要分布于主动脉内皮细胞,并随着动脉粥样硬化的逐渐进展蛋白表达强度逐渐增高,到动脉粥样硬化的第12周血红素氧化酶-1在血管内膜、内膜下出现强阳性反应带,并且在血管壁内平滑肌层也出现血红素氧化酶-1呈灶片状强阳性。2. 在冠状动脉血红素氧化酶-1蛋白主要分布于冠状动脉内皮细胞,并随着动脉粥样硬化的逐渐进展蛋白表达强度逐渐增高。另外血红素氧化酶-1蛋白也在心内膜内皮细胞呈阳性反应、在部分心肌细胞呈片状阳性、在心肌间质毛细血管内皮细胞和心肌小血管、毛细血管内皮细胞呈阳性。

, http://www.100md.com
图3 冠脉HO-1免疫组化强阳性(×200)
2 原位杂交法检测动脉粥样硬化发病过程中主动脉及冠状动脉血红素氧化酶-1mRNA的表达
结果发现血红素氧化酶-1主要分布在主动脉内皮细胞和冠状动脉内皮细胞。在正常情况下主动脉和冠状动脉血红素氧化酶-1mRNA表达较少,随着动脉粥样硬化的发展,在实验组第2周,4周,8周,12周(照片4主动脉原位杂交,见封二。照片5冠状动脉原位杂交,见封二)血红素氧化酶-1mRNA在内皮细胞的表达逐渐增强。阴性对照: 主动脉内皮细胞呈阴性反应(照片6,见封二),冠状动脉内皮细胞呈阴性反应(照片7,见封二)。


, http://www.100md.com
图4 主AHO-1原位杂交内皮细胞极强阳性(×400)
图5 冠状AHO-1原位杂交阳性(×400)


图6 HO-1原位杂交阴性对照(×200)
图7 冠状AHO-1原位杂交阴性寻照(×200)
讨 论
内源性一氧化碳在调节细胞功能和信息传递方面发挥着重要的作用,并且其发挥作用的方式类似于一氧化氮[2]。实验已经证明在脑中一氧化碳是一种新型的神经信使[3]。根据一氧化碳能使血管平滑肌松弛,并且能激活鸟苷酸环化酶,推测一氧化碳在血管紧张度调节中发挥着重要作用[4]。一氧化碳是在细胞内由血红素氧化酶催化血红素形成胆绿素和铁离子的过程中产生的,而且目前研究发现胆绿素及其产物胆红素具有抗氧化作用[5]。血红素氧化酶分为血红素氧化酶-1(诱生型)和血红素氧化酶-2(结构型 不被诱生),它们是内源性一氧化碳合成的限速酶。由于血红素氧化酶-2不被诱生,因此它主要在机体正常生理状态下时发挥作用。而血红素氧化酶-1的可被诱生的性质使其不但在机体正常生理状态下发挥作用,而更主要在机体的其他非正常状态下或应急状态下发挥作用[6]。不同的研究者已经用不同的方法证实血管壁上存在着血红素氧化酶[7]。但在大动脉上血红素氧化酶-1和血红素氧化酶-2的基因及蛋白分布状态国外不同实验室有不同的研究结果。1992年Balla应用Northern杂交观察到主动脉内皮细胞存在着血红素氧化酶基因表达[8]。1993年Verma等的报道在动脉血管壁平滑肌细胞中有较强的血红素氧化酶-2mRNA的表达[9]。同年Jornot报道应用Northern杂交观察到动脉内皮细胞存在血红素氧化酶-1mRNA的表达并且这种表达被二乙基顺丁烯二醇诱生[10]。1994年Ewing应用Northern blot观察到在降主动脉是有血红素氧化酶-1和血红素氧化酶-2mRNA的表达。同时他又应用免疫组化方法观察到血红素氧化酶-2的着色主要在血管内皮细胞和平滑肌层。而血红素氧化酶-1的着色主要在上述细胞的连接点上[11]。而Toshisuke等在1995年的研究时发现在血管平滑肌细胞只有极低水平的血红素氧化酶-2表达,主要是高水平的血红素氧化酶-1mRNA表达,并且这种表达被低氧所诱生[12]。Vulapalli在1996年研究发现肾缺血再灌注能上调该动物的血红素氧化酶-1mRNA的表达。并且应用免疫组化观察到血管的内皮细胞显示血红素氧化酶-1免疫组化染色明显阳性,在心室血红素氧化酶-1免疫反应蛋白也被观察到在不同区域内皮细胞层明显阳性[13]。同年Randa Zakhary发表文章却表达了不同的看法: 即内皮细胞只表达血红素氧化酶-2,而不表达血红素氧化酶-1[14]。Morita[15]研究发现内皮细胞和平滑肌细胞暴露于低氧环境下血红素氧化酶-1mRNA的转录反应不同,低氧增加血红素氧化酶-1mRNA在平滑肌细胞中的水平,而降低血红素氧化酶-1mRN在内皮细胞的水平,并认为血红素氧化酶-1mRNA在内皮细胞和平滑肌细胞的不同的表达可能是因为动脉壁在抵抗外界影响中起不同的作用及不同动物血管内皮细胞及平滑肌细胞表达量不同有关。我们通过免疫组化染色和原位杂交研究发现血红素氧化酶-1主要存在于血管的内皮细胞层,仅在动脉粥样硬化的晚期血红素氧化酶-1蛋白在血管平滑肌细胞出现明显阳性反应。并且发现随着主动脉壁和冠状动脉的内皮和内皮下动脉粥样硬化病变逐渐加重,血红素氧化酶-1的mRNA的表达和血红素氧化酶-1的蛋白表达呈动态进行性增强的发展趋势。1998年5月Wang应用原位杂交方法在人和动物中研究了血红素氧化酶-1在动脉粥样硬化损伤部位的分布状态,也发现血红素氧化酶-1mRNA主要分布于内皮细胞层和损伤部位增厚内膜的泡沫细胞/巨噬细胞[16]。这与我们的观察是一致的。在肾脏缺血再灌注过程中,心脏及降主动脉上的血红素氧化酶-1mRNA表达增高,一氧化碳产生增多。因此一氧化碳及血红素氧化酶在心脏及血管的病理生理过程中也发挥着积极的作用[13]。目前关于内源性一氧化碳在机体中的作用机制尚不清楚。有的研究者认为主要通过激活鸟苷酸环化酶来介导的。也有的研究者发现一氧化碳还可以通过一氧化氮来介导它在体内的生物学效应。还有的学者发现一氧化碳可通过抑制钙内流,改变细胞内钙浓度以产生其生物学效应。Adam则发现一氧化碳能导致角膜细胞内钾离子流动的增加。但在动脉粥样硬化发病过程中内源性一氧化碳如何发挥作用目前尚不得而知。对此我们正在做进一步的研究,并已取得一定的研究成果。
, 百拇医药
参考文献
1 蔡文琴,王泊云,主编.实用免疫细胞化学及核酸分子原位杂交技术.第1版.成都: 四川科技出版社.1994,150
2 Marks GS,Bren JF,Nakafsu BE,et al.Dose carbon monoxide have a physiological function?Trends Phmacol Sci.1991,12:185
3 Verma A,Hirsch DJ,Glau CE,et al.Carbon monoxide: a putative neural messenger.Science.1993,259:381
4 Cook MN,Nakatsu K,Marks GS,et al.Heme oxygenase activity in the adult rat aorta and liver as measured by carbon monoxide formation.Can J.Physiol.Pharmacol.1995,73:515
, http://www.100md.com
5 Grundemar L.Johansson Mb,Ekelund M,et al.Haem oxygenase activity in blood vessel homogenate as measured by carbon monoxide production.Acta Physiol.Scand.1995,152:203
6 Ewing JF,Raju VS,Maines MD.Induction of heart heme oxygenase-1 (HSP32) by hyperthermia possible role in stress-mediated elevation of cyclic 3,5-guanosine monophosphate.J.Pharmacol.Exp.Ther.1994,271:408
7 Zakhary R,Gaine SP,Dinerman JL,et al.Heme oxygenase-2:endothelial and neuronal localization and role in endothelium-dependent relaxation.Proc.Nata.Acad.Sci.USA.1996,93:795
, 百拇医药
8 Gyorgy Balla,Harry S.Jacob,Jozsef Balla,et al.Ferritin: a cytoprotective antioxdant strategem of endothelium.The Journal Biological Chemistry.1992,267:18148
9 Verma A,Hirsch DJ,Glau CE,et al.Carbon monoxide:a putative neural messenger.Science.1993,259:381
10 Jornot L,Junod AF.Variable glutathione levels and expression of antioxidant enzymes in human endothelial cells.Am J.Physiol.1993,264:L482
, http://www.100md.com 11 James F.Ewing,Vulapalli S.Raju,Mahin D.Mains.Inducetion of heart heme oxygenase-1 (HSP32) by hyperthermia:possible role in stress-mediated elevation of cyclic 3,5-guanosine monophosphate.J.Phar.& Exp.Therap.1994,271:408
12 Toshisuke M,Mark A,Perrella ME.Smooth muscle cell derived carbon monoxide is a regulator of vascular cGMP.Proc Natl.Acad.Sci USA.1995,92:1475
13 Vulapalli S.Raju,Main D.Mains.Renal ischemia/reperfusion up-regulates heme oxygenase-1 (HSP32) expression and increases cGMP in rat heart.J.Phar.& Exp.Therap.1996,277:1814
, 百拇医药
14 Randa Z,Sean R,Caine JD.Heme oxygenase-2:endothelial and neccronal localization and role in endothelium dependent relaxation.Proc.Natl.Sci.USA.1996,93:795
15 Morita T,S Kourembanas.Endothelial cell express of vasoconstrictirs and growth factors is regulated by smooth muscle cell-derived carbon monoxide.J.Clin.Invest.1995,96:2676
16 Wang LJ.Lee TS,Pai rc,et al.Expression of heme oxygenase-1 in atherosclerotic lesions.Am.J.Pathol.1998,152(3):711
收稿: 1998-09-18 修回: 1998-12-03, 百拇医药