内毒素对重组人成骨蛋白-1诱导人牙髓细胞活性的影响
作者:苏 勤 何国华 张 郁 李 强
单位:苏 勤 何国华 华西医科大学口腔医学院 610041;张 郁 李 强 第四军医大学口腔医学院
关键词:脂多糖;重组人成骨蛋白-1;牙髓细胞;碱性磷酸酶
华西口腔医学杂志990207 摘要 目的:研究具核梭杆菌的内毒素(LPS)对重组人成骨蛋白-1(rhOP-1)诱导牙髓细胞增殖、分化的影响。方法:采用噻唑盐比色测定(MTT)、酶动力学方法和放射免疫技术。结果:在较低浓度LPS作用时,可协同增加rhOP-1对牙髓细胞增殖和碱性磷酸酶(ALPase)活性,但对骨钙素(BGP)无明显影响,而高浓度LPS则起抑制作用。结论:提示适度的LPS在牙髓对龋病的防御反应过程中起着一定调节作用。
Effect of Lipopolysaccharide on Recombinant Human Osteogenic
, 百拇医药
Protein-1-induced Responses in Human Dental Pulp Cells
Su Qin, He Guohua
College of Stomatology, West China University of Medical Sciences
Zhang Yu, Li Qiang
College of Stomatology, the Fourth Military Medical University
Abstract Objective: To investigate the effects of lipopolysaccharide (LPS) on recombinant human osteogenic protein-1 (rhOP-1) induced proliferation and differentiation. Methods: Measured MTT, alkaline phosphatase (ALPase) activity and osteocalcin content of human dental pulp cells. Results: Low-dose LPS (1 μg/ml) caused co-operative effect with low concentration of rhOP-1 to enhance human dental pulp cell proliferation and ALPase activity, but not to osteocalcin, whereas, high-dose LPS (100 μg/ml) significantly inhibited the proliferation, ALPase activity and osteocalcin with or without rhOP-1. Conclusion: The role of LPS in caries-induced reparative dentin might be a significant determinant.
, 百拇医药
Key words: lipopolysaccharide recombinant human osteogenic protein-1 (rhOP-1) dental pulp cells alkaline phosphatase
牙髓-牙本质复合体在龋病、磨耗、备洞等外界刺激下将产生不同程度的自身防御反应,如修复性牙本质或牙髓炎症,在牙本质受到损害时,成牙本质细胞形成一层修复性牙本质,不仅增加了牙本质的厚度,而且使成牙本质细胞退到牙髓腔中远离损害区的部位。尽管牙髓组织终身可形成继发性牙本质,但修复性牙本质形成所特有的部位和快速性引起了人们的关注。这种反应机制尚未完全清楚,但可以肯定,开放的牙本质小管将刺激信号传递给牙髓组织,其中的一些免疫细胞如Ia抗原表达细胞和巨噬细胞聚集在牙本质小管下层,触发了牙髓最初的防御反应[1]。龋洞中细菌有多种致病因素可激发宿主的免疫反应,其中G-菌的一种共同毒力因子即内毒素脂多糖(LPS),可刺激体内多种细胞产生生长因子。生长因子是胞外基质变化、细胞增殖、分化的影响因素,而各生长因子之间量的变化可能是影响其生物效应的关键。骨形成蛋白(BMPs)作为细胞外基质,在骨和牙齿的形成中有重要作用[2,3]。但不同剂量的LPS是否直接影响各生长因子之间量的变化,直接或间接调节BMPs的生物活性,尚是一个值得研究的问题。本实验观察了具核梭杆菌(Fn.)的LPS对BMPs一员,重组人成骨蛋白-1(rhOP-1,又名BMP-7),诱导体外培养人牙髓细胞的影响,为龋病中牙髓牙本质复合体的自身修复防御机制提供了一定理论依据。
, 百拇医药
1 材料和方法
1.1 实验材料
第5代人牙髓成纤维细胞,Fn.LPS和rhOP-1(由第四军医大学口腔医学院牙髓生物实验室提供),RPMI1640培养液(Gibco,美国),胎牛血清(FBS)(浙江金华清湖犊牛利用研究所),噻唑蓝(MTT)(Sigma公司,美国),碱性磷酸酶(ALPase)试剂盒(BGH,生物化学公司,中国台湾),骨钙素(BGP)试剂盒(福瑞生物工程公司)。
1.2 实验分组
实验组分别为不同浓度的LPS(依次为0、100 ng/ml,1、10、100 μg/ml)和不同浓度的rhOP-1(依次为0、1、10、100 ng/ml,1、10 μg/ml)的不同组合。空白孔为RPMl1640液。每组复种4孔。
1.3 实验方法
, http://www.100md.com
1.3.1 MTT比色测定 取生长良好的第5代人牙髓成纤维细胞,调整牙髓细胞浓度为2×104/ml,接种于96孔板,每孔200 μl。标准环境下以10%FBS的RPMI 1640孵育24小时,弃去培养液和未贴壁的牙髓细胞,按实验分组加人用1%FBS的RPMI 1640配制的不同浓度rhOP-l和LPS的培养液。标准环境孵育5天,每孔加入20 μl MTT液,继续孵育4小时,弃去培养液,每孔加入150 μl的二甲亚枫(DMSO),振荡10分,用酶联检测仪(华东电子管厂)在490 nm波长下测光密度值(OD),取4孔均值。
1.3.2 ALPase活性测定 细胞接种方法同上。标准环境孵育5天,弃去培养液,加入100 μl缓冲裂解液Tritron X-100,超声振荡15分,每孔加入100 μl标准底物液,37℃孵育30分,以0.l mmol/L NaOH终止反应,用酶联检测仪在410 nm波长处测OD值,取4孔均值。
1.3.3 BGP测定 取上述孵育5天后的培养液各25 μl,加入125I-BGP100 μl和抗血清100 μl,每管液体分别混匀,室温27℃放置过夜,再分别加入分离剂1000 μl,混匀,室温放置15分,离心(3500 r/min)15分,弃去上清液,用骨钙素测试仪(Capria l6,美国)测定各管沉淀的放射计数(cmp),经计算机处理,换算成样品的相应浓度值(ng/m1),取4孔均值。
, 百拇医药
2 结 果
MTT比色OD值表明,LPS单独作用于牙髓细胞,100 ng/ml以下浓度对细胞生长无影响,高浓度100 μg/ml可明显抑制细胞生长(P<0.01),而较低浓度1 μg/ml和10 μg/ml则可较明显促进细胞增殖(P<0.05)(表1)。在无LPS时,牙髓细胞增殖与rhOP-l呈剂量依赖关系,促增殖浓度的LPS对低浓度rhOP-1的促增殖效应有较明显协同作用(P<0.01),而对高浓度rhOP-1(1 μg/ml以上)影响不大(P>0.05)(图1)。
表1 单独使用LPS对牙髓细胞增殖、ALPase、骨钙素的影响 LPS
浓度
0 ng
100 ng
1 μg
, 百拇医药
10 μg
100 μg
MTT
OD值
0.32±0.03
0.35±0.04
0.47±0.03
0.44±0.01
0.21±0.05
ALPase
OD值
0.23±0.02
, 百拇医药
0.21±0.04
0.24±0.02
0.21±0.06
0.13±0.03
BGP
(ng/ml)
20.51±0.13
20.14±0.15
21.03±0.09
19.78±0.13
8.36±0.11
, 百拇医药
图1 不同浓度脂多糖(LPS)和rhOP-1组合的MTT OD值
ALPase结果表明,单独用LPS刺激牙髓细胞,高浓度LPS(100 μg/ml)抑制细胞ALPase活性,其余各浓度对其活性均无显著影响(P>0.05)。当不同浓度的LPS和rhOP-1的不同组合作用后,高浓度LPS同样抑制ALPase活性,而1 μg/ml浓度的LPS则对低浓度rhOP-l有较明显协同增加ALPase活性的作用(P<0.01),对高浓度rhOP-1无明显影响(P>0.05),其余浓度组的LPS对不同浓度的rhOP-1无明显影响(P>0.05)(图2)。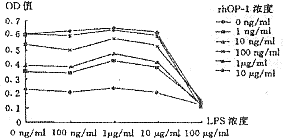
图2 LPS对rhOP-1诱导牙髓细胞ALPase活性的影响
骨钙素的检测结果显示,高浓度LPS(100 μg/ml)在有或无rhOP-l时均明显降低牙髓细胞BGP的分泌(P<0.01),而其余不同浓度的LPS对有无rhOP-1作用时,统计学上均无显著性差异(P>0.05)(图3)。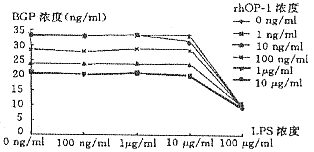
, http://www.100md.com
图3 LPS对rhOP-1诱导牙髓细胞分泌BGP的影响
3 讨 论
牙髓组织对抵御外界刺激的应答与修复反应是一个十分复杂的生物学过程。在慢性龋损进程中,牙髓组织的防御反应程度取决于龋损牙本质的穿透性。在龋损早期,细菌毒力因远离髓腔而弱,引起牙髓修复性牙本质形成;当龋损已接近髓腔,细胞及其代谢产物的强毒力作用而导致了牙髓不可逆的炎症反应。故细菌毒力作用于牙髓的强弱可导致不同的牙髓反应。
在龋洞中可发现大量的G-细菌,其LPS是这类细菌所共有的一种毒力因子,可以刺激宿主体内的巨噬细胞或其它细胞产生生长因子,而牙髓组织中的各种生长因子如IL-1β、TGF-β等在龋病引起的修复性牙本质形成过程中起重要作用[4]。rhOP-1作为生长因子TGF-β超家族一员,实验表明参与牙髓细胞的增殖和分化[5]。本实验结果表明,高浓度LPS(100 μg/ml)抑制牙髓细胞增殖,ALPase活性和BGP的分泌,不受rhOP-1浓度变化的影响,提示LPS的细胞毒性对细胞直接产生抑制效应,或通过对NF-kB多聚酶的影响调节RNA或DNA的合成。
, http://www.100md.com
在较低浓度时,有实验已证明LPS是一个较强的有丝分裂原[6]。它可以刺激多种细胞产生生长因子,调节不同生长因子之间量的变化,而这些生长因子又可能是启动下一个生物程序的信号[7,8]。本实验当LPS为1 μg/ml时,在促细胞增殖同时也与rhOP-l协同作用,增加ALPase的活性,提示在该浓度牙髓自身修复能力较强。但对BGP无明显影响,这可能与LPS-生长因子不直接调节BGP的生成有关。故LPS启动牙髓组织产生防御反应而形成修复性牙本质,可能与LPS通过牙本质小管刺激牙髓组织内的巨噬细胞等免疫细胞,释放出多种不同量的细胞因子以网络形式相互协同或制约而触发牙髓的递级效应有关。
由此可见,适量浓度LPS通过对受损牙本质相应部位的牙髓组织中生长因子的调节,促使局部牙髓细胞增殖,诱导细胞的分化,达到牙髓组织自身修复的目的。提示,龋病发生过程中,LPS等外界刺激与牙髓-牙本质复合体的修复机制有着密切关系。
参考文献
, 百拇医药
1 Kamal A, Okiji T, Kawashima N, et al. Defense responses of dentin/pulp complex to experimentally induced caries in rat molars: an immunohistochemical study on kinetics of pulpal Ia antigen-expressing cells and macrophages. J Endodon, 1997, 23(2):115~120
2 Mera K. Studies on bone morphogenetic protein (BMP) derived from bovine dimineralized dentin matrix. J Jpn Stomatol Soc, 1988, 37(4):389~399
3 Yang LJ, Gao YH, White FH. Bovine bone morphogenetic protein-induced dentinogenesis. Clin Orthop, 1993, 295:305~312
, http://www.100md.com
4 Nakashima M. The effects of growth factors on DNA synthesis, proteoglycan synthesis and alkaline phosphatase activity in bovine dental pulp cells. Arch Oral Biol, 1992, 37(3):231~238
5 Rutherford RB, Wahle J, Tucker M, et al. Induction of reparative dentine formation in monkeys by recombinant human osteogenic protein-1. Arch Oral Biol, 1993, 38(7):571~576
6 Nakane A, Yoshida T, Nakata K, et al. Effects of lipoplysaccharides on human dental pulp cells. J Endodon, 1995, 21(3):128~135
, http://www.100md.com
7 Hosoya S, Matsushima K. Stamulation of Interleukin-1 β production of human dental pulp cells by prophyromonas endodontalis lipopolysaccharide. J Endodon,1997,23(1):39~42
8 Hill SJ, Ebersole JL. The effect of lipopolysaccharide on growth factor-induced mitogenesis in human gingival fibroblasts. J Periodontal, 1996, 67(12):1274~1280
(1998-03-02收稿), http://www.100md.com
单位:苏 勤 何国华 华西医科大学口腔医学院 610041;张 郁 李 强 第四军医大学口腔医学院
关键词:脂多糖;重组人成骨蛋白-1;牙髓细胞;碱性磷酸酶
华西口腔医学杂志990207 摘要 目的:研究具核梭杆菌的内毒素(LPS)对重组人成骨蛋白-1(rhOP-1)诱导牙髓细胞增殖、分化的影响。方法:采用噻唑盐比色测定(MTT)、酶动力学方法和放射免疫技术。结果:在较低浓度LPS作用时,可协同增加rhOP-1对牙髓细胞增殖和碱性磷酸酶(ALPase)活性,但对骨钙素(BGP)无明显影响,而高浓度LPS则起抑制作用。结论:提示适度的LPS在牙髓对龋病的防御反应过程中起着一定调节作用。
Effect of Lipopolysaccharide on Recombinant Human Osteogenic
, 百拇医药
Protein-1-induced Responses in Human Dental Pulp Cells
Su Qin, He Guohua
College of Stomatology, West China University of Medical Sciences
Zhang Yu, Li Qiang
College of Stomatology, the Fourth Military Medical University
Abstract Objective: To investigate the effects of lipopolysaccharide (LPS) on recombinant human osteogenic protein-1 (rhOP-1) induced proliferation and differentiation. Methods: Measured MTT, alkaline phosphatase (ALPase) activity and osteocalcin content of human dental pulp cells. Results: Low-dose LPS (1 μg/ml) caused co-operative effect with low concentration of rhOP-1 to enhance human dental pulp cell proliferation and ALPase activity, but not to osteocalcin, whereas, high-dose LPS (100 μg/ml) significantly inhibited the proliferation, ALPase activity and osteocalcin with or without rhOP-1. Conclusion: The role of LPS in caries-induced reparative dentin might be a significant determinant.
, 百拇医药
Key words: lipopolysaccharide recombinant human osteogenic protein-1 (rhOP-1) dental pulp cells alkaline phosphatase
牙髓-牙本质复合体在龋病、磨耗、备洞等外界刺激下将产生不同程度的自身防御反应,如修复性牙本质或牙髓炎症,在牙本质受到损害时,成牙本质细胞形成一层修复性牙本质,不仅增加了牙本质的厚度,而且使成牙本质细胞退到牙髓腔中远离损害区的部位。尽管牙髓组织终身可形成继发性牙本质,但修复性牙本质形成所特有的部位和快速性引起了人们的关注。这种反应机制尚未完全清楚,但可以肯定,开放的牙本质小管将刺激信号传递给牙髓组织,其中的一些免疫细胞如Ia抗原表达细胞和巨噬细胞聚集在牙本质小管下层,触发了牙髓最初的防御反应[1]。龋洞中细菌有多种致病因素可激发宿主的免疫反应,其中G-菌的一种共同毒力因子即内毒素脂多糖(LPS),可刺激体内多种细胞产生生长因子。生长因子是胞外基质变化、细胞增殖、分化的影响因素,而各生长因子之间量的变化可能是影响其生物效应的关键。骨形成蛋白(BMPs)作为细胞外基质,在骨和牙齿的形成中有重要作用[2,3]。但不同剂量的LPS是否直接影响各生长因子之间量的变化,直接或间接调节BMPs的生物活性,尚是一个值得研究的问题。本实验观察了具核梭杆菌(Fn.)的LPS对BMPs一员,重组人成骨蛋白-1(rhOP-1,又名BMP-7),诱导体外培养人牙髓细胞的影响,为龋病中牙髓牙本质复合体的自身修复防御机制提供了一定理论依据。
, 百拇医药
1 材料和方法
1.1 实验材料
第5代人牙髓成纤维细胞,Fn.LPS和rhOP-1(由第四军医大学口腔医学院牙髓生物实验室提供),RPMI1640培养液(Gibco,美国),胎牛血清(FBS)(浙江金华清湖犊牛利用研究所),噻唑蓝(MTT)(Sigma公司,美国),碱性磷酸酶(ALPase)试剂盒(BGH,生物化学公司,中国台湾),骨钙素(BGP)试剂盒(福瑞生物工程公司)。
1.2 实验分组
实验组分别为不同浓度的LPS(依次为0、100 ng/ml,1、10、100 μg/ml)和不同浓度的rhOP-1(依次为0、1、10、100 ng/ml,1、10 μg/ml)的不同组合。空白孔为RPMl1640液。每组复种4孔。
1.3 实验方法
, http://www.100md.com
1.3.1 MTT比色测定 取生长良好的第5代人牙髓成纤维细胞,调整牙髓细胞浓度为2×104/ml,接种于96孔板,每孔200 μl。标准环境下以10%FBS的RPMI 1640孵育24小时,弃去培养液和未贴壁的牙髓细胞,按实验分组加人用1%FBS的RPMI 1640配制的不同浓度rhOP-l和LPS的培养液。标准环境孵育5天,每孔加入20 μl MTT液,继续孵育4小时,弃去培养液,每孔加入150 μl的二甲亚枫(DMSO),振荡10分,用酶联检测仪(华东电子管厂)在490 nm波长下测光密度值(OD),取4孔均值。
1.3.2 ALPase活性测定 细胞接种方法同上。标准环境孵育5天,弃去培养液,加入100 μl缓冲裂解液Tritron X-100,超声振荡15分,每孔加入100 μl标准底物液,37℃孵育30分,以0.l mmol/L NaOH终止反应,用酶联检测仪在410 nm波长处测OD值,取4孔均值。
1.3.3 BGP测定 取上述孵育5天后的培养液各25 μl,加入125I-BGP100 μl和抗血清100 μl,每管液体分别混匀,室温27℃放置过夜,再分别加入分离剂1000 μl,混匀,室温放置15分,离心(3500 r/min)15分,弃去上清液,用骨钙素测试仪(Capria l6,美国)测定各管沉淀的放射计数(cmp),经计算机处理,换算成样品的相应浓度值(ng/m1),取4孔均值。
, 百拇医药
2 结 果
MTT比色OD值表明,LPS单独作用于牙髓细胞,100 ng/ml以下浓度对细胞生长无影响,高浓度100 μg/ml可明显抑制细胞生长(P<0.01),而较低浓度1 μg/ml和10 μg/ml则可较明显促进细胞增殖(P<0.05)(表1)。在无LPS时,牙髓细胞增殖与rhOP-l呈剂量依赖关系,促增殖浓度的LPS对低浓度rhOP-1的促增殖效应有较明显协同作用(P<0.01),而对高浓度rhOP-1(1 μg/ml以上)影响不大(P>0.05)(图1)。
表1 单独使用LPS对牙髓细胞增殖、ALPase、骨钙素的影响 LPS
浓度
0 ng
100 ng
1 μg
, 百拇医药
10 μg
100 μg
MTT
OD值
0.32±0.03
0.35±0.04
0.47±0.03
0.44±0.01
0.21±0.05
ALPase
OD值
0.23±0.02
, 百拇医药
0.21±0.04
0.24±0.02
0.21±0.06
0.13±0.03
BGP
(ng/ml)
20.51±0.13
20.14±0.15
21.03±0.09
19.78±0.13
8.36±0.11

, 百拇医药
图1 不同浓度脂多糖(LPS)和rhOP-1组合的MTT OD值
ALPase结果表明,单独用LPS刺激牙髓细胞,高浓度LPS(100 μg/ml)抑制细胞ALPase活性,其余各浓度对其活性均无显著影响(P>0.05)。当不同浓度的LPS和rhOP-1的不同组合作用后,高浓度LPS同样抑制ALPase活性,而1 μg/ml浓度的LPS则对低浓度rhOP-l有较明显协同增加ALPase活性的作用(P<0.01),对高浓度rhOP-1无明显影响(P>0.05),其余浓度组的LPS对不同浓度的rhOP-1无明显影响(P>0.05)(图2)。

图2 LPS对rhOP-1诱导牙髓细胞ALPase活性的影响
骨钙素的检测结果显示,高浓度LPS(100 μg/ml)在有或无rhOP-l时均明显降低牙髓细胞BGP的分泌(P<0.01),而其余不同浓度的LPS对有无rhOP-1作用时,统计学上均无显著性差异(P>0.05)(图3)。

, http://www.100md.com
图3 LPS对rhOP-1诱导牙髓细胞分泌BGP的影响
3 讨 论
牙髓组织对抵御外界刺激的应答与修复反应是一个十分复杂的生物学过程。在慢性龋损进程中,牙髓组织的防御反应程度取决于龋损牙本质的穿透性。在龋损早期,细菌毒力因远离髓腔而弱,引起牙髓修复性牙本质形成;当龋损已接近髓腔,细胞及其代谢产物的强毒力作用而导致了牙髓不可逆的炎症反应。故细菌毒力作用于牙髓的强弱可导致不同的牙髓反应。
在龋洞中可发现大量的G-细菌,其LPS是这类细菌所共有的一种毒力因子,可以刺激宿主体内的巨噬细胞或其它细胞产生生长因子,而牙髓组织中的各种生长因子如IL-1β、TGF-β等在龋病引起的修复性牙本质形成过程中起重要作用[4]。rhOP-1作为生长因子TGF-β超家族一员,实验表明参与牙髓细胞的增殖和分化[5]。本实验结果表明,高浓度LPS(100 μg/ml)抑制牙髓细胞增殖,ALPase活性和BGP的分泌,不受rhOP-1浓度变化的影响,提示LPS的细胞毒性对细胞直接产生抑制效应,或通过对NF-kB多聚酶的影响调节RNA或DNA的合成。
, http://www.100md.com
在较低浓度时,有实验已证明LPS是一个较强的有丝分裂原[6]。它可以刺激多种细胞产生生长因子,调节不同生长因子之间量的变化,而这些生长因子又可能是启动下一个生物程序的信号[7,8]。本实验当LPS为1 μg/ml时,在促细胞增殖同时也与rhOP-l协同作用,增加ALPase的活性,提示在该浓度牙髓自身修复能力较强。但对BGP无明显影响,这可能与LPS-生长因子不直接调节BGP的生成有关。故LPS启动牙髓组织产生防御反应而形成修复性牙本质,可能与LPS通过牙本质小管刺激牙髓组织内的巨噬细胞等免疫细胞,释放出多种不同量的细胞因子以网络形式相互协同或制约而触发牙髓的递级效应有关。
由此可见,适量浓度LPS通过对受损牙本质相应部位的牙髓组织中生长因子的调节,促使局部牙髓细胞增殖,诱导细胞的分化,达到牙髓组织自身修复的目的。提示,龋病发生过程中,LPS等外界刺激与牙髓-牙本质复合体的修复机制有着密切关系。
参考文献
, 百拇医药
1 Kamal A, Okiji T, Kawashima N, et al. Defense responses of dentin/pulp complex to experimentally induced caries in rat molars: an immunohistochemical study on kinetics of pulpal Ia antigen-expressing cells and macrophages. J Endodon, 1997, 23(2):115~120
2 Mera K. Studies on bone morphogenetic protein (BMP) derived from bovine dimineralized dentin matrix. J Jpn Stomatol Soc, 1988, 37(4):389~399
3 Yang LJ, Gao YH, White FH. Bovine bone morphogenetic protein-induced dentinogenesis. Clin Orthop, 1993, 295:305~312
, http://www.100md.com
4 Nakashima M. The effects of growth factors on DNA synthesis, proteoglycan synthesis and alkaline phosphatase activity in bovine dental pulp cells. Arch Oral Biol, 1992, 37(3):231~238
5 Rutherford RB, Wahle J, Tucker M, et al. Induction of reparative dentine formation in monkeys by recombinant human osteogenic protein-1. Arch Oral Biol, 1993, 38(7):571~576
6 Nakane A, Yoshida T, Nakata K, et al. Effects of lipoplysaccharides on human dental pulp cells. J Endodon, 1995, 21(3):128~135
, http://www.100md.com
7 Hosoya S, Matsushima K. Stamulation of Interleukin-1 β production of human dental pulp cells by prophyromonas endodontalis lipopolysaccharide. J Endodon,1997,23(1):39~42
8 Hill SJ, Ebersole JL. The effect of lipopolysaccharide on growth factor-induced mitogenesis in human gingival fibroblasts. J Periodontal, 1996, 67(12):1274~1280
(1998-03-02收稿), http://www.100md.com