兔关节软骨细胞体外培养形成基质能力的观察
作者:陈富林 毛天球 冯 雪 杨维东 吴军正
单位:710032 第四军医大学口腔医学院
关键词:软骨细胞;基质合成;细胞培养
华西口腔医学杂志990205 摘要 目的:观察兔关节软骨细胞体外培养形成基质能力。方法:通过Ⅱ型胶原酶消化法获得大量高活性兔关节软骨细胞,倒置显微镜及透射电镜下观察细胞形态及超微结构,用含15%胎牛血清的DMEM培养液连续培养,观察软骨基质的形成情况。结果:体外培养的软骨细胞为多角形,透射电镜下见胞浆内有丰富的粗面内质网系统及线粒体,胞膜下及胞浆中有较多分泌泡;连续培养10天时,培养瓶底部出现肉眼可见的白色结节,蕃红-O染色显示白色结节含大量氨基葡聚糖阳性物质,20天时形成火山口样结构,也被蕃红-O染成深红色。结论:软骨细胞在体外也具有很强的基质形成能力并能形成软骨样组织,因而可以用于进行软骨体外再造。
, 百拇医药
Cartilage Matrix Synthetic Ability of Rabbit Articular
Chondrocytes Cultured in vitro
Chen Fulin, Mao Tianqiu, Feng Xue, et al
College of Stomatology, the Fourth Military Medical University
Abstract Objective: To observe the ability of matrix synthesis of rabbit articular chondrocytes cultured in vitro. Methods: Rabbit articular chondrocytes were acquired by digestion of 0.l% type Ⅱ collagenase and cultured in vitro, then cell morphology and ultrastructure were observed with phase-contrast microscope and scanning electronic microscope. With continuous culturing of chondrocytes in DMEM medium containing 15% FBS, synthesis of cartilage matrix was observed by using microscope and safranine-O staining. Results: The cultured chondrocytes were polygonal cells. There were many rough endoplasmic reticula and mitochondria in cytoplasm, and a lot of secretory vesicles under cell membrane and in the cytoplasm. When cultured for 10 days, some small and white nodules were formed on the bottom of the culture dished, and volcanic-mouth-like structures were formed when cultured for 20 days. Both these nodules and structures contained GAG-positive substances were demonstrated by safranine-O staining. Conclusion: Chondrocytes can produce matrix and cartilage-like tissue in vitro, so it is feasible to produce cartilage by culturing chondrocytes in vitro.
, 百拇医药
Key words: chondrocyte matrix synthesis cell culture
用细胞移植方法进行组织和器官再造,是近年来医学领域的一个重点研究内容,被称为是20世纪的十大科技研究之一[1]。软骨组成成分简单,由细胞和基质构成,不含血管等其他结构。在体外分离、培养软骨细胞,并将细胞种植到具有一定空间结构的三维支架上,通过细胞之间的相互粘附、生长繁殖、分泌细胞外基质,有可能形成具有一定结构和功能的软骨块。本研究观察了培养兔关节软骨细胞的一般形态和超微结构,并通过连续培养的方法观察其体外形成软骨基质的能力,为进一步进行组织再造打下基础。
1 材料和方法
1.1 材料
DMEM培养液(Gibco),胎牛血清(FBS,浙江金华清湖犊牛利用研究所),胰蛋白酶(上海浦东生化试剂厂),CO2细胞培养箱(Forma Scientific公司),倒置显微镜及照相系统(Olympus),Ⅱ型胶原酶(Sigma),电子显微镜(JEM-2000 EX透射电镜,JEC公司)。
, 百拇医药
1.2 方法
1.2.1 软骨细胞的分离、培养
1月龄新西兰幼兔1只,耳缘静脉注射空气处死,无菌条件下剪开四肢关节,用刀片切取关节表面软骨,放入盛有DMEM培养液的培养皿中,剪成小碎块,移入25 ml培养瓶中,用培养液洗软骨块两次,加入0.1%Ⅱ型胶原酶2 ml消化20分,轻轻吹打后弃去上清,并重复1次;然后加入0.1% Ⅱ型胶原酶5 ml,在孵箱内消化6~8小时,其间每隔1小时晃动培养瓶1次,观察大部分软骨块被消化后,轻轻吹打,收集消化液,1000 r/min离心3分使细胞沉淀,用培养液洗两次,以洗去细胞表面的消化酶;细胞记数后移入25 ml培养瓶中,每瓶接种细胞约2×104,加入含10%FBS的DMEM培养液3 ml,置于37℃、饱和湿度、5%CO2的细胞孵箱中培养,每3天换液1次,倒置显微镜下观察并照相,细胞长满后用0.25%胰酶传代。
, 百拇医药 1.2.2 培养软骨细胞的透射电镜观察
取生长良好的第三代细胞,0.25%胰酶消化后移入离心管,3000 r/min离心5分,取出细胞团块用3%戊二醛固定,锇酸后固定,丙酮系列脱水,环氧树脂包埋,切片后进行观察。
1.2.3 软骨细胞体外形成基质的观察
取两瓶第三代软骨细胞,用含15%FBS的培养液连续培养,观察培养瓶底部基质形成情况,分别于10、20天取出,95%酒精固定,蕃红-O染色,苏木精衬染,观察基质的形成情况。
2 结 果
2.1 培养软骨细胞的观察
消化6~8小时后,大部分软骨块消失,镜下观察消化液内出现大量小圆形细胞,表明消化成功。软骨细胞贴壁较慢,24~36小时才开始贴壁变形,其外形为多边形,长成一片时呈明显的铺路石状外观,与长梭形的成纤维细胞较易区分(图1)。由于先用胶原酶消化40分,去除了软骨表面的滑膜等结构,可以避免成纤维细胞等细胞成分的污染,因而获得的软骨细胞纯度较高。
, http://www.100md.com
图1 培养第二代的软骨细胞,外观呈铺路石状 ×200
2.2 透射电镜观察
电镜下可见软骨细胞呈合成与分泌功能旺盛的细胞类型,表现为细胞胞浆丰富,核周围有大量的线粒体,粗面内质网发达,胞膜下及胞浆中有较多分泌泡,泡内为合成的基质成分,胞浆中还可见大量成团的糖原颗粒(图2,3)。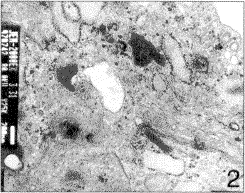
图2 透射电镜下,培养的软骨细胞内有发达的粗面内质网和线粒体 ×25000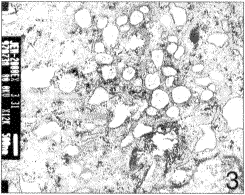
图3 透射电镜下,培养的软骨细胞内有大量分泌细胞 ×12000
2.3 基质形成情况的观察
, http://www.100md.com
传代后的细胞呈单层生长,5~6天时长满培养瓶底部,然后出现叠层生长。镜下见局部密度增高,细胞界限不清。连续培养过程中,软骨细胞聚集成团,培养10天时培养瓶底部可见小的白色结节形成,并不断增大。某些部位形成的基质收缩并大量堆积,形成火山口样结构,其中央又有细胞生长,如此可反复多次,20天时可形成明显的软骨样组织。用蕃红-O进行氨基葡聚糖(GAG)染色,白色结节含大量GAG阳性物质,被染成深红色,软骨细胞被包埋于其中(图4)。火山口样结构也主要由GAG阳性物质和软骨细胞构成(图5)。
图4 连续培养10天,形成类软骨样物质,GAG染色阳性 蕃红-O ×200
图5 连续培养20天,形成火山口样结构,被蕃红-O染成深红色 蕃红-0 ×50
, 百拇医药
3 讨 论
软骨是主要由氨基葡聚糖、Ⅱ型胶原,和位于陷窝中的软骨细胞构成的富于弹性的组织。软骨组织的自身修复能力很差,而且供区有限,因此各种原因所致的软骨的缺损和畸形,一直是一个临床治疗的难题。目前常用的软骨缺损和畸形修复的方法主要包括自体软骨移植和软骨代用品移植等,但应用时都存在不同程度的问题。
George等[2]曾将培养的幼兔软骨细胞悬液注人兔胫骨近心端软骨上直径3 mm,深3 mm的全层缺损中,术后4周,组织学检查见缺损底部有软骨细胞生长,但细胞间质的甲苯胺蓝染色非常淡;术后8周组织学检查仅见缺损底部被软骨细胞覆盖,整个缺损并未得到完全修复。分析其原因,可能是由于大部分软骨细胞未能在缺损中粘附、生长,因此他们提出如果能将软骨细胞接种到一个支架材料上,然后再植入软骨缺损中,修复效果可能会明显提高。Puelacher等[3]将培养的牛软骨细胞接种于聚乙醇酸支架上,然后将此支架-软骨细胞复合物植入裸鼠皮下,成功地形成了软骨组织,并认为这种软骨细胞移植方法为修复关节软骨缺损、耳及鼻翼软骨畸形提供了一种新方法。
, http://www.100md.com
软骨细胞可在体外培养及增殖,只需要少量的自体软骨细胞,就可获得足够的细胞数量用于移植,因此对自体组织的需要量很少;此外还可以通过冻存的方式,建立软骨细胞库,进行同种异体软骨细胞移植。
根据本实验的观察,培养的软骨细胞具有发达的线粒体和粗面内质网,代谢活力高,胞浆中有较多分泌泡,合成及分泌功能旺盛。细胞连续培养时,作者采用高浓度FBS(15%)进行培养,这是由于培养的细胞长成一片时,将会出现接触抑制,而高浓度的FBS可以维持细胞的高活性状态[4]。软骨细胞聚集成灶时,可以分泌形成大量GAG染色阳性物质,肉眼观察在瓶底可见明显的白色结节,细胞包埋于其中,形成软骨样组织,表明细胞在培养瓶中亦具有很强的软骨形成能力。软骨组成成分简单,由细胞和基质构成,不含血管等其他成分,因此,如果将软骨细胞接种在三维支架上进行立体培养,完全有可能在体外条件下形成一块软骨组织,用于移植以修复软骨缺损和畸形。
但如何在体外调控软骨细胞的生长、增殖并使其能正常分泌基质,如何建立大规模的软骨细胞培养系统,依然是研究的重点。此外,选用何种支架材料,也是一个需要解决的问题[5]。
, 百拇医药
参考文献
1 Langer R,Vacanti JP.Tissue Engineering. Science,1993,260(5110):920~926
2 George B, Robert B, Greer C,et al. Homotransplantion of isolated epiphyseal and articular chondrocytes into joint surfaces of rabbits. Nature,1971,230(4969):385~396
3 Puelacher WC,Kim SW,Vacanti JP,et al.Tissue-engineered growth of cartilage: the effect of varying the concentration of chondrocytes seeded onto synthetic polymer matrices. Int J Oral Maxillofac Surg,1994,23(1):49~53
4 司徒镇强,吴军正主编.细胞培养.西安:世界图书出版公司,1996:109~110
5 Noushin SD, Michael PZ, Richard GL, et al. Cartilage production by rabbit articular chondrocytes on polyglycolic acid scaffolds in a closed bioreactor system.Biotech and Bioeng, 1995,46(2):299~305
(1997-12-22收稿), http://www.100md.com
单位:710032 第四军医大学口腔医学院
关键词:软骨细胞;基质合成;细胞培养
华西口腔医学杂志990205 摘要 目的:观察兔关节软骨细胞体外培养形成基质能力。方法:通过Ⅱ型胶原酶消化法获得大量高活性兔关节软骨细胞,倒置显微镜及透射电镜下观察细胞形态及超微结构,用含15%胎牛血清的DMEM培养液连续培养,观察软骨基质的形成情况。结果:体外培养的软骨细胞为多角形,透射电镜下见胞浆内有丰富的粗面内质网系统及线粒体,胞膜下及胞浆中有较多分泌泡;连续培养10天时,培养瓶底部出现肉眼可见的白色结节,蕃红-O染色显示白色结节含大量氨基葡聚糖阳性物质,20天时形成火山口样结构,也被蕃红-O染成深红色。结论:软骨细胞在体外也具有很强的基质形成能力并能形成软骨样组织,因而可以用于进行软骨体外再造。
, 百拇医药
Cartilage Matrix Synthetic Ability of Rabbit Articular
Chondrocytes Cultured in vitro
Chen Fulin, Mao Tianqiu, Feng Xue, et al
College of Stomatology, the Fourth Military Medical University
Abstract Objective: To observe the ability of matrix synthesis of rabbit articular chondrocytes cultured in vitro. Methods: Rabbit articular chondrocytes were acquired by digestion of 0.l% type Ⅱ collagenase and cultured in vitro, then cell morphology and ultrastructure were observed with phase-contrast microscope and scanning electronic microscope. With continuous culturing of chondrocytes in DMEM medium containing 15% FBS, synthesis of cartilage matrix was observed by using microscope and safranine-O staining. Results: The cultured chondrocytes were polygonal cells. There were many rough endoplasmic reticula and mitochondria in cytoplasm, and a lot of secretory vesicles under cell membrane and in the cytoplasm. When cultured for 10 days, some small and white nodules were formed on the bottom of the culture dished, and volcanic-mouth-like structures were formed when cultured for 20 days. Both these nodules and structures contained GAG-positive substances were demonstrated by safranine-O staining. Conclusion: Chondrocytes can produce matrix and cartilage-like tissue in vitro, so it is feasible to produce cartilage by culturing chondrocytes in vitro.
, 百拇医药
Key words: chondrocyte matrix synthesis cell culture
用细胞移植方法进行组织和器官再造,是近年来医学领域的一个重点研究内容,被称为是20世纪的十大科技研究之一[1]。软骨组成成分简单,由细胞和基质构成,不含血管等其他结构。在体外分离、培养软骨细胞,并将细胞种植到具有一定空间结构的三维支架上,通过细胞之间的相互粘附、生长繁殖、分泌细胞外基质,有可能形成具有一定结构和功能的软骨块。本研究观察了培养兔关节软骨细胞的一般形态和超微结构,并通过连续培养的方法观察其体外形成软骨基质的能力,为进一步进行组织再造打下基础。
1 材料和方法
1.1 材料
DMEM培养液(Gibco),胎牛血清(FBS,浙江金华清湖犊牛利用研究所),胰蛋白酶(上海浦东生化试剂厂),CO2细胞培养箱(Forma Scientific公司),倒置显微镜及照相系统(Olympus),Ⅱ型胶原酶(Sigma),电子显微镜(JEM-2000 EX透射电镜,JEC公司)。
, 百拇医药
1.2 方法
1.2.1 软骨细胞的分离、培养
1月龄新西兰幼兔1只,耳缘静脉注射空气处死,无菌条件下剪开四肢关节,用刀片切取关节表面软骨,放入盛有DMEM培养液的培养皿中,剪成小碎块,移入25 ml培养瓶中,用培养液洗软骨块两次,加入0.1%Ⅱ型胶原酶2 ml消化20分,轻轻吹打后弃去上清,并重复1次;然后加入0.1% Ⅱ型胶原酶5 ml,在孵箱内消化6~8小时,其间每隔1小时晃动培养瓶1次,观察大部分软骨块被消化后,轻轻吹打,收集消化液,1000 r/min离心3分使细胞沉淀,用培养液洗两次,以洗去细胞表面的消化酶;细胞记数后移入25 ml培养瓶中,每瓶接种细胞约2×104,加入含10%FBS的DMEM培养液3 ml,置于37℃、饱和湿度、5%CO2的细胞孵箱中培养,每3天换液1次,倒置显微镜下观察并照相,细胞长满后用0.25%胰酶传代。
, 百拇医药 1.2.2 培养软骨细胞的透射电镜观察
取生长良好的第三代细胞,0.25%胰酶消化后移入离心管,3000 r/min离心5分,取出细胞团块用3%戊二醛固定,锇酸后固定,丙酮系列脱水,环氧树脂包埋,切片后进行观察。
1.2.3 软骨细胞体外形成基质的观察
取两瓶第三代软骨细胞,用含15%FBS的培养液连续培养,观察培养瓶底部基质形成情况,分别于10、20天取出,95%酒精固定,蕃红-O染色,苏木精衬染,观察基质的形成情况。
2 结 果
2.1 培养软骨细胞的观察
消化6~8小时后,大部分软骨块消失,镜下观察消化液内出现大量小圆形细胞,表明消化成功。软骨细胞贴壁较慢,24~36小时才开始贴壁变形,其外形为多边形,长成一片时呈明显的铺路石状外观,与长梭形的成纤维细胞较易区分(图1)。由于先用胶原酶消化40分,去除了软骨表面的滑膜等结构,可以避免成纤维细胞等细胞成分的污染,因而获得的软骨细胞纯度较高。

, http://www.100md.com
图1 培养第二代的软骨细胞,外观呈铺路石状 ×200
2.2 透射电镜观察
电镜下可见软骨细胞呈合成与分泌功能旺盛的细胞类型,表现为细胞胞浆丰富,核周围有大量的线粒体,粗面内质网发达,胞膜下及胞浆中有较多分泌泡,泡内为合成的基质成分,胞浆中还可见大量成团的糖原颗粒(图2,3)。

图2 透射电镜下,培养的软骨细胞内有发达的粗面内质网和线粒体 ×25000

图3 透射电镜下,培养的软骨细胞内有大量分泌细胞 ×12000
2.3 基质形成情况的观察
, http://www.100md.com
传代后的细胞呈单层生长,5~6天时长满培养瓶底部,然后出现叠层生长。镜下见局部密度增高,细胞界限不清。连续培养过程中,软骨细胞聚集成团,培养10天时培养瓶底部可见小的白色结节形成,并不断增大。某些部位形成的基质收缩并大量堆积,形成火山口样结构,其中央又有细胞生长,如此可反复多次,20天时可形成明显的软骨样组织。用蕃红-O进行氨基葡聚糖(GAG)染色,白色结节含大量GAG阳性物质,被染成深红色,软骨细胞被包埋于其中(图4)。火山口样结构也主要由GAG阳性物质和软骨细胞构成(图5)。

图4 连续培养10天,形成类软骨样物质,GAG染色阳性 蕃红-O ×200

图5 连续培养20天,形成火山口样结构,被蕃红-O染成深红色 蕃红-0 ×50
, 百拇医药
3 讨 论
软骨是主要由氨基葡聚糖、Ⅱ型胶原,和位于陷窝中的软骨细胞构成的富于弹性的组织。软骨组织的自身修复能力很差,而且供区有限,因此各种原因所致的软骨的缺损和畸形,一直是一个临床治疗的难题。目前常用的软骨缺损和畸形修复的方法主要包括自体软骨移植和软骨代用品移植等,但应用时都存在不同程度的问题。
George等[2]曾将培养的幼兔软骨细胞悬液注人兔胫骨近心端软骨上直径3 mm,深3 mm的全层缺损中,术后4周,组织学检查见缺损底部有软骨细胞生长,但细胞间质的甲苯胺蓝染色非常淡;术后8周组织学检查仅见缺损底部被软骨细胞覆盖,整个缺损并未得到完全修复。分析其原因,可能是由于大部分软骨细胞未能在缺损中粘附、生长,因此他们提出如果能将软骨细胞接种到一个支架材料上,然后再植入软骨缺损中,修复效果可能会明显提高。Puelacher等[3]将培养的牛软骨细胞接种于聚乙醇酸支架上,然后将此支架-软骨细胞复合物植入裸鼠皮下,成功地形成了软骨组织,并认为这种软骨细胞移植方法为修复关节软骨缺损、耳及鼻翼软骨畸形提供了一种新方法。
, http://www.100md.com
软骨细胞可在体外培养及增殖,只需要少量的自体软骨细胞,就可获得足够的细胞数量用于移植,因此对自体组织的需要量很少;此外还可以通过冻存的方式,建立软骨细胞库,进行同种异体软骨细胞移植。
根据本实验的观察,培养的软骨细胞具有发达的线粒体和粗面内质网,代谢活力高,胞浆中有较多分泌泡,合成及分泌功能旺盛。细胞连续培养时,作者采用高浓度FBS(15%)进行培养,这是由于培养的细胞长成一片时,将会出现接触抑制,而高浓度的FBS可以维持细胞的高活性状态[4]。软骨细胞聚集成灶时,可以分泌形成大量GAG染色阳性物质,肉眼观察在瓶底可见明显的白色结节,细胞包埋于其中,形成软骨样组织,表明细胞在培养瓶中亦具有很强的软骨形成能力。软骨组成成分简单,由细胞和基质构成,不含血管等其他成分,因此,如果将软骨细胞接种在三维支架上进行立体培养,完全有可能在体外条件下形成一块软骨组织,用于移植以修复软骨缺损和畸形。
但如何在体外调控软骨细胞的生长、增殖并使其能正常分泌基质,如何建立大规模的软骨细胞培养系统,依然是研究的重点。此外,选用何种支架材料,也是一个需要解决的问题[5]。
, 百拇医药
参考文献
1 Langer R,Vacanti JP.Tissue Engineering. Science,1993,260(5110):920~926
2 George B, Robert B, Greer C,et al. Homotransplantion of isolated epiphyseal and articular chondrocytes into joint surfaces of rabbits. Nature,1971,230(4969):385~396
3 Puelacher WC,Kim SW,Vacanti JP,et al.Tissue-engineered growth of cartilage: the effect of varying the concentration of chondrocytes seeded onto synthetic polymer matrices. Int J Oral Maxillofac Surg,1994,23(1):49~53
4 司徒镇强,吴军正主编.细胞培养.西安:世界图书出版公司,1996:109~110
5 Noushin SD, Michael PZ, Richard GL, et al. Cartilage production by rabbit articular chondrocytes on polyglycolic acid scaffolds in a closed bioreactor system.Biotech and Bioeng, 1995,46(2):299~305
(1997-12-22收稿), http://www.100md.com