人类免疫缺陷病毒感染的免疫发病机制
作者:马 娜
单位:马 娜 杨俊伟 南京军区南京总医院 解放军肾脏病研究所(南京,210002)
关键词:人类免疫缺陷病毒;发病机制;临床过程
肾脏病与透析肾移植杂志990216 马 娜 综述 杨俊伟 审校
“获得性免疫缺陷综合征(AIDS)”是人类免疫缺陷病毒(HIV)所致的一种严重的感染性疾病。过去的十余年间,人们对HIV的分子生物学复杂性、HIV感染后的临床过程及该疾病的发病机制等方面的研究都已取得了重大进展。众所周知,HIV在AIDS的发生及进展中起主要作用。表现在感染后的T细胞每天可复制产生1010病毒粒子[1,2]。原发性HIV感染中,病毒血症导致病毒播散至淋巴器官,使淋巴器官内的微环境遭到破坏,最终导致免疫系统再生能力严重受损。由于免疫系统不能彻底清除病毒,故引发慢性持续感染状态,导致显著的免疫抑制。本综述旨在讨论HIV发病机制中,淋巴器官、病毒共受体(corecepter)、病毒嗜性、病毒超抗原及病毒分子的作用。
, http://www.100md.com
1 HIV感染的临床概况
1.1 HIV感染的过程 大量感染HIV人群的诊断与治疗,已使人们对HIV感染的过程有了较为全面的认识(见附图)。通常可将HIV感染分为三个阶段,即:①原发感染;②临床潜伏期;③AIDS阶段。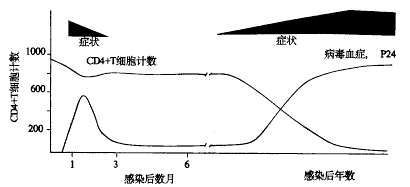

附图 典型的HIV感染和临床症状进展
1.1.1 原发感染 HIV初次感染3~6周内,大多数患者(50%~70%)表现出急性类单核细胞增多症。在此期间,可检测到高水平的病毒血症。随后,大约在感染后1周至3个月出现拮抗病毒的细胞及体液免疫反应。随着HIV特异性免疫反应的出现,病毒血症在急性综合征消散后的数周至数月内显著改善或消失。然而,这种免疫反应显然不能长期完全抑制病毒复制。所以,即便当血浆病毒血症及HIV mRNA难以检测到的时候,HIV依然在淋巴结内长期复制。
, 百拇医药
1.1.2 潜伏期 初次感染HIV后,大多数患者进入长达数年的临床潜伏期。在此期间,几乎所有患者都出现免疫系统的逐渐恶化,这主要反映在外周血CD4+细胞的耗竭,而患者通常很少出现临床症状。
1.1.3 AIDS阶段 此阶段的特征是,机体免疫系统的进行性恶化,最终进展到持续存在的全身综合征和(或)机会性感染状态。此时出现的免疫抑制也是初发感染时病毒播散及入侵淋巴器官之后一系列免疫反应的最终结果。
1.2 HIV感染个体的临床分类 由于个体差异及HIV病毒的变异,HIV感染后的临床表现也各异。根据临床进展不同,HIV感染个体可分为以下3类。
1.2.1 典型进展者 大多数HIV感染后个体(80%)经历疾病进展的典型过程。该过程包括一个最长可达8年的临床潜伏期。HIV感染的数周后,患者病毒血症减弱,同时伴随抗HIV的细胞及体液免疫反应。病毒清除与外周血出现抗HIV主要组织相容性复合物-1型限制型CD8+细胞毒性T细胞(CTLs)最密切相关[3]。CTLs是HIV感染潜伏期对抗HIV的免疫反应中的主要淋巴细胞,并在清除感染细胞及控制病毒数目中起主要作用。此外,HIV特异性抗体在病毒清除方面也起一定作用。但是,该抗体不能中和HIV,对于出现的HIV变异株更是无能为力。
, 百拇医药
目前已发现病毒特异性CTLs对于急性感染病毒的清除及持续性感染的控制都具有一定作用。感染早期,CTLs的出现与病毒血症的消散有相关性。HIV感染长期不进展的患者表现CTLs高活性。HIV-1特异性CTLs能够识别病毒结构基因产物(Env,Gag,Pol)及调节基因产物衍生的病毒抗原。由CTLs定义的表位以Env,Gag,及Nef蛋白为特征。除介导细胞毒性反应外,CD8+细胞还可通过释放可溶性因子抑制病毒复制而控制HIV感染。目前已发现由CD8+细胞产生的抑制因子包括MIP-1,RANTES和IL-6。这些因子的发现,在HIV的研究领域中关于病毒受体及共受体方面开辟了一片新天地。
随着病程进展至AIDS期,免疫系统被广泛激活,这主要反映在血浆noepterin、可溶性白介素受体、可溶性CD8、β2微球蛋白水平升高及细胞因子释放。就目前动态监测结果分析,IFNγ在病程早期出现峰值。有人认为,细胞因子模式从Th1型(IL-2、IFNγ)向Th2型(IL-4、IL-5、IL-10)转换。然而这一点目前尚有争议。随着病程进展,细胞免疫及体液免疫反应都随着疾病的进展而严重削弱,导致细胞因子生成减少。通常状况下,CD4+细胞计数>500个/μl的个体没有临床症状,而CD4+细胞计数<500个/μl的个体往往表现出全身症状。进展至CD4+细胞计数<200个/μl的AIDS期需要8~10年。AIDS的主要临床症状是持续而严重的全身症状及机会性感染或肿瘤发生率的增加。尽管上述模式是最常见的,近来仍有证据表明,部分感染个体临床过程进展异常缓慢或迅速。
, 百拇医药
1.2.2 不进展者 少数HIV感染个体(<10%)在很长的一段时间里可没有病情进展,称不进展者。此类感染者通常CD4+细胞计数持续稳定于正常范围,且病毒负荷较低(淋巴结内及外周血病毒负荷比急性进展者低4~20倍),淋巴组织也保存较完好。
不进展者保持为临床无症状状态,并具有高水平的CD8+ CTLs、高水平的外周血CD8+MHC Ⅰ型限制性抗体及高水平的HIV抗体,并且其体内非MHC限制性CD8+通常都具有很强的HIV抑制活性。有人报道,此类感染者可出现中和性HIV抗体或高度交叉反应性中和抗体(或二者)水平升高。病程不进展的原因尚未明确,可能是因为感染的是低致病性和(或)HIV缺陷株(nef变异株)[4],也可能是由于突变型CCR2和CCR5趋化因子受体为对抗HIV感染提供保护[5]。
1.2.3 迅速进展者 1%~15%的HIV感染个体在初发感染2~3年内外周血CD4+T细胞显著减少。这类患者主要特征包括:临床潜伏期很短或缺如、持续高病毒负荷、长时期的急性病毒综合征、持续存在的全身症状、抗HIV蛋白抗体低水平及中和抗体低水平或缺乏。与不进展者相比,此类个体记忆型CD8+ CTLs细胞呈低水平。此外,迅速进展者还存在高水平的非中和性抗体。体外实验发现,这种抗体能促进HIV的生长。
, http://www.100md.com
2 淋巴器官的作用
淋巴结内病变过程和病程进展关系可分为以下四个阶段:①病毒播散;②病毒从外周血内清除;③外周血内及淋巴结内病毒负荷与复制分离;④外周血及淋巴结内病毒负荷与复制再平衡。
2.1 病毒播散期 此期与初发HIV感染(病毒入侵3~6周)相对应。大多数个体(50%~70%)出现类似单核细胞增多症样临床综合征。血样筛选诊断HIV感染结果可能是阴性,但可通过检测P24抗原血症或血浆HIV RNA进行诊断。在猿免疫缺陷病毒(SIV)感染的动物模型中,淋巴器官与初发感染有关。感染后一周,即可在外周血淋巴结检测到病毒。感染后第二周,随着病毒特异性免疫反应的出现,具有产生病毒感染能力的HIV感染细胞减少。淋巴滤泡内大量生发中心形成,滤泡树突细胞突触的网状结构内可检测到病毒RNA及胞外病毒粒子与抗体、补体形成的复合物。随着HIV特异性细胞免疫反应及淋巴生发中心或网状内皮系统捕获免疫复合物以清除病毒,具有复制病毒功能的感染细胞进一步减少,导致抗原血症在感染后四周内消散。在这一阶段病毒复制水平显著下调。说明病毒复制的指标下调与不同的HIV蛋白特异性抗体的出现时间相关。近来有研究表明,在此期间,特异性细胞免疫反应,而非体液免疫反应,对于下调HIV病毒血症起到主要作用。另一方面,体液免疫反应,可通过促进滤泡树突细胞网状结构机械性捕获病毒颗粒而清除循环内游离病毒。
, http://www.100md.com
2.2 分离期 分离期对应的时间通常是8~10年的临床潜伏期,包括CD4+细胞计数>200个/μl HIV感染个体。在此期间,病毒学检查诸如P24抗原血症、血浆及外周血感染病毒滴度都是低的。这种低病毒负荷与此阶段的特征包括CD4+细胞数目及免疫功能的进行性下降不相符合。但近来发现,淋巴结内病毒负荷及复制超过外周血5~10倍。淋巴结生发中心25%的CD4+T细胞含有HIV DNA。淋巴结内及外周血内病毒负荷与复制的分离部分归因于暴露于病毒抗原后淋巴生发中心内滤泡增生。HIV感染细胞的隔离与病毒颗粒的捕获都与该分离有关。机械性、免疫性和微环境机制联合作用导致HIV被局限于淋巴结内。淋巴结内微环境有利于维持高水平的免疫激活。这样,免疫效应细胞之间的密切接触导致局部炎性细胞因子高水平,其中包括:IFNγ、TNFα、IL-6等。这些都能有效地诱使HIV在感染细胞内复制。除此之外,HIV感染细胞在淋巴结内分离也有助于这种分离现象的出现。至少已报道两种分割区内含有感染性及活动性复制的病毒。有些研究者发现。FDCs细胞与HIV具有细胞外的联系。这类细胞尽管本身并没有被病毒感染,却可以在穿过白细胞依赖区的淋巴滤泡时,把病毒传递给淋巴细胞。近来研究结果还发现,感染的淋巴样DCs和粘膜郎罕细胞(LCs)都能有效地感染T细胞。
, 百拇医药
2.3 平衡期 此期CD4+细胞<200个/μl。外周血病毒负荷迅速增加,导致外周血与淋巴结房室达到平衡状态。至少有两种机制导致外周血与淋巴结房室内病毒负荷的再平衡。其一是淋巴结内病毒捕获及HIV感染细胞隔离的丧失导致生发中心细胞外病毒颗粒减少,血浆病毒血症的增加。另一种机制则与广泛的淋巴组织变性致使丧失对病毒传播与复制的控制有关。在疾病的进展期,淋巴结构几乎完全被破坏,从而导致严重的免疫抑制与机会性感染的可能性增加。
3 HIV造成机体免疫缺陷的机制
3.1 病毒共受体及嗜性作用 HIV的任何一株都能感染CD4+T细胞,但从很多初次的患者体内分离出的HIV株能够在单核细胞/巨噬细胞系却不能在T细胞系复制(嗜M性),与此相反,适应T细胞的HIV株能感染CD4+细胞却不能在单核细胞/巨噬细胞内有效复制(嗜T性)。在原发感染初期,嗜M性(非合胞体形成)病毒占优势,随后由嗜T性(合胞体形成)病毒所替代。这种嗜性是由gp120病毒外壳抗原的第三条可变区所决定的。近来,有研究表明,几种趋化因子受体(7个穿膜区的G蛋白伴随受体)可作为HIV的共受体,并能够决定病毒嗜性特征。其中,CCR2和CCR5基因突变而分别形成的CCR2-64I、CCR5-Δ32在延缓病程和抗HIV感染中的作用尤为引人瞩目[6,7]。这些发现提示可能存在一种模型,即:不同类型的受体与配体指导嗜M及嗜T型HIV株的传递和致病。这些对于将来干预性治疗的意义尚有待于进一步探索。
, http://www.100md.com
3.2 CD4+细胞耗竭的机制 大量的病毒表达与复制,贯穿HIV疾病全过程,其细胞致病效应导致CD4+T细胞耗竭及免疫功能的进行性恶化。HIV诱发的细胞病理学可能由HIV基因产物与宿主细胞相互作用引起,并可被分为两类:HIV直接介导的细胞致病机制和间接作用机制(附表)。
附表 T细胞耗竭的可能机制 T细胞耗竭的机制分类
可能的机制
HIV介导的直接细胞致病作用
杀灭单个细胞
病毒出芽
细胞膜改变
病毒毒性产物
, http://www.100md.com
合胞体形成
gp120-CD4
LFA-ICAM1
病毒特异性免疫反应
CTLs介导的细胞溶解
抗体依赖性细胞毒性反应
自身免疫反应
MHC模拟/丧失自身耐受性
自身抗体
移植物抗宿主反应
自身反应性CTLs
超抗原/细胞凋亡
, 百拇医药
逆病毒抗原
共同感染(coinfecting)微生物抗原
Fas/FasL
Bcl-2/p53
细胞因子
3.2.1 HIV的直接作用机制 HIV可以通过积聚不完整的病毒DNA及抑制细胞蛋白合成而介导单个细胞的灭亡。HIV表达细胞与未感染的CD4+细胞的融合,而形成合胞体或巨细胞的过程也可以导致数百个细胞的消灭。gp120与CD4+分子之间的相互作用是该过程的关键步骤。粘连分子白细胞功能相关抗原1(LFA-1)的α,β链及细胞内粘附分子(ICAM)-1,2,3也都与合胞体的形成与调节有关。IL-4能够通过增强LFA-1-ICAM-1/ICAM-2的相互作用而显著增强HIV感染的单核细胞聚集和巨细胞的形成。其他还发现FPR-1,hsc70,肌动蛋白和vimentin也可以调节单核细胞聚集形成巨细胞的过程与HIV诱发的细胞融合。然而,合胞体很少在体内形成,但研究发现,初发病毒分离物的出现与合胞体诱生表型、CD4+T细胞的迅速减少及HIV疾病的进展具有相关性,这一点支持了合胞体假说。此外,HIV也可能间接地通过病毒特异性CTL反应导致免疫抑制[8]。
, 百拇医药
3.2.2 间接作用机制
(1) 超抗原和自身免疫 超抗原是能够与T细胞受体β链可变(V)区结合并诱使表达特异性V-β区域的T细胞广泛激活和扩增,从而导致表达特异性V-β区域的CD4+细胞耗竭或无反应性的微生物抗原。目前认为,HIV是一种超抗原。HIV病毒超抗原刺激可能诱使T细胞大量复制病毒,随之出现细胞的溶解。
HIV发病机制的自身免疫模型是在观察到HIV蛋白与MHC抗原的相似性的基础上建立起来的。HIV gp41与HLAⅡ型分子的β1区域有相同的高度保守序列,病毒的gp120模拟MHCⅠ型重链上的一种单形表位。HIV的Nef和MHCⅡ型的保守区也已引起注意。所以,gp120和gp41能够模拟MHC产物并与MHC Ⅰ和(或)Ⅱ型有交叉反应性。根据这一理论,强烈的病毒表位与自身抗原之间的分子相似性可能导致对自身MHC耐受的消失[9]。从临床角度,HIV发病机制中自身免疫反应存在提示对HIV抗原的耐受而非免疫更有可能成为一种治疗方法。然而,暴露于HIV以诱发HIV耐受与目前疫苗的研究方向完全相反。通过研究HIV感染的移植受体接受免疫抑制治疗以防止移植物排斥反应发现,免疫抑制可能有助于延缓HIV病程进展。
, 百拇医药
(2)细胞凋亡 生理性细胞死亡,或称细胞编程死亡,发生于胚胎发育时期及细胞更新时。细胞程序化死亡是以细胞凋亡为特征,即以核浓缩、核碎裂及核DNA断裂为特征的细胞死亡过程。当暴露于感染性因子后,T细胞凋亡过程是一种终止免疫反应的机制。
有研究表明,HIV感染的个体,淋巴细胞由于细胞凋亡而引起的细胞死亡的加速。通过表型分析也提示HIV感染中CD4+和CD8+细胞都存在凋亡现象[10]。
HIV感染中,T细胞凋亡加速的产生机制可能有以下几种:①病毒基因产物:HIV gp120与CD4之间的相互作用是诱导凋亡的强力促进因子,病毒Vpr基因产物可以诱导凋亡。②细胞因子:体内占有优势地位的淋巴因子反应主要包括,外周血TNFα、IFNγ、IL-6、IL-10水平升高。有证据表明,TNFα和IFNγ都能促进T细胞凋亡。③抗原呈递细胞(APC):单核细胞/巨嗜细胞和树突状细胞是HIV重要的储备场所,可以提供HIV-1外壳蛋白以把T细胞作为靶细胞。已有充分证据表明,在体外,APC可能通过很多途径介导细胞凋亡。④超抗原:据悉,动物肿瘤逆转录病毒能够编码超抗原。但是,HIV单独或是与其他微生物联合感染而编码超抗原的程度尚有待进一步阐明。研究发现部分进展型HIV患者缺乏特异性Vβ细胞受体,从而对上述观点起到间接的支持作用。
, http://www.100md.com
总之,HIV疾病的免疫发病机制是多因素、多阶段的,至今尚未完全明了。研究HIV疾病中的淋巴组织的变化为理解其发病机制提供相当大的帮助。即便是在潜伏期,淋巴器官内病毒复制也持续在高水平。原发感染后,病毒播散全身并种植于淋巴组织,从而形成病毒的储藏所。最后,淋巴组织的结构被破坏,伴随发生的是由于CD4+T细胞耗竭而带来的免疫功能紊乱。个体CD4+T细胞耗竭的机制尚不清楚,尽管HIV本身具有直接或间接的细胞致病性,其他机制,诸如细胞凋亡、自身免疫介导机制、CTL介导的T细胞灭亡及超抗原刺激都可能是T细胞耗竭的协同作用因素。加深对于HIV感染个体T细胞耗竭的免疫机制的理解,将为拟定有效的干预性治疗方案提供帮助。
作者简介:马 娜 南京大学医学院博士研究生
参考文献
1 Chun T-W,Carruth L,Ffinzi D et al.Quantification of latent tissue reserviors and total body viral load in HIV-1 infection.Nature,1997,387:183
, 百拇医药
2 Perelson AS,Essunger P,Cao Y et al.ecay characteristics of HIV-1-infected compartments furing combination therapy.Nature,1997,387:188
3 Koup RA,Safrit JT,Cao Y et al.emporal association of cellular immune responses with the initial control of viremia in primary human immunodeficiency virus type 1 syndrome.Virol,1994,68:4650
4 Kirchhoff F,Greenough TCmBreettler DB et al.Absence of intact nef sequences in a long-term survivor with nonprogressive HIV-1 infection.N Eng1 J Med,1995,332:228
, 百拇医药
5 Simth MW,Dean M,Caringtom M et al.Contrasting genetic influence of CCR2 and CCR5 variants on HIV-1 infection and disease progression.Science,1997,277:959
6 Chose H,Farzan M,Siln Y et al.The beta-chemokine receptors CCR3 and CCR5 facilitate infection by primary HIV-1 isolates.Cell,1996,85:1135
7 Samson M,Libert F,Doranz BJ et al.Resistance to HIV-1 infecyion in caucasian individuals bearing mutant alleles of the CCR-5 chemokine receptor gene.Nature,1996,382:722
, 百拇医药
8 Zindernagel RM,Hengarther H.T-cell-mediated immunopathology versus direct cytolysis by virus:Implications for HIV and AIDS.Immunol Today,1994,15:262
9 Siliciano RF,Lawton T,Knall C et al.Analysis of host-virus interactions in AIDS witha anti gp120 T-cell clones:Effect of HIV sequence variation and a mechanism for CD4+ cell depletion.Cell,1988,54:651
10 Mwyes I,Orro SA,Jonkwe RR et al.Programmed death of T cells in HIB-1 infection.Science,1992,257:217
(1999-02-05收稿,1999-03-20修回), 百拇医药
单位:马 娜 杨俊伟 南京军区南京总医院 解放军肾脏病研究所(南京,210002)
关键词:人类免疫缺陷病毒;发病机制;临床过程
肾脏病与透析肾移植杂志990216 马 娜 综述 杨俊伟 审校
“获得性免疫缺陷综合征(AIDS)”是人类免疫缺陷病毒(HIV)所致的一种严重的感染性疾病。过去的十余年间,人们对HIV的分子生物学复杂性、HIV感染后的临床过程及该疾病的发病机制等方面的研究都已取得了重大进展。众所周知,HIV在AIDS的发生及进展中起主要作用。表现在感染后的T细胞每天可复制产生1010病毒粒子[1,2]。原发性HIV感染中,病毒血症导致病毒播散至淋巴器官,使淋巴器官内的微环境遭到破坏,最终导致免疫系统再生能力严重受损。由于免疫系统不能彻底清除病毒,故引发慢性持续感染状态,导致显著的免疫抑制。本综述旨在讨论HIV发病机制中,淋巴器官、病毒共受体(corecepter)、病毒嗜性、病毒超抗原及病毒分子的作用。
, http://www.100md.com
1 HIV感染的临床概况
1.1 HIV感染的过程 大量感染HIV人群的诊断与治疗,已使人们对HIV感染的过程有了较为全面的认识(见附图)。通常可将HIV感染分为三个阶段,即:①原发感染;②临床潜伏期;③AIDS阶段。


附图 典型的HIV感染和临床症状进展
1.1.1 原发感染 HIV初次感染3~6周内,大多数患者(50%~70%)表现出急性类单核细胞增多症。在此期间,可检测到高水平的病毒血症。随后,大约在感染后1周至3个月出现拮抗病毒的细胞及体液免疫反应。随着HIV特异性免疫反应的出现,病毒血症在急性综合征消散后的数周至数月内显著改善或消失。然而,这种免疫反应显然不能长期完全抑制病毒复制。所以,即便当血浆病毒血症及HIV mRNA难以检测到的时候,HIV依然在淋巴结内长期复制。
, 百拇医药
1.1.2 潜伏期 初次感染HIV后,大多数患者进入长达数年的临床潜伏期。在此期间,几乎所有患者都出现免疫系统的逐渐恶化,这主要反映在外周血CD4+细胞的耗竭,而患者通常很少出现临床症状。
1.1.3 AIDS阶段 此阶段的特征是,机体免疫系统的进行性恶化,最终进展到持续存在的全身综合征和(或)机会性感染状态。此时出现的免疫抑制也是初发感染时病毒播散及入侵淋巴器官之后一系列免疫反应的最终结果。
1.2 HIV感染个体的临床分类 由于个体差异及HIV病毒的变异,HIV感染后的临床表现也各异。根据临床进展不同,HIV感染个体可分为以下3类。
1.2.1 典型进展者 大多数HIV感染后个体(80%)经历疾病进展的典型过程。该过程包括一个最长可达8年的临床潜伏期。HIV感染的数周后,患者病毒血症减弱,同时伴随抗HIV的细胞及体液免疫反应。病毒清除与外周血出现抗HIV主要组织相容性复合物-1型限制型CD8+细胞毒性T细胞(CTLs)最密切相关[3]。CTLs是HIV感染潜伏期对抗HIV的免疫反应中的主要淋巴细胞,并在清除感染细胞及控制病毒数目中起主要作用。此外,HIV特异性抗体在病毒清除方面也起一定作用。但是,该抗体不能中和HIV,对于出现的HIV变异株更是无能为力。
, 百拇医药
目前已发现病毒特异性CTLs对于急性感染病毒的清除及持续性感染的控制都具有一定作用。感染早期,CTLs的出现与病毒血症的消散有相关性。HIV感染长期不进展的患者表现CTLs高活性。HIV-1特异性CTLs能够识别病毒结构基因产物(Env,Gag,Pol)及调节基因产物衍生的病毒抗原。由CTLs定义的表位以Env,Gag,及Nef蛋白为特征。除介导细胞毒性反应外,CD8+细胞还可通过释放可溶性因子抑制病毒复制而控制HIV感染。目前已发现由CD8+细胞产生的抑制因子包括MIP-1,RANTES和IL-6。这些因子的发现,在HIV的研究领域中关于病毒受体及共受体方面开辟了一片新天地。
随着病程进展至AIDS期,免疫系统被广泛激活,这主要反映在血浆noepterin、可溶性白介素受体、可溶性CD8、β2微球蛋白水平升高及细胞因子释放。就目前动态监测结果分析,IFNγ在病程早期出现峰值。有人认为,细胞因子模式从Th1型(IL-2、IFNγ)向Th2型(IL-4、IL-5、IL-10)转换。然而这一点目前尚有争议。随着病程进展,细胞免疫及体液免疫反应都随着疾病的进展而严重削弱,导致细胞因子生成减少。通常状况下,CD4+细胞计数>500个/μl的个体没有临床症状,而CD4+细胞计数<500个/μl的个体往往表现出全身症状。进展至CD4+细胞计数<200个/μl的AIDS期需要8~10年。AIDS的主要临床症状是持续而严重的全身症状及机会性感染或肿瘤发生率的增加。尽管上述模式是最常见的,近来仍有证据表明,部分感染个体临床过程进展异常缓慢或迅速。
, 百拇医药
1.2.2 不进展者 少数HIV感染个体(<10%)在很长的一段时间里可没有病情进展,称不进展者。此类感染者通常CD4+细胞计数持续稳定于正常范围,且病毒负荷较低(淋巴结内及外周血病毒负荷比急性进展者低4~20倍),淋巴组织也保存较完好。
不进展者保持为临床无症状状态,并具有高水平的CD8+ CTLs、高水平的外周血CD8+MHC Ⅰ型限制性抗体及高水平的HIV抗体,并且其体内非MHC限制性CD8+通常都具有很强的HIV抑制活性。有人报道,此类感染者可出现中和性HIV抗体或高度交叉反应性中和抗体(或二者)水平升高。病程不进展的原因尚未明确,可能是因为感染的是低致病性和(或)HIV缺陷株(nef变异株)[4],也可能是由于突变型CCR2和CCR5趋化因子受体为对抗HIV感染提供保护[5]。
1.2.3 迅速进展者 1%~15%的HIV感染个体在初发感染2~3年内外周血CD4+T细胞显著减少。这类患者主要特征包括:临床潜伏期很短或缺如、持续高病毒负荷、长时期的急性病毒综合征、持续存在的全身症状、抗HIV蛋白抗体低水平及中和抗体低水平或缺乏。与不进展者相比,此类个体记忆型CD8+ CTLs细胞呈低水平。此外,迅速进展者还存在高水平的非中和性抗体。体外实验发现,这种抗体能促进HIV的生长。
, http://www.100md.com
2 淋巴器官的作用
淋巴结内病变过程和病程进展关系可分为以下四个阶段:①病毒播散;②病毒从外周血内清除;③外周血内及淋巴结内病毒负荷与复制分离;④外周血及淋巴结内病毒负荷与复制再平衡。
2.1 病毒播散期 此期与初发HIV感染(病毒入侵3~6周)相对应。大多数个体(50%~70%)出现类似单核细胞增多症样临床综合征。血样筛选诊断HIV感染结果可能是阴性,但可通过检测P24抗原血症或血浆HIV RNA进行诊断。在猿免疫缺陷病毒(SIV)感染的动物模型中,淋巴器官与初发感染有关。感染后一周,即可在外周血淋巴结检测到病毒。感染后第二周,随着病毒特异性免疫反应的出现,具有产生病毒感染能力的HIV感染细胞减少。淋巴滤泡内大量生发中心形成,滤泡树突细胞突触的网状结构内可检测到病毒RNA及胞外病毒粒子与抗体、补体形成的复合物。随着HIV特异性细胞免疫反应及淋巴生发中心或网状内皮系统捕获免疫复合物以清除病毒,具有复制病毒功能的感染细胞进一步减少,导致抗原血症在感染后四周内消散。在这一阶段病毒复制水平显著下调。说明病毒复制的指标下调与不同的HIV蛋白特异性抗体的出现时间相关。近来有研究表明,在此期间,特异性细胞免疫反应,而非体液免疫反应,对于下调HIV病毒血症起到主要作用。另一方面,体液免疫反应,可通过促进滤泡树突细胞网状结构机械性捕获病毒颗粒而清除循环内游离病毒。
, http://www.100md.com
2.2 分离期 分离期对应的时间通常是8~10年的临床潜伏期,包括CD4+细胞计数>200个/μl HIV感染个体。在此期间,病毒学检查诸如P24抗原血症、血浆及外周血感染病毒滴度都是低的。这种低病毒负荷与此阶段的特征包括CD4+细胞数目及免疫功能的进行性下降不相符合。但近来发现,淋巴结内病毒负荷及复制超过外周血5~10倍。淋巴结生发中心25%的CD4+T细胞含有HIV DNA。淋巴结内及外周血内病毒负荷与复制的分离部分归因于暴露于病毒抗原后淋巴生发中心内滤泡增生。HIV感染细胞的隔离与病毒颗粒的捕获都与该分离有关。机械性、免疫性和微环境机制联合作用导致HIV被局限于淋巴结内。淋巴结内微环境有利于维持高水平的免疫激活。这样,免疫效应细胞之间的密切接触导致局部炎性细胞因子高水平,其中包括:IFNγ、TNFα、IL-6等。这些都能有效地诱使HIV在感染细胞内复制。除此之外,HIV感染细胞在淋巴结内分离也有助于这种分离现象的出现。至少已报道两种分割区内含有感染性及活动性复制的病毒。有些研究者发现。FDCs细胞与HIV具有细胞外的联系。这类细胞尽管本身并没有被病毒感染,却可以在穿过白细胞依赖区的淋巴滤泡时,把病毒传递给淋巴细胞。近来研究结果还发现,感染的淋巴样DCs和粘膜郎罕细胞(LCs)都能有效地感染T细胞。
, 百拇医药
2.3 平衡期 此期CD4+细胞<200个/μl。外周血病毒负荷迅速增加,导致外周血与淋巴结房室达到平衡状态。至少有两种机制导致外周血与淋巴结房室内病毒负荷的再平衡。其一是淋巴结内病毒捕获及HIV感染细胞隔离的丧失导致生发中心细胞外病毒颗粒减少,血浆病毒血症的增加。另一种机制则与广泛的淋巴组织变性致使丧失对病毒传播与复制的控制有关。在疾病的进展期,淋巴结构几乎完全被破坏,从而导致严重的免疫抑制与机会性感染的可能性增加。
3 HIV造成机体免疫缺陷的机制
3.1 病毒共受体及嗜性作用 HIV的任何一株都能感染CD4+T细胞,但从很多初次的患者体内分离出的HIV株能够在单核细胞/巨噬细胞系却不能在T细胞系复制(嗜M性),与此相反,适应T细胞的HIV株能感染CD4+细胞却不能在单核细胞/巨噬细胞内有效复制(嗜T性)。在原发感染初期,嗜M性(非合胞体形成)病毒占优势,随后由嗜T性(合胞体形成)病毒所替代。这种嗜性是由gp120病毒外壳抗原的第三条可变区所决定的。近来,有研究表明,几种趋化因子受体(7个穿膜区的G蛋白伴随受体)可作为HIV的共受体,并能够决定病毒嗜性特征。其中,CCR2和CCR5基因突变而分别形成的CCR2-64I、CCR5-Δ32在延缓病程和抗HIV感染中的作用尤为引人瞩目[6,7]。这些发现提示可能存在一种模型,即:不同类型的受体与配体指导嗜M及嗜T型HIV株的传递和致病。这些对于将来干预性治疗的意义尚有待于进一步探索。
, http://www.100md.com
3.2 CD4+细胞耗竭的机制 大量的病毒表达与复制,贯穿HIV疾病全过程,其细胞致病效应导致CD4+T细胞耗竭及免疫功能的进行性恶化。HIV诱发的细胞病理学可能由HIV基因产物与宿主细胞相互作用引起,并可被分为两类:HIV直接介导的细胞致病机制和间接作用机制(附表)。
附表 T细胞耗竭的可能机制 T细胞耗竭的机制分类
可能的机制
HIV介导的直接细胞致病作用
杀灭单个细胞
病毒出芽
细胞膜改变
病毒毒性产物
, http://www.100md.com
合胞体形成
gp120-CD4
LFA-ICAM1
病毒特异性免疫反应
CTLs介导的细胞溶解
抗体依赖性细胞毒性反应
自身免疫反应
MHC模拟/丧失自身耐受性
自身抗体
移植物抗宿主反应
自身反应性CTLs
超抗原/细胞凋亡
, 百拇医药
逆病毒抗原
共同感染(coinfecting)微生物抗原
Fas/FasL
Bcl-2/p53
细胞因子
3.2.1 HIV的直接作用机制 HIV可以通过积聚不完整的病毒DNA及抑制细胞蛋白合成而介导单个细胞的灭亡。HIV表达细胞与未感染的CD4+细胞的融合,而形成合胞体或巨细胞的过程也可以导致数百个细胞的消灭。gp120与CD4+分子之间的相互作用是该过程的关键步骤。粘连分子白细胞功能相关抗原1(LFA-1)的α,β链及细胞内粘附分子(ICAM)-1,2,3也都与合胞体的形成与调节有关。IL-4能够通过增强LFA-1-ICAM-1/ICAM-2的相互作用而显著增强HIV感染的单核细胞聚集和巨细胞的形成。其他还发现FPR-1,hsc70,肌动蛋白和vimentin也可以调节单核细胞聚集形成巨细胞的过程与HIV诱发的细胞融合。然而,合胞体很少在体内形成,但研究发现,初发病毒分离物的出现与合胞体诱生表型、CD4+T细胞的迅速减少及HIV疾病的进展具有相关性,这一点支持了合胞体假说。此外,HIV也可能间接地通过病毒特异性CTL反应导致免疫抑制[8]。
, 百拇医药
3.2.2 间接作用机制
(1) 超抗原和自身免疫 超抗原是能够与T细胞受体β链可变(V)区结合并诱使表达特异性V-β区域的T细胞广泛激活和扩增,从而导致表达特异性V-β区域的CD4+细胞耗竭或无反应性的微生物抗原。目前认为,HIV是一种超抗原。HIV病毒超抗原刺激可能诱使T细胞大量复制病毒,随之出现细胞的溶解。
HIV发病机制的自身免疫模型是在观察到HIV蛋白与MHC抗原的相似性的基础上建立起来的。HIV gp41与HLAⅡ型分子的β1区域有相同的高度保守序列,病毒的gp120模拟MHCⅠ型重链上的一种单形表位。HIV的Nef和MHCⅡ型的保守区也已引起注意。所以,gp120和gp41能够模拟MHC产物并与MHC Ⅰ和(或)Ⅱ型有交叉反应性。根据这一理论,强烈的病毒表位与自身抗原之间的分子相似性可能导致对自身MHC耐受的消失[9]。从临床角度,HIV发病机制中自身免疫反应存在提示对HIV抗原的耐受而非免疫更有可能成为一种治疗方法。然而,暴露于HIV以诱发HIV耐受与目前疫苗的研究方向完全相反。通过研究HIV感染的移植受体接受免疫抑制治疗以防止移植物排斥反应发现,免疫抑制可能有助于延缓HIV病程进展。
, 百拇医药
(2)细胞凋亡 生理性细胞死亡,或称细胞编程死亡,发生于胚胎发育时期及细胞更新时。细胞程序化死亡是以细胞凋亡为特征,即以核浓缩、核碎裂及核DNA断裂为特征的细胞死亡过程。当暴露于感染性因子后,T细胞凋亡过程是一种终止免疫反应的机制。
有研究表明,HIV感染的个体,淋巴细胞由于细胞凋亡而引起的细胞死亡的加速。通过表型分析也提示HIV感染中CD4+和CD8+细胞都存在凋亡现象[10]。
HIV感染中,T细胞凋亡加速的产生机制可能有以下几种:①病毒基因产物:HIV gp120与CD4之间的相互作用是诱导凋亡的强力促进因子,病毒Vpr基因产物可以诱导凋亡。②细胞因子:体内占有优势地位的淋巴因子反应主要包括,外周血TNFα、IFNγ、IL-6、IL-10水平升高。有证据表明,TNFα和IFNγ都能促进T细胞凋亡。③抗原呈递细胞(APC):单核细胞/巨嗜细胞和树突状细胞是HIV重要的储备场所,可以提供HIV-1外壳蛋白以把T细胞作为靶细胞。已有充分证据表明,在体外,APC可能通过很多途径介导细胞凋亡。④超抗原:据悉,动物肿瘤逆转录病毒能够编码超抗原。但是,HIV单独或是与其他微生物联合感染而编码超抗原的程度尚有待进一步阐明。研究发现部分进展型HIV患者缺乏特异性Vβ细胞受体,从而对上述观点起到间接的支持作用。
, http://www.100md.com
总之,HIV疾病的免疫发病机制是多因素、多阶段的,至今尚未完全明了。研究HIV疾病中的淋巴组织的变化为理解其发病机制提供相当大的帮助。即便是在潜伏期,淋巴器官内病毒复制也持续在高水平。原发感染后,病毒播散全身并种植于淋巴组织,从而形成病毒的储藏所。最后,淋巴组织的结构被破坏,伴随发生的是由于CD4+T细胞耗竭而带来的免疫功能紊乱。个体CD4+T细胞耗竭的机制尚不清楚,尽管HIV本身具有直接或间接的细胞致病性,其他机制,诸如细胞凋亡、自身免疫介导机制、CTL介导的T细胞灭亡及超抗原刺激都可能是T细胞耗竭的协同作用因素。加深对于HIV感染个体T细胞耗竭的免疫机制的理解,将为拟定有效的干预性治疗方案提供帮助。
作者简介:马 娜 南京大学医学院博士研究生
参考文献
1 Chun T-W,Carruth L,Ffinzi D et al.Quantification of latent tissue reserviors and total body viral load in HIV-1 infection.Nature,1997,387:183
, 百拇医药
2 Perelson AS,Essunger P,Cao Y et al.ecay characteristics of HIV-1-infected compartments furing combination therapy.Nature,1997,387:188
3 Koup RA,Safrit JT,Cao Y et al.emporal association of cellular immune responses with the initial control of viremia in primary human immunodeficiency virus type 1 syndrome.Virol,1994,68:4650
4 Kirchhoff F,Greenough TCmBreettler DB et al.Absence of intact nef sequences in a long-term survivor with nonprogressive HIV-1 infection.N Eng1 J Med,1995,332:228
, 百拇医药
5 Simth MW,Dean M,Caringtom M et al.Contrasting genetic influence of CCR2 and CCR5 variants on HIV-1 infection and disease progression.Science,1997,277:959
6 Chose H,Farzan M,Siln Y et al.The beta-chemokine receptors CCR3 and CCR5 facilitate infection by primary HIV-1 isolates.Cell,1996,85:1135
7 Samson M,Libert F,Doranz BJ et al.Resistance to HIV-1 infecyion in caucasian individuals bearing mutant alleles of the CCR-5 chemokine receptor gene.Nature,1996,382:722
, 百拇医药
8 Zindernagel RM,Hengarther H.T-cell-mediated immunopathology versus direct cytolysis by virus:Implications for HIV and AIDS.Immunol Today,1994,15:262
9 Siliciano RF,Lawton T,Knall C et al.Analysis of host-virus interactions in AIDS witha anti gp120 T-cell clones:Effect of HIV sequence variation and a mechanism for CD4+ cell depletion.Cell,1988,54:651
10 Mwyes I,Orro SA,Jonkwe RR et al.Programmed death of T cells in HIB-1 infection.Science,1992,257:217
(1999-02-05收稿,1999-03-20修回), 百拇医药