人酰基辅酶A:胆固醇酰基转移酶N端片段在大肠杆菌中的表达
作者:叶治家 程天民 江智红 李伯良
单位:叶治家 程天民 江智红 李伯良 第三军医大学预防医学系防原医学教研室,全军复合伤研究所 重庆,400038
关键词:酰基辅酶A:胆固醇乙酰基转移酶;氨基端片段;基因表达
提要 目的
提要 目的:重组表达人ACAT的N端片段。方法:将编码ACAT氨基末端包含第一个跨膜区(1~196 aa)的cDNA片段克隆至不同的大肠杆菌表达载体中,构建了多种大肠杆菌表达质粒,再转化至大肠杆菌中进行表达研究。结果和结论:在详细摸索表达条件的基础上,经温敏诱导,成功地在大肠杆菌AR68中表达了N端融合proteinA BC domain的人ACAT氨基末端包含第一个跨膜区的片段,表达量约20 mg/L菌液。为进一步表达完整的ACAT蛋白、研究ACAT基因表达调控及其结构与功能的关系奠定了基础。
, http://www.100md.com
中图法分类号 R345
Expression of human ACAT N-terminal fragment in E. coli
Ye Zhijia, Cheng Tianmin, Jiang Zhihong, Li Boliang
(Department of Radiation Medicine, Third Military Medical University, Chongqing,400038)
Abstract Objective: To express acyl-coenzyme A: cholesterolacyl-transferase (ACAT) N-terminal containing the membrane anchoring region 1 (ACATn). Methods: The gene encoding the ACATn was cloned into the expression vector and transferred into E. coli.Results and Conclusion: The expressed product of ACATn fused with protein ABC domain and was detected in E.coli AR68.
, http://www.100md.com
Key words acyl-coA; cholesterolacyltransferase; N-terminal fragment; gene expression
酰基辅酶A:胆固醇酰基转移酶(Acyl-coenzyme A: cholesterolacyltransferase, ACAT; EC2.3.1.26)催化胆固醇与长链脂肪酸形成胆固醇酯。ACAT在体内胆固醇的吸收、运输、贮存等过程中发挥极其重要的作用,是调节体内胆固醇代谢平衡的关键酶之一[1]。遗传及细胞生物学实验表明,动脉粥样硬化发生与体内ACAT活性过高密切相关。ACAT在细胞内主要分布在粗面内质网膜上,且含量极低,遇去垢剂易失活,分离纯化极其困难[2],使得对ACAT的研究多年来停留在细胞水平。1993年美国Dartmouth医学院Chang实验室利用ACAT缺陷的CHO突变细胞株AC29克隆了人ACAT的cDNA[3],从而把ACAT的研究带入分子水平。从ACAT cDNA编码的氨基酸序列分析得知,人ACAT含550氨基酸残基,其中60%以上为疏水氨基酸,包含两个跨膜区,疏水性极强,这类蛋白质极不稳定,重组表达也十分困难。我们在进行大量表达及纯化条件摸索的基础上,在大肠杆菌中成功表达了与葡萄球菌蛋白A的BC domain(Protein A BC, PABC)融合、包含第一跨膜区的ACAT氨基端片段(PABC-ACATn)。
, http://www.100md.com
1 材料与方法
1.1 质粒、菌种
质粒pACAT15L、pMFLV3、pBLPAV7、pBLSPV3;大肠杆菌BL21(DE3)、MC1061、AR68、RR1等均由中图科学院生物化学研究所220组保存。
1.2 酶、化学试剂
DNA限制性内切酶、Klenow酶、T4DNA连接酶购自Biolabs,丙烯酰胺、甲叉丙烯酰胺、十二烷基硫酸钠(SDS)为Fluka产品,PMSF购自Boehringer Mannhein,其它试剂均为进口或国产分析纯。
1.3 细菌培养、质粒抽提、酶切反应、DNA电泳鉴定及回收、连接反应、质粒转化
均按文献[4]进行。
, http://www.100md.com
1.4 蛋白质分析SDS-聚丙烯酰胺凝胶电泳
按Laemmli[5]方法进行。
1.5 外源基因的表达
重组表达质粒转化大肠杆菌,随机接种3个单克隆菌落于LB/AP(AR68菌用2LB/AP)培养液,32℃培养过夜,取过夜菌按2%(AR68菌按20%)接种量接种于新鲜LB/AP(AR68菌用2LB/AP)培养液,32℃培养2~3h,再在42℃继续培养32 h进行温敏诱导表达。
1.6 表达产物的鉴定分析
全菌蛋白样品的制备:取表达菌液测D600值,离心收集菌体,按每0.1 Dλ菌加10 μl水及等体积的2×Laemmli上样缓冲液悬浮菌体,煮沸5 min,取20 μl进行SDS-PAGE电泳分析,鉴定有无表达。分泌至培养基中蛋白样品的制备:诱导后,将1.2 ml表达菌液7 500 r/min离心10 min,上清中加入三氯醋酸至终浓度10%,混匀,15 000 r/min离心10 min,沉淀用0.5 ml丙酮洗涤,15 000 r/min离心10 min,去丙酮,加入适量的水和等体积的2X Laemmli上样缓冲液,煮沸5 min,取20 μl进行SDS-PAGE电泳分析,鉴定有无表达。
, 百拇医药
1.7 表达时相分析
接种转化有表达质粒pBLPAV7-ACATn的AR68单克隆菌落于2LB/AP培养液,32℃培养过夜,取过夜菌按20%接种量接种于新鲜2LB/AP培养液,32℃培养2~3h,再在42℃继续培养1、2、3、4、5h,进行温敏诱导表达,取样测D600值,离心收集菌体,按每0.1 Dλ菌加10 μl水及等体积的2X Laemmli上样缓冲液悬浮菌体,煮沸5 min,取20 μl进行SDS-PAGE电泳分析,鉴定有无表达。
2 结果
2.1 表达质粒的构建
pBLPAV系列(包括分泌、非分泌)表达质粒是在PL Promoter控制下的高效表达载体,表达产物N-端融合protein A BC domain,便于用IgG固相柱亲和纯化。根据ACAT cDNA K1序列的酶切图谱,将其编码ACATn的ACAT cDNA片段克隆至该系列载体这中,经过一系列的酶切、补平、连接等重组操作,分别获得了其N-端融合有PABC的ACATn包括非分泌、分泌表达质粒pBLPAV7-ACATn,见图1、pLSPA12-ACATn(未显示)。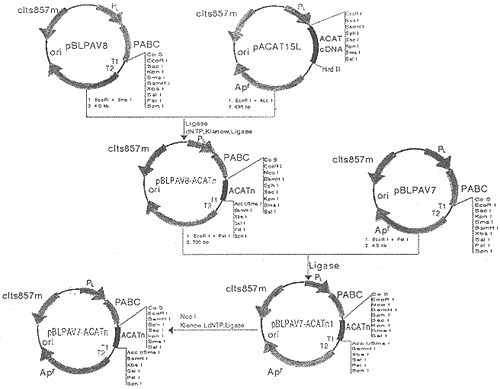
, http://www.100md.com
图1 表达质粒的构建流程
Fig 1 Construction of expression plasmid pBLPAV7-ACATn
2.2 表达质粒pBLPAV7-ACATn的酶切鉴定
重组质粒pBLPAV7-ACATn经合适限制性内切酶(NcoI和XbaI)切,未切出相应的DNA片段,表明pBLPAV7-ACATn1中NcoI切点经酶切、补平、连接等操作被消除,未消除NcoI切点的质粒切出大小约700 bp片段,与理论值相符,见图2。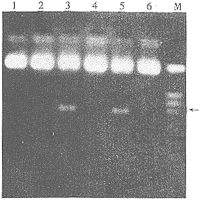
图2 表达质粒的酶切鉴定
, http://www.100md.com
Fig 2 Identification of the expression plasmids
pBLPAV7-ACATn(NcoI+XbaI);Lane 1、2、4、6:positive clones;M:marker(λ DNA/Hind Ⅲ and φ X174/Hae Ⅲ)
2.3 融合proteinA BC domain的ACAT N端片段在E.coli AR68中的表达
将构建的非分泌表达质粒转化到不同的表达菌(包括AR68、RR1、MC1061、BL21)中,分泌表达质粒转化至BL21(DE3)中,进行表达研究,仅观察到pBLPAV7-ACATn表达质粒转在AR68菌株中有相应的表达条带,分子量分别约41×103u(与理论推算值相符),表达量约占全菌蛋白的2%,3个克隆菌表达量没有明显差别,见图3。其余表达菌中均未观察到相应的表达条带。
, 百拇医药
图3 表达产物的SDS-PAGE电泳分析
Fig 3 SDS-PAGE analysis of the expression products from AR68 harboring the plasmid pBLPAV7-ACATn
Lane 1:total bacterial proteins from cells incubated at 32℃;Lane 2-4:total bacterial proteins from cells incubated at 42℃;Lane 5:protein molecular weight marker.
2.4 表达时相分析
在观察到有表达后,再分析不同的诱导时间对表达量的影响,结果表明42℃诱导1 h就能观察到表达条带,且表达量最高,其后表达量减少,见图4。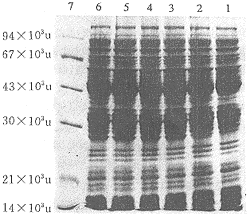
, 百拇医药
图4 不同时相表达产物的SDS-PAGE电泳分析
Fig 4 SDS-PAGE analysis of the expression products from AR68 harboring the plasmid pBLPAV7-ACATn induced different time
Lane 1:total bacterial proteins from cells incubated at 32℃;Lane 2~6:total bacterial proteins from cells incubated at 42℃ for 1,2,3,4,5 h;Lane 7:protein molecular weight marker.
3 讨论
胆固醇在生物体内起着重要的作用,是哺乳动物细胞维持生命过程所必需的。正常动物体内胆固醇代谢保持动态平衡,体内胆固醇的含量过高或过低都会引起病变。ACAT的主要生理功能是将体内多余的胆固醇转化成胆固醇酯,在调节胆固醇代谢平衡过程中起重要作用。实验证据表明,高胆固醇血症引起动脉管壁ACAT活性升高,导致巨噬细胞内胆固醇酯大量堆积,形成泡沫细胞,是动脉粥样硬化症发生的早期事件[6]。ACAT的纯化极其困难,至今这一问题还未得到解决[1]。重组表达是纯化ACAT的最有效的手段,但由于ACAT分子疏水极强,表达产物不易形成正确的折叠,极易被水解,因此,ACAT的重组表达也很困难,亦未见有成功的报道。
, 百拇医药
根据ACAT cDNA的酶切图谱,我们将编码包含第一个跨膜区的ACAT氨基端(ACATn)的ACAT cDNA片段克隆至不同的高效表达载体中进行表达研究,以期表达纯化得到相应的表达产物,进一步进行活性分析并制备相应的抗体。在进行大量表达条件摸索的基础上,在大肠杆菌中成功表达了与PABC融合包含第一个跨膜区的ACAT氨基片段(PABC-ACATn)。表达量分别占全菌蛋白的2%。ACATn与亲水性较强的proteinA BC domain融合,既增强表达产物的稳定性,提高表达量,又便于利用亲和层析纯化表达产物[7]。即使这样,表达产物PABC-ACATn还不稳定,仅在蛋白酶较缺乏的AR68菌株中获得表达。从诱导时间分析,温敏诱导1 h后,就能观察到表达条带,但随着时间的延长,表达产物的量逐渐减少,表明表达产物不稳定,易降解。
ACATn的成功表达为进一步纯化ACATn及重组表达完整的ACAT蛋白分子积累了条件和经验,为进一步在蛋白水平研究ACAT结构与功能的关系以及筛选ACAT有效的抑制剂打下基础。
, http://www.100md.com
作者简介:中国科学院生物化学研究所,上海,200031
参考文献
1 Chang C Y, Catherine C Y C, Dong C. Acyl-coenzyme A:cholesterol acyltransferase. Anna Rev Biochem,1997,66(6):613
2 Doolittle G M, Chang T Y. Solubilization,partial purification and reconstitution in phosphatidylcoline-cholesterol liposomes of acyl-coA:chrosterol acyltransferase. Biochemistry,1982,21(2):674
3 Catherine C Y C, Cheng J, Chang T Y. Molecular cloning and functional expresion of human acyl-coenzyme A: chrosterol acyltransferaseacyl cDNA in mutant Chinese hamster overy cells. J Biol Chem,1993,2688(11):20747
, http://www.100md.com
4 Sambrook J, Fritsch E F, Mariatis T. Molecular cloning: A laboratory Manual, 2nd ed. New York: Cold Spring Harbor Press, Cold Spring Harbor,1989.59~73
5 Laemmli U K. Cleavege of structural proteins during the assembly of the head of bacteriophage T4. Nature(London),1970,227(2):680
6 Brown M S, Goldstein J L. Lipoprotein metabolism in the macrophage:implications for cholesterol deposition in atherosclerosis. Ann Review Biochem,1983,52(5):223
7 李伯良,杨新颖,江智红,等.易于基因产物加工和快速纯化的融合表达载体.生物工程学报,1994,10(2):206
(收稿:1998-07-30;修回:1999-01-26), 百拇医药
单位:叶治家 程天民 江智红 李伯良 第三军医大学预防医学系防原医学教研室,全军复合伤研究所 重庆,400038
关键词:酰基辅酶A:胆固醇乙酰基转移酶;氨基端片段;基因表达
提要 目的
提要 目的:重组表达人ACAT的N端片段。方法:将编码ACAT氨基末端包含第一个跨膜区(1~196 aa)的cDNA片段克隆至不同的大肠杆菌表达载体中,构建了多种大肠杆菌表达质粒,再转化至大肠杆菌中进行表达研究。结果和结论:在详细摸索表达条件的基础上,经温敏诱导,成功地在大肠杆菌AR68中表达了N端融合proteinA BC domain的人ACAT氨基末端包含第一个跨膜区的片段,表达量约20 mg/L菌液。为进一步表达完整的ACAT蛋白、研究ACAT基因表达调控及其结构与功能的关系奠定了基础。
, http://www.100md.com
中图法分类号 R345
Expression of human ACAT N-terminal fragment in E. coli
Ye Zhijia, Cheng Tianmin, Jiang Zhihong, Li Boliang
(Department of Radiation Medicine, Third Military Medical University, Chongqing,400038)
Abstract Objective: To express acyl-coenzyme A: cholesterolacyl-transferase (ACAT) N-terminal containing the membrane anchoring region 1 (ACATn). Methods: The gene encoding the ACATn was cloned into the expression vector and transferred into E. coli.Results and Conclusion: The expressed product of ACATn fused with protein ABC domain and was detected in E.coli AR68.
, http://www.100md.com
Key words acyl-coA; cholesterolacyltransferase; N-terminal fragment; gene expression
酰基辅酶A:胆固醇酰基转移酶(Acyl-coenzyme A: cholesterolacyltransferase, ACAT; EC2.3.1.26)催化胆固醇与长链脂肪酸形成胆固醇酯。ACAT在体内胆固醇的吸收、运输、贮存等过程中发挥极其重要的作用,是调节体内胆固醇代谢平衡的关键酶之一[1]。遗传及细胞生物学实验表明,动脉粥样硬化发生与体内ACAT活性过高密切相关。ACAT在细胞内主要分布在粗面内质网膜上,且含量极低,遇去垢剂易失活,分离纯化极其困难[2],使得对ACAT的研究多年来停留在细胞水平。1993年美国Dartmouth医学院Chang实验室利用ACAT缺陷的CHO突变细胞株AC29克隆了人ACAT的cDNA[3],从而把ACAT的研究带入分子水平。从ACAT cDNA编码的氨基酸序列分析得知,人ACAT含550氨基酸残基,其中60%以上为疏水氨基酸,包含两个跨膜区,疏水性极强,这类蛋白质极不稳定,重组表达也十分困难。我们在进行大量表达及纯化条件摸索的基础上,在大肠杆菌中成功表达了与葡萄球菌蛋白A的BC domain(Protein A BC, PABC)融合、包含第一跨膜区的ACAT氨基端片段(PABC-ACATn)。
, http://www.100md.com
1 材料与方法
1.1 质粒、菌种
质粒pACAT15L、pMFLV3、pBLPAV7、pBLSPV3;大肠杆菌BL21(DE3)、MC1061、AR68、RR1等均由中图科学院生物化学研究所220组保存。
1.2 酶、化学试剂
DNA限制性内切酶、Klenow酶、T4DNA连接酶购自Biolabs,丙烯酰胺、甲叉丙烯酰胺、十二烷基硫酸钠(SDS)为Fluka产品,PMSF购自Boehringer Mannhein,其它试剂均为进口或国产分析纯。
1.3 细菌培养、质粒抽提、酶切反应、DNA电泳鉴定及回收、连接反应、质粒转化
均按文献[4]进行。
, http://www.100md.com
1.4 蛋白质分析SDS-聚丙烯酰胺凝胶电泳
按Laemmli[5]方法进行。
1.5 外源基因的表达
重组表达质粒转化大肠杆菌,随机接种3个单克隆菌落于LB/AP(AR68菌用2LB/AP)培养液,32℃培养过夜,取过夜菌按2%(AR68菌按20%)接种量接种于新鲜LB/AP(AR68菌用2LB/AP)培养液,32℃培养2~3h,再在42℃继续培养32 h进行温敏诱导表达。
1.6 表达产物的鉴定分析
全菌蛋白样品的制备:取表达菌液测D600值,离心收集菌体,按每0.1 Dλ菌加10 μl水及等体积的2×Laemmli上样缓冲液悬浮菌体,煮沸5 min,取20 μl进行SDS-PAGE电泳分析,鉴定有无表达。分泌至培养基中蛋白样品的制备:诱导后,将1.2 ml表达菌液7 500 r/min离心10 min,上清中加入三氯醋酸至终浓度10%,混匀,15 000 r/min离心10 min,沉淀用0.5 ml丙酮洗涤,15 000 r/min离心10 min,去丙酮,加入适量的水和等体积的2X Laemmli上样缓冲液,煮沸5 min,取20 μl进行SDS-PAGE电泳分析,鉴定有无表达。
, 百拇医药
1.7 表达时相分析
接种转化有表达质粒pBLPAV7-ACATn的AR68单克隆菌落于2LB/AP培养液,32℃培养过夜,取过夜菌按20%接种量接种于新鲜2LB/AP培养液,32℃培养2~3h,再在42℃继续培养1、2、3、4、5h,进行温敏诱导表达,取样测D600值,离心收集菌体,按每0.1 Dλ菌加10 μl水及等体积的2X Laemmli上样缓冲液悬浮菌体,煮沸5 min,取20 μl进行SDS-PAGE电泳分析,鉴定有无表达。
2 结果
2.1 表达质粒的构建
pBLPAV系列(包括分泌、非分泌)表达质粒是在PL Promoter控制下的高效表达载体,表达产物N-端融合protein A BC domain,便于用IgG固相柱亲和纯化。根据ACAT cDNA K1序列的酶切图谱,将其编码ACATn的ACAT cDNA片段克隆至该系列载体这中,经过一系列的酶切、补平、连接等重组操作,分别获得了其N-端融合有PABC的ACATn包括非分泌、分泌表达质粒pBLPAV7-ACATn,见图1、pLSPA12-ACATn(未显示)。

, http://www.100md.com
图1 表达质粒的构建流程
Fig 1 Construction of expression plasmid pBLPAV7-ACATn
2.2 表达质粒pBLPAV7-ACATn的酶切鉴定
重组质粒pBLPAV7-ACATn经合适限制性内切酶(NcoI和XbaI)切,未切出相应的DNA片段,表明pBLPAV7-ACATn1中NcoI切点经酶切、补平、连接等操作被消除,未消除NcoI切点的质粒切出大小约700 bp片段,与理论值相符,见图2。

图2 表达质粒的酶切鉴定
, http://www.100md.com
Fig 2 Identification of the expression plasmids
pBLPAV7-ACATn(NcoI+XbaI);Lane 1、2、4、6:positive clones;M:marker(λ DNA/Hind Ⅲ and φ X174/Hae Ⅲ)
2.3 融合proteinA BC domain的ACAT N端片段在E.coli AR68中的表达
将构建的非分泌表达质粒转化到不同的表达菌(包括AR68、RR1、MC1061、BL21)中,分泌表达质粒转化至BL21(DE3)中,进行表达研究,仅观察到pBLPAV7-ACATn表达质粒转在AR68菌株中有相应的表达条带,分子量分别约41×103u(与理论推算值相符),表达量约占全菌蛋白的2%,3个克隆菌表达量没有明显差别,见图3。其余表达菌中均未观察到相应的表达条带。

, 百拇医药
图3 表达产物的SDS-PAGE电泳分析
Fig 3 SDS-PAGE analysis of the expression products from AR68 harboring the plasmid pBLPAV7-ACATn
Lane 1:total bacterial proteins from cells incubated at 32℃;Lane 2-4:total bacterial proteins from cells incubated at 42℃;Lane 5:protein molecular weight marker.
2.4 表达时相分析
在观察到有表达后,再分析不同的诱导时间对表达量的影响,结果表明42℃诱导1 h就能观察到表达条带,且表达量最高,其后表达量减少,见图4。

, 百拇医药
图4 不同时相表达产物的SDS-PAGE电泳分析
Fig 4 SDS-PAGE analysis of the expression products from AR68 harboring the plasmid pBLPAV7-ACATn induced different time
Lane 1:total bacterial proteins from cells incubated at 32℃;Lane 2~6:total bacterial proteins from cells incubated at 42℃ for 1,2,3,4,5 h;Lane 7:protein molecular weight marker.
3 讨论
胆固醇在生物体内起着重要的作用,是哺乳动物细胞维持生命过程所必需的。正常动物体内胆固醇代谢保持动态平衡,体内胆固醇的含量过高或过低都会引起病变。ACAT的主要生理功能是将体内多余的胆固醇转化成胆固醇酯,在调节胆固醇代谢平衡过程中起重要作用。实验证据表明,高胆固醇血症引起动脉管壁ACAT活性升高,导致巨噬细胞内胆固醇酯大量堆积,形成泡沫细胞,是动脉粥样硬化症发生的早期事件[6]。ACAT的纯化极其困难,至今这一问题还未得到解决[1]。重组表达是纯化ACAT的最有效的手段,但由于ACAT分子疏水极强,表达产物不易形成正确的折叠,极易被水解,因此,ACAT的重组表达也很困难,亦未见有成功的报道。
, 百拇医药
根据ACAT cDNA的酶切图谱,我们将编码包含第一个跨膜区的ACAT氨基端(ACATn)的ACAT cDNA片段克隆至不同的高效表达载体中进行表达研究,以期表达纯化得到相应的表达产物,进一步进行活性分析并制备相应的抗体。在进行大量表达条件摸索的基础上,在大肠杆菌中成功表达了与PABC融合包含第一个跨膜区的ACAT氨基片段(PABC-ACATn)。表达量分别占全菌蛋白的2%。ACATn与亲水性较强的proteinA BC domain融合,既增强表达产物的稳定性,提高表达量,又便于利用亲和层析纯化表达产物[7]。即使这样,表达产物PABC-ACATn还不稳定,仅在蛋白酶较缺乏的AR68菌株中获得表达。从诱导时间分析,温敏诱导1 h后,就能观察到表达条带,但随着时间的延长,表达产物的量逐渐减少,表明表达产物不稳定,易降解。
ACATn的成功表达为进一步纯化ACATn及重组表达完整的ACAT蛋白分子积累了条件和经验,为进一步在蛋白水平研究ACAT结构与功能的关系以及筛选ACAT有效的抑制剂打下基础。
, http://www.100md.com
作者简介:中国科学院生物化学研究所,上海,200031
参考文献
1 Chang C Y, Catherine C Y C, Dong C. Acyl-coenzyme A:cholesterol acyltransferase. Anna Rev Biochem,1997,66(6):613
2 Doolittle G M, Chang T Y. Solubilization,partial purification and reconstitution in phosphatidylcoline-cholesterol liposomes of acyl-coA:chrosterol acyltransferase. Biochemistry,1982,21(2):674
3 Catherine C Y C, Cheng J, Chang T Y. Molecular cloning and functional expresion of human acyl-coenzyme A: chrosterol acyltransferaseacyl cDNA in mutant Chinese hamster overy cells. J Biol Chem,1993,2688(11):20747
, http://www.100md.com
4 Sambrook J, Fritsch E F, Mariatis T. Molecular cloning: A laboratory Manual, 2nd ed. New York: Cold Spring Harbor Press, Cold Spring Harbor,1989.59~73
5 Laemmli U K. Cleavege of structural proteins during the assembly of the head of bacteriophage T4. Nature(London),1970,227(2):680
6 Brown M S, Goldstein J L. Lipoprotein metabolism in the macrophage:implications for cholesterol deposition in atherosclerosis. Ann Review Biochem,1983,52(5):223
7 李伯良,杨新颖,江智红,等.易于基因产物加工和快速纯化的融合表达载体.生物工程学报,1994,10(2):206
(收稿:1998-07-30;修回:1999-01-26), 百拇医药