庆大霉素中毒豚鼠蜗核SP免疫反应阳性神经元的变化
作者:许珉 胡海涛朱宏亮 王唯析樊玉林 毕育学
单位:许 珉 朱宏亮 樊玉林(第二临床医学院耳鼻喉科 西安 710004);王唯析 胡海涛 解剖学教研室;毕育学 卫生统计学教研室
关键词:耳聋;蜗神经核;P物质;庆大霉素;免疫组织化学
摘要 用免疫组化方法探讨庆大霉素耳中毒时蜗核SP免疫反应神经元的胞体截面积及细胞数的变化 摘要 用免疫组化方法探讨庆大霉素耳中毒时蜗核SP免疫反应神经元的胞体截面积及细胞数的变化。结果发现庆大霉素100mg.kg-1.d-1腹腔注射后1d,豚鼠蜗核SP样神经元胞体截面积立即发生了变化,并持续到连续注药第21天;SP样神经元细胞数量的相对变化发生在注药3d以后。结果提示:①庆大霉素中毒豚鼠蜗核神经元的变化和耳蜗的病变可能同时发生或蜗核早于耳蜗病变。②临床上治疗氨基甙类抗生素所致耳聋应兼治中枢病变并尽早实施。
, 百拇医药
THE CHANGES OF SP IMMUNOREACTION NEURON OF
NUCLEUS IN GUINEA PIGS WITH GENTAMYCINE TOXICITY
Xu Min, Hu Haitao, Zhu hongliang et al
(Department of Otorhinolaryngology, Second Affiliated Hospital)
Abstract The number and cell body area of SP immunoreactive neuron were determided in cochlear nucleus of guinea pigs with gentamycine (GM) toxicity using the method of immunohistochemistry .The results showed that:One day after GM (100mg.kg-1.d-1)was injected into the abdominal cavity,the cell body area of cochlear nucleus SP-like neurons changed immediately and remaining the results until twenty-first day after injecting GM continuously, the relative changes of cell number of SP-like neurons occured in third day after injecting GM.These indicates that ①The pathological changes of cochlear hair-cells and cochlear nucleus neurons after GM toxicity may happen at same time or the pathological changes of cochlear nucleus is earlier than that of cochlear hair-cells;②Central pathological changes should be considered in treating hearing loss induced by aminoglyacid antibiotics ,and the earlier, the better.
, 百拇医药
Key words hearing loss;cochlear nucleus;gentamicine ,substance P;immunohistochemistry
近二十余年来,有关正常动物听觉中枢核团内神经递质、受体及它们的合成或降解酶的分布研究较多[1],并证实P物质(substance P,SP)是听觉传导径路的递质之一,但均限于对正常动物的观察。至于耳聋时听觉中枢核团的变化多注重耳蜗或听神经切除后对核团体积的影响。迄今为止,有关耳毒性药物引起听力损失时听觉中枢核团内神经元的病变研究甚少。本研究观察了庆大霉素(Gentamycine, GM)中毒对蜗核SP阳性神经元的影响。
材料和方法
取健康发育中的杂色豚鼠60只(西安医科大学动物中心提供),雌雄不拘,体重200~300g,耳廓反射灵敏,耳道及鼓膜正常。随机分为6组,每组10只,设正常对照组, GM1d、3d、1周、 2周及 3周模型组。GM 100mg.kg-1.d-1腹腔注射,每日一次。对照组每天腹腔注射等体积的生理盐水。用药结束,立即解剖。
, http://www.100md.com
各组豚鼠用药前采用日产VC-10电生理记录仪,在隔音屏蔽室行听觉脑干诱发电位检查,同时记录各组动物的听阈值。并和GM1d、3d、1周、2周和3周组进行比较。参照Paxinos和Watson大鼠脑图谱,动物均在解剖前1d定时将秋水仙素,按0.6μg/g的剂量缓慢注入侧脑室,持续20min,留针10min。动物保温观察24h,并注意喂水。动物再次麻醉后固定于解剖台上,灌注针头经左心室插入主动脉,快速灌注0.9% NaCl 250ml,再相继灌入4℃的4%多聚甲醛磷酸盐缓冲液(1ml*g-1),约1~1.5h滴完,然后断头,在蜗核平面取脑,入20%蔗糖溶液,4℃直至组织块沉底。脑组织行冠状连续切片,切片厚40μm,从吻侧出现所需结构开始,隔4取1,按ABC法常规进行免疫组织化学染色,兔抗SP抗体1∶1500。明胶裱片,脱水,透明,中性树胶封固,光镜观察。用PBS代替SP抗体进行对照染色,结果均为阴性。
图像分析采用Leica公司的Quantimet 570图像分析仪,测定免疫反应阳性神经元的胞体截面积(μm2)。在显微镜下计其SP免疫反应阳性神经元中含核细胞数目,以每高倍(×40)视野中神经元个数表示。数据处理采用大型统计软件Statistics Package of Social Science (SPSS)进行方差分析或t检验。
, 百拇医药
结果
1 ABR阀值的变化
从表1可知,在GM1周组听阈值明显提高,与正常对照组比较有高度显著性差异(P<0.0001)。并且随用药时间的延长,听阈值不断提高。
2 SP样神经元的图像分析及统计处理 表2示蜗神经核各亚核的SP阳性神经元的胞体截面积在GM中毒后均发生了明显的变化(P<0.05),并且在注射GM1d以后就立即发生了变化,尤以腹前核及腹后核变化最为显著,腹前核在注药1d后胞体截面积减少了50%,和对照组比较有高度显著性差异(P<0.01)。
表1 注射GM豚鼠ABR阈值的变化(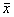 ±s)
±s)
, 百拇医药
组 别
听阈值
P值
对照组
12.25±2.06
GM1d
15.00±5.77
0.4042
GM3d
17.50±5.00
0.1002
GM1周
32.05±2.08
, http://www.100md.com
0.0001
GM2周
58.75±4.79
0.0001
GM3周
67.50±6.46
0.0001
表2 GM中毒豚鼠SP样神经元胞体截面积的变化 (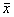 ±s,μm2)
±s,μm2)
组 别
, http://www.100md.com
腹前核
腹后核
蜗神经背核
对照组
326.5±105.5
336.5±69.73
228.4±97.57
GM1d
168.8±49.22**
209.1±76.30**
175.7±73.82*
, http://www.100md.com
GM3d
187.5±50.62**
210.3±61.49**
186.0±81.84
GM1周
212.1±71.81**
135.7±64.27**
141.6±44.61**
GM2周
179.1±59.65**
, http://www.100md.com
227.6±85.20**
128.3±29.90**
GM3周
195.0±54.45**
243.5±75.69**
173.5±106.5*
与对照组比较*P<0.05,**P<0.01
表3 GM中毒豚鼠SP样神经元数量的变化 (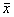 ±s)
±s)
, 百拇医药
组 别
腹前核
腹后核
蜗神经背核
对照组
23.0±4.18
17.4±3.21
17.6±5.22
GM1d
20.0±3.74
20.0±6.69
13.8±3.34
, http://www.100md.com
GM3d
36.6±8.67**
28.2±8.04**
30.6±3.05**
GM1周
33.0±6.63**
30.4±3.91**
26.8±8.22**
GM2周
32.2±5.07*
, 百拇医药
31.0±5.43**
29.6±4.16**
GM3周
36.1±7.93**
32.8±4.32*
26.0±4.12**
与对照组比较 *P<0.05,**P<0.01
3 神经元数量的变化
表3显示:GM中毒后,蜗核各亚核SP神经元的数量均程度不同发生了变化,总的趋势为随着GM用药时间的延长,细胞数量从GM3d组开始明显增加并保持此水平到GM3周。
, 百拇医药
讨论
蜗神经核由蜗神经腹核及蜗神经背核组成,蜗神经腹核又被蜗神经根分为腹前核及腹后核。应用GM1d后蜗神经核的三个亚核SP阳性神经元胞体截面积立即缩小,和对照组比较有高度显著性差异(P<0.01),尤以腹前核变化最剧,胞体截面积减少近50%,腹后核减少近40%,蜗神经背核减少24%,并且一直持续到连续注药21d。Lustig等[2]的实验结果为,猫肌注新霉素后各亚核体积变化为腹前核减低35%,腹后核减低39%,蜗神经背核减低33%。长期新生致聋组(66~133周)猫的球细胞截面积则降为305μm2,与对照组比较降低了38.5%,说明随着用药时间的进一步延长,球细胞截面积呈进行性下降。与本实验结果总变化趋势一致,但数据有一定差距,可能与本实验测定的是SP阳性神经元截面积,而他们测定的是所有球细胞的截面积有关。另外,动物的种属及所用药物的剂量不同也有一定影响。倪道凤等[3]测定了手术破坏耳蜗后豚鼠蜗核甲苯胺蓝染色神经元的截面积,与正常对照组相比,新生鼠4d、7d、60d腹前核分别降低51.8%、50.0%和51%;腹后核分别降低32.28%、32.81%和32.75%,以上实验结果显示:不论是耳蜗切除,还是耳蜗局部及全身应用耳毒性药物,均可导致蜗神经核细胞截面积的缩小。发生以上变化的原因,Holme等[4]和Rubel等[5]的解释如下,对于听觉系统的正常发育来说,需要正常的感觉输入,即离开了这个感觉输入或声音刺激,听觉神经元的发育就要受到影响。当动物听觉丧失或耳蜗切除后,蜗核就发生变化,包括总体积减小,蜗核细胞萎缩,腹前核神经元的听觉终末明显减少;出现无代谢活性的小线粒体,丧失了发育[6,7]。
, 百拇医药
有实验证实[8]SP是耳蜗初级传入神经递质之一,并且SP参与声信号在脑干听觉中枢和内侧膝状体的传递。所以SP阳性神经元的病变,必然影响到听觉信号的传递及听觉的产生。本实验应用GM1d后,蜗核三个亚核的球细胞SP样神经元胞体截面积迅速发生了变化,既往对此的解释多认为是继发于耳蜗毛细胞和螺旋神经节的变化。藏玉洤[9]在豚鼠实验中,发现链霉素中毒时,除内耳病变外,前庭和听觉神经系统均有广泛的损害,认为这些损害并非内耳损害的继发病变。从我们的形态学观察及功能测定结果来看,也不能支持耳蜗神经核的变化完全是继发性改变,因为应用GM1d豚鼠的行为学观察未见异常变化,电镜观察亦未发现内、外毛细胞的任何明显病变,而此时的蜗核SP神经元胞体截面积却迅速变小,且维持此水平到第21d。综上所述,我们认为蜗神经核的病变是否同耳蜗病变同时发生或蜗核病变更早于耳蜗毛细胞病变。如果持这种观点认识耳蜗病变与中枢病变的关系,老年性聋出现的严重的感音神经性耳聋而耳蜗Corti器和血管纹是正常的[10]这一病理现象就较为容易理解了。
, http://www.100md.com
在GM的影响下,蜗核三个亚核SP免疫反应神经元的数量呈增加趋势。Fleckeisen[11]认为,听力丧失增加腹侧蜗核大暗球细胞的密度,是因为腹侧核的体积缩小了。简而言之,蜗核总体积缩小了,所以单位面积或体积的细胞数就增加了。细胞的体积或蜗核的体积缩小导致了神经元数量相对增多,但实际上神经元数量并未增加。
本文用免疫组化法证实,GM中毒不仅引起了耳蜗的病变,而且导致了中枢听觉核团蜗核SP神经元胞体截面积的改变。由于蜗核SP样神经元胞体截面积在应用GM24h后就立即发生了改变,而此时实验豚鼠的脑干诱发电位未见异常,电镜观察亦未发现内外毛细胞的任何明显病变。故认为蜗核病变与耳蜗病变同时发生或早于耳蜗病变。本研究为认识耳聋的中枢病变及早期防治耳聋应兼治中枢病变提供了理论依据。
参考文献
1 Hunter C,Doi K,Wanthold RJ, Neurotransmission in the auditory system .Otolaryngol Clinic of North America,1992;25(5)∶1027
, 百拇医药
2 Lustig LR, leake PA.Snyder RL et al.Changes in the cat cochlear nucleus following neonatal denfening and chronic intracochlear electrical stimulation.Hearing Res,1994;74∶29
3 倪道风,杜明,徐春晓等.豚鼠耳蜗损伤对耳蜗核神经元细胞面积的影响.中华耳鼻咽喉科杂志,1997;32(5)∶264
4 Holme VA,Kunze LH.Effect of chronic otitis media on language and speech development.Pediatrics,1969;43∶833
5 Rubel EW, Born DE,Deitch JS et al.Recent advances toward understanding auditory system development.In:C Berlin(Ed),Hearing science.San Diego, CA;1984∶109~157
, 百拇医药
6 Trune DR,Influence of neonatal cochlear removal on the development of mouse cochlear nucleus:I number,size and density of its neurons.J Comp Neurol,1982;209∶409
7 Coleman J,O Connor P.Effects of monaural and binarural sound deprivation on cell development in the anteroventral cochlear nucleus of rats.Exp Neurol,1979;64∶553
8 邱建华,王锦玲,施际武等.豚鼠耳蜗SP和SP受体分布的免疫组织化学研究.第四军医大学学报,1996;17(1)∶1
9 藏玉洤,秦廷权.链霉素对于神经结构的毒害.解剖学报,1963;6(2)∶109
, 百拇医药
10 Otte J.Ganglion cell populations in normal and pothological human cochlear,implication for cochleor implantation. Laryngoscope, 1978;88(8)∶1233
11 Fleckeisen CE, Harrison RV,Mount RJ.Effects of total cochlear haircell loss on integrity of cochlear nucleus.Acta Otolarynogol (stockh),1991;489(suppl)∶23
(1999-03-12收稿 1999-05-12修回), 百拇医药
单位:许 珉 朱宏亮 樊玉林(第二临床医学院耳鼻喉科 西安 710004);王唯析 胡海涛 解剖学教研室;毕育学 卫生统计学教研室
关键词:耳聋;蜗神经核;P物质;庆大霉素;免疫组织化学
摘要 用免疫组化方法探讨庆大霉素耳中毒时蜗核SP免疫反应神经元的胞体截面积及细胞数的变化 摘要 用免疫组化方法探讨庆大霉素耳中毒时蜗核SP免疫反应神经元的胞体截面积及细胞数的变化。结果发现庆大霉素100mg.kg-1.d-1腹腔注射后1d,豚鼠蜗核SP样神经元胞体截面积立即发生了变化,并持续到连续注药第21天;SP样神经元细胞数量的相对变化发生在注药3d以后。结果提示:①庆大霉素中毒豚鼠蜗核神经元的变化和耳蜗的病变可能同时发生或蜗核早于耳蜗病变。②临床上治疗氨基甙类抗生素所致耳聋应兼治中枢病变并尽早实施。
, 百拇医药
THE CHANGES OF SP IMMUNOREACTION NEURON OF
NUCLEUS IN GUINEA PIGS WITH GENTAMYCINE TOXICITY
Xu Min, Hu Haitao, Zhu hongliang et al
(Department of Otorhinolaryngology, Second Affiliated Hospital)
Abstract The number and cell body area of SP immunoreactive neuron were determided in cochlear nucleus of guinea pigs with gentamycine (GM) toxicity using the method of immunohistochemistry .The results showed that:One day after GM (100mg.kg-1.d-1)was injected into the abdominal cavity,the cell body area of cochlear nucleus SP-like neurons changed immediately and remaining the results until twenty-first day after injecting GM continuously, the relative changes of cell number of SP-like neurons occured in third day after injecting GM.These indicates that ①The pathological changes of cochlear hair-cells and cochlear nucleus neurons after GM toxicity may happen at same time or the pathological changes of cochlear nucleus is earlier than that of cochlear hair-cells;②Central pathological changes should be considered in treating hearing loss induced by aminoglyacid antibiotics ,and the earlier, the better.
, 百拇医药
Key words hearing loss;cochlear nucleus;gentamicine ,substance P;immunohistochemistry
近二十余年来,有关正常动物听觉中枢核团内神经递质、受体及它们的合成或降解酶的分布研究较多[1],并证实P物质(substance P,SP)是听觉传导径路的递质之一,但均限于对正常动物的观察。至于耳聋时听觉中枢核团的变化多注重耳蜗或听神经切除后对核团体积的影响。迄今为止,有关耳毒性药物引起听力损失时听觉中枢核团内神经元的病变研究甚少。本研究观察了庆大霉素(Gentamycine, GM)中毒对蜗核SP阳性神经元的影响。
材料和方法
取健康发育中的杂色豚鼠60只(西安医科大学动物中心提供),雌雄不拘,体重200~300g,耳廓反射灵敏,耳道及鼓膜正常。随机分为6组,每组10只,设正常对照组, GM1d、3d、1周、 2周及 3周模型组。GM 100mg.kg-1.d-1腹腔注射,每日一次。对照组每天腹腔注射等体积的生理盐水。用药结束,立即解剖。
, http://www.100md.com
各组豚鼠用药前采用日产VC-10电生理记录仪,在隔音屏蔽室行听觉脑干诱发电位检查,同时记录各组动物的听阈值。并和GM1d、3d、1周、2周和3周组进行比较。参照Paxinos和Watson大鼠脑图谱,动物均在解剖前1d定时将秋水仙素,按0.6μg/g的剂量缓慢注入侧脑室,持续20min,留针10min。动物保温观察24h,并注意喂水。动物再次麻醉后固定于解剖台上,灌注针头经左心室插入主动脉,快速灌注0.9% NaCl 250ml,再相继灌入4℃的4%多聚甲醛磷酸盐缓冲液(1ml*g-1),约1~1.5h滴完,然后断头,在蜗核平面取脑,入20%蔗糖溶液,4℃直至组织块沉底。脑组织行冠状连续切片,切片厚40μm,从吻侧出现所需结构开始,隔4取1,按ABC法常规进行免疫组织化学染色,兔抗SP抗体1∶1500。明胶裱片,脱水,透明,中性树胶封固,光镜观察。用PBS代替SP抗体进行对照染色,结果均为阴性。
图像分析采用Leica公司的Quantimet 570图像分析仪,测定免疫反应阳性神经元的胞体截面积(μm2)。在显微镜下计其SP免疫反应阳性神经元中含核细胞数目,以每高倍(×40)视野中神经元个数表示。数据处理采用大型统计软件Statistics Package of Social Science (SPSS)进行方差分析或t检验。
, 百拇医药
结果
1 ABR阀值的变化
从表1可知,在GM1周组听阈值明显提高,与正常对照组比较有高度显著性差异(P<0.0001)。并且随用药时间的延长,听阈值不断提高。
2 SP样神经元的图像分析及统计处理 表2示蜗神经核各亚核的SP阳性神经元的胞体截面积在GM中毒后均发生了明显的变化(P<0.05),并且在注射GM1d以后就立即发生了变化,尤以腹前核及腹后核变化最为显著,腹前核在注药1d后胞体截面积减少了50%,和对照组比较有高度显著性差异(P<0.01)。
表1 注射GM豚鼠ABR阈值的变化(
, 百拇医药
组 别
听阈值
P值
对照组
12.25±2.06
GM1d
15.00±5.77
0.4042
GM3d
17.50±5.00
0.1002
GM1周
32.05±2.08
, http://www.100md.com
0.0001
GM2周
58.75±4.79
0.0001
GM3周
67.50±6.46
0.0001
表2 GM中毒豚鼠SP样神经元胞体截面积的变化 (
组 别
, http://www.100md.com
腹前核
腹后核
蜗神经背核
对照组
326.5±105.5
336.5±69.73
228.4±97.57
GM1d
168.8±49.22**
209.1±76.30**
175.7±73.82*
, http://www.100md.com
GM3d
187.5±50.62**
210.3±61.49**
186.0±81.84
GM1周
212.1±71.81**
135.7±64.27**
141.6±44.61**
GM2周
179.1±59.65**
, http://www.100md.com
227.6±85.20**
128.3±29.90**
GM3周
195.0±54.45**
243.5±75.69**
173.5±106.5*
与对照组比较*P<0.05,**P<0.01
表3 GM中毒豚鼠SP样神经元数量的变化 (
, 百拇医药
组 别
腹前核
腹后核
蜗神经背核
对照组
23.0±4.18
17.4±3.21
17.6±5.22
GM1d
20.0±3.74
20.0±6.69
13.8±3.34
, http://www.100md.com
GM3d
36.6±8.67**
28.2±8.04**
30.6±3.05**
GM1周
33.0±6.63**
30.4±3.91**
26.8±8.22**
GM2周
32.2±5.07*
, 百拇医药
31.0±5.43**
29.6±4.16**
GM3周
36.1±7.93**
32.8±4.32*
26.0±4.12**
与对照组比较 *P<0.05,**P<0.01
3 神经元数量的变化
表3显示:GM中毒后,蜗核各亚核SP神经元的数量均程度不同发生了变化,总的趋势为随着GM用药时间的延长,细胞数量从GM3d组开始明显增加并保持此水平到GM3周。
, 百拇医药
讨论
蜗神经核由蜗神经腹核及蜗神经背核组成,蜗神经腹核又被蜗神经根分为腹前核及腹后核。应用GM1d后蜗神经核的三个亚核SP阳性神经元胞体截面积立即缩小,和对照组比较有高度显著性差异(P<0.01),尤以腹前核变化最剧,胞体截面积减少近50%,腹后核减少近40%,蜗神经背核减少24%,并且一直持续到连续注药21d。Lustig等[2]的实验结果为,猫肌注新霉素后各亚核体积变化为腹前核减低35%,腹后核减低39%,蜗神经背核减低33%。长期新生致聋组(66~133周)猫的球细胞截面积则降为305μm2,与对照组比较降低了38.5%,说明随着用药时间的进一步延长,球细胞截面积呈进行性下降。与本实验结果总变化趋势一致,但数据有一定差距,可能与本实验测定的是SP阳性神经元截面积,而他们测定的是所有球细胞的截面积有关。另外,动物的种属及所用药物的剂量不同也有一定影响。倪道凤等[3]测定了手术破坏耳蜗后豚鼠蜗核甲苯胺蓝染色神经元的截面积,与正常对照组相比,新生鼠4d、7d、60d腹前核分别降低51.8%、50.0%和51%;腹后核分别降低32.28%、32.81%和32.75%,以上实验结果显示:不论是耳蜗切除,还是耳蜗局部及全身应用耳毒性药物,均可导致蜗神经核细胞截面积的缩小。发生以上变化的原因,Holme等[4]和Rubel等[5]的解释如下,对于听觉系统的正常发育来说,需要正常的感觉输入,即离开了这个感觉输入或声音刺激,听觉神经元的发育就要受到影响。当动物听觉丧失或耳蜗切除后,蜗核就发生变化,包括总体积减小,蜗核细胞萎缩,腹前核神经元的听觉终末明显减少;出现无代谢活性的小线粒体,丧失了发育[6,7]。
, 百拇医药
有实验证实[8]SP是耳蜗初级传入神经递质之一,并且SP参与声信号在脑干听觉中枢和内侧膝状体的传递。所以SP阳性神经元的病变,必然影响到听觉信号的传递及听觉的产生。本实验应用GM1d后,蜗核三个亚核的球细胞SP样神经元胞体截面积迅速发生了变化,既往对此的解释多认为是继发于耳蜗毛细胞和螺旋神经节的变化。藏玉洤[9]在豚鼠实验中,发现链霉素中毒时,除内耳病变外,前庭和听觉神经系统均有广泛的损害,认为这些损害并非内耳损害的继发病变。从我们的形态学观察及功能测定结果来看,也不能支持耳蜗神经核的变化完全是继发性改变,因为应用GM1d豚鼠的行为学观察未见异常变化,电镜观察亦未发现内、外毛细胞的任何明显病变,而此时的蜗核SP神经元胞体截面积却迅速变小,且维持此水平到第21d。综上所述,我们认为蜗神经核的病变是否同耳蜗病变同时发生或蜗核病变更早于耳蜗毛细胞病变。如果持这种观点认识耳蜗病变与中枢病变的关系,老年性聋出现的严重的感音神经性耳聋而耳蜗Corti器和血管纹是正常的[10]这一病理现象就较为容易理解了。
, http://www.100md.com
在GM的影响下,蜗核三个亚核SP免疫反应神经元的数量呈增加趋势。Fleckeisen[11]认为,听力丧失增加腹侧蜗核大暗球细胞的密度,是因为腹侧核的体积缩小了。简而言之,蜗核总体积缩小了,所以单位面积或体积的细胞数就增加了。细胞的体积或蜗核的体积缩小导致了神经元数量相对增多,但实际上神经元数量并未增加。
本文用免疫组化法证实,GM中毒不仅引起了耳蜗的病变,而且导致了中枢听觉核团蜗核SP神经元胞体截面积的改变。由于蜗核SP样神经元胞体截面积在应用GM24h后就立即发生了改变,而此时实验豚鼠的脑干诱发电位未见异常,电镜观察亦未发现内外毛细胞的任何明显病变。故认为蜗核病变与耳蜗病变同时发生或早于耳蜗病变。本研究为认识耳聋的中枢病变及早期防治耳聋应兼治中枢病变提供了理论依据。
参考文献
1 Hunter C,Doi K,Wanthold RJ, Neurotransmission in the auditory system .Otolaryngol Clinic of North America,1992;25(5)∶1027
, 百拇医药
2 Lustig LR, leake PA.Snyder RL et al.Changes in the cat cochlear nucleus following neonatal denfening and chronic intracochlear electrical stimulation.Hearing Res,1994;74∶29
3 倪道风,杜明,徐春晓等.豚鼠耳蜗损伤对耳蜗核神经元细胞面积的影响.中华耳鼻咽喉科杂志,1997;32(5)∶264
4 Holme VA,Kunze LH.Effect of chronic otitis media on language and speech development.Pediatrics,1969;43∶833
5 Rubel EW, Born DE,Deitch JS et al.Recent advances toward understanding auditory system development.In:C Berlin(Ed),Hearing science.San Diego, CA;1984∶109~157
, 百拇医药
6 Trune DR,Influence of neonatal cochlear removal on the development of mouse cochlear nucleus:I number,size and density of its neurons.J Comp Neurol,1982;209∶409
7 Coleman J,O Connor P.Effects of monaural and binarural sound deprivation on cell development in the anteroventral cochlear nucleus of rats.Exp Neurol,1979;64∶553
8 邱建华,王锦玲,施际武等.豚鼠耳蜗SP和SP受体分布的免疫组织化学研究.第四军医大学学报,1996;17(1)∶1
9 藏玉洤,秦廷权.链霉素对于神经结构的毒害.解剖学报,1963;6(2)∶109
, 百拇医药
10 Otte J.Ganglion cell populations in normal and pothological human cochlear,implication for cochleor implantation. Laryngoscope, 1978;88(8)∶1233
11 Fleckeisen CE, Harrison RV,Mount RJ.Effects of total cochlear haircell loss on integrity of cochlear nucleus.Acta Otolarynogol (stockh),1991;489(suppl)∶23
(1999-03-12收稿 1999-05-12修回), 百拇医药