Na+通道阻断剂对脑缺血海马锥体细胞损伤的保护作用*
作者:朱忠良 李晖樊小力 师建华 崔得华田平武
单位:朱忠良 樊小力 师建华(生理学教研室 西安 710061);李 晖 西安医科大学第一临床医学院妇产科;崔得华田平武 日本国立精神神经中心脱髓鞘病和衰老疾病研究部
关键词:一过性脑缺血;海马;脑室内注射;钠离子通道阻断剂
西安医科大学学报/990304 摘要 实验为观察在脑一过性缺血条件下,Na+通道阻断剂对海马CA1区锥体细胞是否具有保护作用,对9月龄Wistar大鼠进行实验。通过脑室内单独注射利多卡因、利多卡因和呋喃苯胺酸复合应用,用H-E染色方法通过计算机对海马CA1区神经元计数。结果发现,单独注射2%利多卡因5μl,对海马CA1区锥体细胞无保护作用;2%利多卡因和2%呋喃苯胺酸各2.5μl联合应用,与对照组相比,具有显著性差异(P<0.01)。实验结果提示,Na+通道阻断剂联合应用,可能是预防脑缺血引起海马CA1区神经细胞损伤的重要途径之一。
, 百拇医药
THE PROTECTIVE EFFECT OF Na+ CHANNEL BLOCKERS
AGAINST CELL DAMAGE CASUSED BY ISCHEMIA
Zhu Zhongliang, Li Hui, Fan Xiaoli et al
(Department of Physiology)
Abstract In order to observe it blockers of sodium channel obsesses the neuroprotective effect on hippocampal CA1 pyramidal cell under the condition of transient brain ischemia,the present experiment used 24 male Wistar rats aged 9 months and divided them into four groups.Lidocaine and/or furosemide were injected introcerebroventicularlly(I.C.V).Stained with H-E and accounted the CA1 pyramidal cell numbers by computer in each group suggested following findings:Although 5μl of 2% lidocaine was injected I.C.V ,the results indicated lidocaine didn't have any blockade to pyramidal cell injuries in hippocampal CA1 area(P<0.05).In the group medicated with 2.5μl of both 2% lidocaine and 2% furosemide, the results showed that the combined approach had a blockade to injuries of pyramidal cells compared with control group (P<0.01).The present experiment indicates that the combined blockade of lidocaine and furosemide injected I.C.V. to Na+ channel can prevent the injuries from hippocampal neurons owing to ischemia.
, 百拇医药
Key words transient brain ischemia;hippocampus;introcerebroventicularlly;Na+ channel blocker
缺血能够引起动物和人海马CA1区锥体细胞选择性死亡[1,2]。实验证明,跨膜Na+梯度是Na+-Ca2+交换和从细胞外摄取谷氨酸的能量来源,细胞内Na+浓度的改变是引起神经细胞死亡的重要原因之一。在脑缺血、缺O2、中毒等病理条件下,过剩的Na+内流可以引起Na+-Ca2+逆向交换,即Na+出细胞,Ca2+进入细胞内,导致Ca2+在细胞内升高引起细胞的损伤。因此,通过抑制Na+-Ca2+交换,对在脑缺血条件下神经细胞的死亡具有保护作用[4]。Evans等人发现Na+通道阻断剂利多卡因对海马CA1区神经细胞具有保护作用[5]。
, http://www.100md.com
Na+ 通过神经细胞膜具有多样性,如 Na+- K+- 2Cl- 共转运活动是 Na+维持电平衡,进入细胞膜的被动转运方式[6],呋喃苯胺酸作为这种共转运活动的抑制剂,也具有一定保护神经细胞的功能。本实验通过脑室内联合注射利多卡因和呋喃苯胺酸,观察在脑缺血条件下对海马CA1区锥体神经细胞的保护作用。
材料和方法
1 动物及其分组 实验用9月龄雄性Wistar大鼠,体重450~550g。室温25℃。动物管理及操作均按照日本国立精神神经中心动物管理委员会规章进行。实验分为正常组、缺血组、利多卡因组、利多卡因和呋喃苯胺酸复合用药组。每组6只动物,共24只,每只单独笼养。
2 实验方法及缺血模型 动物用戊巴比妥钠腹腔麻醉 (30mg/kg), 剪去头部皮毛,沿头颅正中切开皮肤,分离皮下组织, 暴露 Bregma 线。 正中线右侧 1.2 mm,Bregma 线 0.8 mm 处颅骨钻孔机打开颅骨, 直径为1mm的碳素纤维管插入脑室,深度为4mm。消毒创面,组织固定剂固定插管。半小时后通过蠕动泵缓慢向脑室内注射2.5μl 2%利多卡因;复合用药组注射2.5μl 2%利多卡因,10min后,再注射2.5μl 2%呋喃苯胺酸。手术创面喷洒组织消毒液消毒,外科粘合剂(Aron alph A日本东亚合成株式会社)逐层粘合组织、皮肤。对缺血组、利多卡因组、利多卡因和呋喃苯胺酸复合用药组的动物,1h后,背面朝下,剪去颈部皮毛,沿正中线纵向切开颈部皮肤2cm,气管两侧深后方暴露颈总动脉,左、右两侧同时结扎10min。手术创面消毒后,逐渐粘合组织、皮肤。以上过程均在无菌实验室进行。7d后,乙醚麻醉处死动物,常规灌流,固定,后经石蜡包埋、切片等处理,作H-E染色。 3 统计学处理 每只动物取3张同一平面连续切片,片厚7μm,通过计算机对海马CA1区锥体细胞在1mm范围内计数,得出均数;再计算每组CA1区锥体细胞均数,用 ±s表示。以两组非配对t检验作统计学处理,定义P<0.05为具有显著性标准。
±s表示。以两组非配对t检验作统计学处理,定义P<0.05为具有显著性标准。
, 百拇医药
结果
1 结扎双侧颈总动脉对海马CA1区神经细胞的损伤 正常组海马CA1区锥体细胞数量为218.25±15.50;缺血组(结扎双侧颈总动脉,未给予任何药物)海马CA1区锥体细胞层变薄,细胞排列松散,出现核固缩细胞(图1),有的部位可见神经元集中脱落。缺血组CA1区锥体细胞数量为191.83±12.47,与正常组比较,有显著性差异(P<0.05)。
图1 缺血组海马CA1区锥体细胞层变薄,箭头所示细胞脱落×20
2 利多卡因对脑缺血引起海马CA1区神经元损伤作用 脑室内注射2%利多卡因5μl,CA1区锥体细胞数量为193.36±18.11,与缺血组比较,无显著性差异(P>0.05),形态上主要表现为细胞排列疏松,不规整,仍可见散在核固缩细胞以及细胞在局部的脱落(图2)。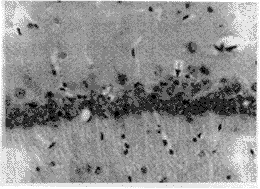
, http://www.100md.com
图2 利多卡因组海马CA1区可见变性锥体细胞 ×20
3 利多卡因和呋喃苯胺酸复合用药对脑缺血海马CA1区锥体神经细胞损伤的保护作用
本组海马CA1区锥体细胞层次分明,边缘清晰,彼此之间连接紧密,大小均匀,核固缩细胞数量稀少。该组CA1区锥体细胞数量为213.74±12.48(图3),与缺血组比较,有显著性差异(P<0.01)。各实验组对缺血海马CA1区细胞影响见附表。
图3 利多卡因和呋喃苯胺酸复合用药组神经元排列整齐,无细胞脱落 ×20
附表 实验各组海马CA1区神经细胞数比较( ±s) 组 别
±s) 组 别
, http://www.100md.com
n
神经细胞数
P值
(1)正常对照组
6
218.25±15.50
(2)阳性对照组
6
191.83±12.47
P1~2<0.01
(3)L组
6
, 百拇医药
193.36±18.11
P2~3 >0.05
(4)L+F组
6
213.74±12.48
P2~4<0.01
P3~4<0.05
注:L,利多卡因;F,呋喃苯胺酸;P1~2,第1组和第2组比较;P2~3,第2组和第3组比较;P2~4,第2组和第4组比较;P3~4,第3组和第4组比较
, 百拇医药 讨论
生理学和生化学实验均证实,一过性脑缺血后的24h,海马CA1区锥体细胞仍然正常,但在1周后神经元变性、死亡,3周后在沙土鼠海马CA1锥体细胞只有5.8%神经元存活[7,8]。
关于缺血引起海马CA1区神经元选择性死亡的机制,目前仍不十分清楚。有人发现脑缺血导致该区域神经细胞染色质浓缩,细胞固缩等细胞凋亡的特征性变化[9]。有人认为由于NMDA受体在CA1区密集分布,缺血所引起的谷氨酸释放,导致其与NMDA受体结合,细胞内Ca2+浓度增加,造成不可逆性的神经细胞死亡,并以此解释CA1区神经元选择性死亡的原因[10]。
谷氨酸作为兴奋性神经递质,存在于脑内兴奋性突触前末梢。在病理条件下其对脑神经元具有毒性作用,称作为兴奋性毒性作用(excitotoxicity)。谷氨酸这种神经兴奋性毒性作用通过Na+内流机制所介导。例如,谷氨酸毒性引起的神经元损伤作用,通过去除细胞外Na+、Cl-可减少细胞的死亡[11,12]。
, http://www.100md.com
跨膜Na+梯度是Na+-Ca2+交换的能量来源,同时也是从细胞外摄取谷氨酸的能量来源。大量实验证实,Na+通道阻断剂能够减少缺血、缺氧引起的神经细胞的损伤。但利多卡因作为Na+通道阻断剂,只能通过非失活性钠离子通道起作用。因此,在脑缺血情况下,是否对海马CA1区锥体细胞具有保护作用,众说莫一。
Na+通过神经细胞膜转运具有多样性。例如,Na+-K+-2Cl共转运活动是Na+通过细胞膜另一种途径。但呋喃苯胺酸在脑缺血情况下,是否对神经细胞具有保护作用,亦不确定,以上实验结果可能与单一应用某种Na+通道阻断剂,仍不能充分改变脑缺血时,Na+转运异常有关。
本实验研究发现,利多卡因和呋喃苯胺酸于脑室内复合用药,具有保护CA1区锥体神经元效应。其机制可能为:①利多卡因具有保护细胞膜稳定性,减少能量消耗的功能。②通过抑制Na+-Ca2+逆向交换,可以减少Ca2+在细胞内沉积,保护神经元。③呋喃苯胺酸和利多卡因的联合用药,还可抑制Na+-K+-2Cl依赖性Na+通道,从而有效抑制Na+介导的谷氨酸毒性作用。但本实验若能同时监测细胞内Na+、Ca2+浓度的变化,则可对用药前后锥体细胞在缺血条件下离子改变机制进行更直接的阐明。
, 百拇医药
*日本笹川医学奖学金资助
参考文献
1 Pulsinelli WA,Brierlu JB, Plum F.Temporal profile of neuronal damage in a model of transient forebrain ischemia.Ann Neurol,1982;11(5)∶491
2 Smith ML,Auer RN, Siesjo BK.The density and distribution of ischemic brain injury in the rat following 2~10 min of forebrain ischemia.Acta Neuropathol,1984;64(4)∶319
3 Fried E,Amorim PG,Chambers G et al.The importance of sodium for anoxic transmission damage in rat hippocampal slices:Mechanisms of protection by lidocaine.J Physiol,1995;489(2)∶557
, http://www.100md.com
4 Stya PK,Waxman SG, Ransom BR.Ionic mechanisms of anoxic injury in mammalian CNS white matter:role of Na+-Ca2+ Exchanger.J Neuroscience, 1992;12(2)∶430
5 Evans DE,Kobrine AL,Grys DC et al.Protective effect of lidocaine in acute cerebral ischemia induced by air embolism.J Neurosurg, 1984;60(2)∶257
6 Minoru Takebayahi,Ariyuke kagaya, Teruo hayashi et al.γ-Amiobutyric acid increases intracellular Ca2+ concentration in cultured cortical neurons:role of Cl- transport.Eur J Pharmacol,1996;297(3)∶137
, 百拇医药
7 Arai H,Passonneau JV, Lust WD.Energy metabolism in delayed neuronal death of CA1 neurons of the hippocampus following transient ischemia in the gerbil.Metab Brain Dis,1986;1(4)∶263
8 Monmaur P,Thomson M,Harzi M.Temporal changes in hippocampal theta activity following twenty minutes of forebrain ischemia in the chronic rat.Brain Res,1986;378(2)∶262
9 MacManus J,Hill I,Preston E et al.Differences in DNA fragmentation following transient cerebral or decapitation ischemia in rats.J Cerebral Blood Flow Metab,1995;15(5)∶728
, http://www.100md.com
10 Monagham DT, Holets VR,Toy DW et al.Anatomical distributions of four pharmacologically distinct 3H-L-Glutamate binding sites.Nature, 1983;306(5939)∶176
11 Boening J,Kassl,Cottrell J.The effect of blocking sodium influx in anoxic damage in the rat hippocampal slice.Neuroscience,1989;33(2)∶263
12 Lucas L,West C,Rigor B et al.Protection against cerebral hypoxia by local anesthetics:A study using brain slices.J Neuroscience Methods,1989;28(1~2)∶47
(1999-01-19收稿 1999-05-12修回), 百拇医药
单位:朱忠良 樊小力 师建华(生理学教研室 西安 710061);李 晖 西安医科大学第一临床医学院妇产科;崔得华田平武 日本国立精神神经中心脱髓鞘病和衰老疾病研究部
关键词:一过性脑缺血;海马;脑室内注射;钠离子通道阻断剂
西安医科大学学报/990304 摘要 实验为观察在脑一过性缺血条件下,Na+通道阻断剂对海马CA1区锥体细胞是否具有保护作用,对9月龄Wistar大鼠进行实验。通过脑室内单独注射利多卡因、利多卡因和呋喃苯胺酸复合应用,用H-E染色方法通过计算机对海马CA1区神经元计数。结果发现,单独注射2%利多卡因5μl,对海马CA1区锥体细胞无保护作用;2%利多卡因和2%呋喃苯胺酸各2.5μl联合应用,与对照组相比,具有显著性差异(P<0.01)。实验结果提示,Na+通道阻断剂联合应用,可能是预防脑缺血引起海马CA1区神经细胞损伤的重要途径之一。
, 百拇医药
THE PROTECTIVE EFFECT OF Na+ CHANNEL BLOCKERS
AGAINST CELL DAMAGE CASUSED BY ISCHEMIA
Zhu Zhongliang, Li Hui, Fan Xiaoli et al
(Department of Physiology)
Abstract In order to observe it blockers of sodium channel obsesses the neuroprotective effect on hippocampal CA1 pyramidal cell under the condition of transient brain ischemia,the present experiment used 24 male Wistar rats aged 9 months and divided them into four groups.Lidocaine and/or furosemide were injected introcerebroventicularlly(I.C.V).Stained with H-E and accounted the CA1 pyramidal cell numbers by computer in each group suggested following findings:Although 5μl of 2% lidocaine was injected I.C.V ,the results indicated lidocaine didn't have any blockade to pyramidal cell injuries in hippocampal CA1 area(P<0.05).In the group medicated with 2.5μl of both 2% lidocaine and 2% furosemide, the results showed that the combined approach had a blockade to injuries of pyramidal cells compared with control group (P<0.01).The present experiment indicates that the combined blockade of lidocaine and furosemide injected I.C.V. to Na+ channel can prevent the injuries from hippocampal neurons owing to ischemia.
, 百拇医药
Key words transient brain ischemia;hippocampus;introcerebroventicularlly;Na+ channel blocker
缺血能够引起动物和人海马CA1区锥体细胞选择性死亡[1,2]。实验证明,跨膜Na+梯度是Na+-Ca2+交换和从细胞外摄取谷氨酸的能量来源,细胞内Na+浓度的改变是引起神经细胞死亡的重要原因之一。在脑缺血、缺O2、中毒等病理条件下,过剩的Na+内流可以引起Na+-Ca2+逆向交换,即Na+出细胞,Ca2+进入细胞内,导致Ca2+在细胞内升高引起细胞的损伤。因此,通过抑制Na+-Ca2+交换,对在脑缺血条件下神经细胞的死亡具有保护作用[4]。Evans等人发现Na+通道阻断剂利多卡因对海马CA1区神经细胞具有保护作用[5]。
, http://www.100md.com
Na+ 通过神经细胞膜具有多样性,如 Na+- K+- 2Cl- 共转运活动是 Na+维持电平衡,进入细胞膜的被动转运方式[6],呋喃苯胺酸作为这种共转运活动的抑制剂,也具有一定保护神经细胞的功能。本实验通过脑室内联合注射利多卡因和呋喃苯胺酸,观察在脑缺血条件下对海马CA1区锥体神经细胞的保护作用。
材料和方法
1 动物及其分组 实验用9月龄雄性Wistar大鼠,体重450~550g。室温25℃。动物管理及操作均按照日本国立精神神经中心动物管理委员会规章进行。实验分为正常组、缺血组、利多卡因组、利多卡因和呋喃苯胺酸复合用药组。每组6只动物,共24只,每只单独笼养。
2 实验方法及缺血模型 动物用戊巴比妥钠腹腔麻醉 (30mg/kg), 剪去头部皮毛,沿头颅正中切开皮肤,分离皮下组织, 暴露 Bregma 线。 正中线右侧 1.2 mm,Bregma 线 0.8 mm 处颅骨钻孔机打开颅骨, 直径为1mm的碳素纤维管插入脑室,深度为4mm。消毒创面,组织固定剂固定插管。半小时后通过蠕动泵缓慢向脑室内注射2.5μl 2%利多卡因;复合用药组注射2.5μl 2%利多卡因,10min后,再注射2.5μl 2%呋喃苯胺酸。手术创面喷洒组织消毒液消毒,外科粘合剂(Aron alph A日本东亚合成株式会社)逐层粘合组织、皮肤。对缺血组、利多卡因组、利多卡因和呋喃苯胺酸复合用药组的动物,1h后,背面朝下,剪去颈部皮毛,沿正中线纵向切开颈部皮肤2cm,气管两侧深后方暴露颈总动脉,左、右两侧同时结扎10min。手术创面消毒后,逐渐粘合组织、皮肤。以上过程均在无菌实验室进行。7d后,乙醚麻醉处死动物,常规灌流,固定,后经石蜡包埋、切片等处理,作H-E染色。 3 统计学处理 每只动物取3张同一平面连续切片,片厚7μm,通过计算机对海马CA1区锥体细胞在1mm范围内计数,得出均数;再计算每组CA1区锥体细胞均数,用
 ±s表示。以两组非配对t检验作统计学处理,定义P<0.05为具有显著性标准。
±s表示。以两组非配对t检验作统计学处理,定义P<0.05为具有显著性标准。, 百拇医药
结果
1 结扎双侧颈总动脉对海马CA1区神经细胞的损伤 正常组海马CA1区锥体细胞数量为218.25±15.50;缺血组(结扎双侧颈总动脉,未给予任何药物)海马CA1区锥体细胞层变薄,细胞排列松散,出现核固缩细胞(图1),有的部位可见神经元集中脱落。缺血组CA1区锥体细胞数量为191.83±12.47,与正常组比较,有显著性差异(P<0.05)。

图1 缺血组海马CA1区锥体细胞层变薄,箭头所示细胞脱落×20
2 利多卡因对脑缺血引起海马CA1区神经元损伤作用 脑室内注射2%利多卡因5μl,CA1区锥体细胞数量为193.36±18.11,与缺血组比较,无显著性差异(P>0.05),形态上主要表现为细胞排列疏松,不规整,仍可见散在核固缩细胞以及细胞在局部的脱落(图2)。

, http://www.100md.com
图2 利多卡因组海马CA1区可见变性锥体细胞 ×20
3 利多卡因和呋喃苯胺酸复合用药对脑缺血海马CA1区锥体神经细胞损伤的保护作用
本组海马CA1区锥体细胞层次分明,边缘清晰,彼此之间连接紧密,大小均匀,核固缩细胞数量稀少。该组CA1区锥体细胞数量为213.74±12.48(图3),与缺血组比较,有显著性差异(P<0.01)。各实验组对缺血海马CA1区细胞影响见附表。

图3 利多卡因和呋喃苯胺酸复合用药组神经元排列整齐,无细胞脱落 ×20
附表 实验各组海马CA1区神经细胞数比较(
 ±s) 组 别
±s) 组 别, http://www.100md.com
n
神经细胞数
P值
(1)正常对照组
6
218.25±15.50
(2)阳性对照组
6
191.83±12.47
P1~2<0.01
(3)L组
6
, 百拇医药
193.36±18.11
P2~3 >0.05
(4)L+F组
6
213.74±12.48
P2~4<0.01
P3~4<0.05
注:L,利多卡因;F,呋喃苯胺酸;P1~2,第1组和第2组比较;P2~3,第2组和第3组比较;P2~4,第2组和第4组比较;P3~4,第3组和第4组比较
, 百拇医药 讨论
生理学和生化学实验均证实,一过性脑缺血后的24h,海马CA1区锥体细胞仍然正常,但在1周后神经元变性、死亡,3周后在沙土鼠海马CA1锥体细胞只有5.8%神经元存活[7,8]。
关于缺血引起海马CA1区神经元选择性死亡的机制,目前仍不十分清楚。有人发现脑缺血导致该区域神经细胞染色质浓缩,细胞固缩等细胞凋亡的特征性变化[9]。有人认为由于NMDA受体在CA1区密集分布,缺血所引起的谷氨酸释放,导致其与NMDA受体结合,细胞内Ca2+浓度增加,造成不可逆性的神经细胞死亡,并以此解释CA1区神经元选择性死亡的原因[10]。
谷氨酸作为兴奋性神经递质,存在于脑内兴奋性突触前末梢。在病理条件下其对脑神经元具有毒性作用,称作为兴奋性毒性作用(excitotoxicity)。谷氨酸这种神经兴奋性毒性作用通过Na+内流机制所介导。例如,谷氨酸毒性引起的神经元损伤作用,通过去除细胞外Na+、Cl-可减少细胞的死亡[11,12]。
, http://www.100md.com
跨膜Na+梯度是Na+-Ca2+交换的能量来源,同时也是从细胞外摄取谷氨酸的能量来源。大量实验证实,Na+通道阻断剂能够减少缺血、缺氧引起的神经细胞的损伤。但利多卡因作为Na+通道阻断剂,只能通过非失活性钠离子通道起作用。因此,在脑缺血情况下,是否对海马CA1区锥体细胞具有保护作用,众说莫一。
Na+通过神经细胞膜转运具有多样性。例如,Na+-K+-2Cl共转运活动是Na+通过细胞膜另一种途径。但呋喃苯胺酸在脑缺血情况下,是否对神经细胞具有保护作用,亦不确定,以上实验结果可能与单一应用某种Na+通道阻断剂,仍不能充分改变脑缺血时,Na+转运异常有关。
本实验研究发现,利多卡因和呋喃苯胺酸于脑室内复合用药,具有保护CA1区锥体神经元效应。其机制可能为:①利多卡因具有保护细胞膜稳定性,减少能量消耗的功能。②通过抑制Na+-Ca2+逆向交换,可以减少Ca2+在细胞内沉积,保护神经元。③呋喃苯胺酸和利多卡因的联合用药,还可抑制Na+-K+-2Cl依赖性Na+通道,从而有效抑制Na+介导的谷氨酸毒性作用。但本实验若能同时监测细胞内Na+、Ca2+浓度的变化,则可对用药前后锥体细胞在缺血条件下离子改变机制进行更直接的阐明。
, 百拇医药
*日本笹川医学奖学金资助
参考文献
1 Pulsinelli WA,Brierlu JB, Plum F.Temporal profile of neuronal damage in a model of transient forebrain ischemia.Ann Neurol,1982;11(5)∶491
2 Smith ML,Auer RN, Siesjo BK.The density and distribution of ischemic brain injury in the rat following 2~10 min of forebrain ischemia.Acta Neuropathol,1984;64(4)∶319
3 Fried E,Amorim PG,Chambers G et al.The importance of sodium for anoxic transmission damage in rat hippocampal slices:Mechanisms of protection by lidocaine.J Physiol,1995;489(2)∶557
, http://www.100md.com
4 Stya PK,Waxman SG, Ransom BR.Ionic mechanisms of anoxic injury in mammalian CNS white matter:role of Na+-Ca2+ Exchanger.J Neuroscience, 1992;12(2)∶430
5 Evans DE,Kobrine AL,Grys DC et al.Protective effect of lidocaine in acute cerebral ischemia induced by air embolism.J Neurosurg, 1984;60(2)∶257
6 Minoru Takebayahi,Ariyuke kagaya, Teruo hayashi et al.γ-Amiobutyric acid increases intracellular Ca2+ concentration in cultured cortical neurons:role of Cl- transport.Eur J Pharmacol,1996;297(3)∶137
, 百拇医药
7 Arai H,Passonneau JV, Lust WD.Energy metabolism in delayed neuronal death of CA1 neurons of the hippocampus following transient ischemia in the gerbil.Metab Brain Dis,1986;1(4)∶263
8 Monmaur P,Thomson M,Harzi M.Temporal changes in hippocampal theta activity following twenty minutes of forebrain ischemia in the chronic rat.Brain Res,1986;378(2)∶262
9 MacManus J,Hill I,Preston E et al.Differences in DNA fragmentation following transient cerebral or decapitation ischemia in rats.J Cerebral Blood Flow Metab,1995;15(5)∶728
, http://www.100md.com
10 Monagham DT, Holets VR,Toy DW et al.Anatomical distributions of four pharmacologically distinct 3H-L-Glutamate binding sites.Nature, 1983;306(5939)∶176
11 Boening J,Kassl,Cottrell J.The effect of blocking sodium influx in anoxic damage in the rat hippocampal slice.Neuroscience,1989;33(2)∶263
12 Lucas L,West C,Rigor B et al.Protection against cerebral hypoxia by local anesthetics:A study using brain slices.J Neuroscience Methods,1989;28(1~2)∶47
(1999-01-19收稿 1999-05-12修回), 百拇医药