转化生长因子β1对鼠造血祖细胞产生树突状细胞的调控作用
作者:张毅 陈磐 张雁云 张学光 原田明久 松岛纲治
单位:215007 江苏,苏州医学院免疫学教研室(张毅、张学光、张雁云);苏州市第二人民医院(陈磐);日本东京大学医学部分子预防医学教研室(原田明久、松岛纲治)
关键词:转化生长因子β1;树突状细胞
中华医学杂志990305 【摘要】 目的 研究转化生长因子-β1(TGF-β1)对造血祖细胞(HPC)产生树突状细胞(DC)的调控作用及其分子机理。方法 分离高纯度小鼠骨髓Lin、C-kit+、HPC,经粒细胞集落刺激因子(GM-CSF)、干细胞因子(SCF)和肿瘤坏死因子(TNFα)培养,诱导产生DC。采用流式细胞仪、逆转录多聚酶链反应(RT-PCR)和同种异基因混合淋巴细胞反应(Allo-MLR),分析TGF-β1对DC产生的调节作用及其分子机理。结果 TGF-β1显著抑制DC前体细胞的产生和成熟DC的分化,同时TGF-β1抑制主组织相容性抗原(MHC-Ⅱ)类抗原活化转录因子(CIITA)基因的转录和MHC-Ⅱ类抗原与协同刺激分子CD86抗原的表达。结论 TGF-β1介导的免疫抑制作用与其抑制DC的分化及功能成熟相关。
, http://www.100md.com
Transforming growth factor-β1 inhibits the generation of dendritic cells from murine hematopoietic progenitor cells in vitro ZHANG Yi*, CHEN Pan, ZHANG Yanyun, et al. * Immunology Research Unit, Suzhou Medical College, P.R. China; No. People′s Hospital of Suzhou, P.R. China; Department of Molecular Preventive Medicine, School of Medicine, The University of Tokyo, Japan
【Abstract】 Objective To investigate the regulatory effect of transforming growth factor-β1 (TGF-β1) on the generation of dendritic cells (DCs) from hematopoietic progenitor cells (HPCs) and its cellular and molecular mechnisms.Methods Murine bone marrow derived-Lin c-kit+ HPCs were isolated by a cell sorter and cultured in the presence of granulocyte-macrophage colony-stimulating factor (GM-CSF), stem cell factor (SCF), tumor necrosis factor α(TNFα) and TGF-β1. The generation of DC precursors and mature DCs and their phenotypes were analyzed by a cell sorter, reverse transcription-polymerase chain reaction (RT-PCR), and allogenic mixed lymphocyte reaction (MLR).Results TGF-β1 could significantly inhibit the generation of DC precursors at day 6 and mature DCs at day 12 from murine Lin c-kit+ HPCs stimulated with GM-CSF + SCF + TNFα or GM-CSF + SCF. Moreover, TGF-β1 markedly suppressed the expression of antigen peresenting molecule Ia and co-stimulatory molecule CD86 on the surface of cultrued Lin c-kit+ HPCs. Examination of RT-PCR showed that TGF-β1 could also inhibit the expression of MHC class Ⅱ trans-activator (CTIIA) mRNA, which encodes a transcriptional factor to strictly control the expression of MHC class Ⅱ antigens in the cultured cells. Conclusion Our results suggest that TGF-β1 is an inhibitory cytokine for the generation of DC precursors and maturation of DC from HPCs, which may account for the cellular mechanisms of TGF-β1-mediated immuno-suppressive functions in vivo and in vitro.
, 百拇医药
【Key words】 Transforming growth factor beta Dendritic cell
(Natl Med J China, 1999,79:178-180)
树突状细胞(DC)作为专职性抗原递呈细胞,是调控免疫应答的中心环节。DC来源于骨髓造血祖细胞(HPC),其分化发育过程可分为3个不同阶段:(1)DC祖细胞;(2)不成熟DC前体细胞;(3)成熟DC。成熟DC表面表达了大量组织相容性抗原(MHC-Ⅱ)类抗原和协同刺激分子如CD40、CD80和CD86,是DC递呈抗原并激活T淋巴细胞和调控各类免疫应答的分子基础[1]。
转化生长因子(TGF-β1)由多种细胞产生的有多样性生物学功能的细胞因子[2,3]。TGF-β1基因缺陷型小鼠体内免疫细胞表面MHC-Ⅱ类抗原表达显著增强,并发生了多器官多灶性炎症反应和各类自身免疫性疾病[2]。然而,在TGF-β1和MHC-Ⅱ基因双缺陷型小鼠体内,上述多灶性炎症反应和自身免疫性疾病不再发生,提示TGF-β1可调节MHC-Ⅱ类抗原的表达,并由此介导了各种免疫抑制作用[3]。由于DC表达高水平的MHC-Ⅱ类抗原,我们推测,TGF-β1很可能参与调控DC的分化、生长和功能成熟[4]。
, http://www.100md.com
我们利用已建立的分化模式[5,6],研究了TGF-β1对HPC分化发育为成熟DC的调节作用。
材料与方法
1.细胞因子与抗体: 重组小鼠干细胞因子(SCF)、粒细胞集落刺激因子(GM-CSF)和大鼠抗小鼠c-kit单克隆抗体(mAb,ACK-2)由须田哲央博士(日本Toray公司)惠赠;小鼠肿瘤坏死因子(TNFα)为本室自制;人TGF-β1购自美国R&D公司。其他各类mAbs和标记抗体均购自美国PharMingen公司。
2.小鼠Lin、c-kit+、HPC的分离和培养:C57BL/6小鼠购自日本Clea公司。按文献[5,6]分离和培养小鼠骨髓Lin、c-kit+、HPC。
, 百拇医药
3.免疫荧光分析:按文献[6,7]进行,采用EPICS-ELITE流式细胞仪(美国Coulter公司),分析培养6天CD11b-/dull、CD11c+、CD11b+hi、CD11c+、DC前体细胞和培养12天时Ia+、CD86+、成熟DC的产生及相关表型特征。
4.逆转录-聚合酶链反应(RT-PCR):采用RNA20LTMB(美国Biotech. Lab公司)试剂盒抽取总RNA,定量后取200 ng总RNA,经RT-PCR试剂盒(日本Takara公司)逆转录合成单链cDNA,再采用CIITA cDNA特异性引物(5′-GGTACGGATGATAATGAGGT-3′)经PCR,94 ℃30秒;55 ℃1.5分钟;72 ℃1分钟,25个循环后,获PCR产物,1.5%琼脂糖电泳后,溴乙锭染色结果[7]。
, 百拇医药 5.Allo-MLR: 按文献[4,5]进行。小鼠T淋巴细胞由Balb/c小鼠脾脏分离获得。
结 果
1.TGF-β1抑制Lin、c-kit+、HPC产生CD11b-/dull、CD11c+、CD11b+hi、CD11c+、DC前体细胞:经6天培养,GM-CSF+SCF+TNFα可刺激Lin、C-kit+、HPC产生CD11b-/dull、CD11c+(10.0±3.5)%和CD11b+hi、CD11c+(26.0±5.6)%二类不同特性的DC前体细胞,与报道相符[7]。在相同培养条件下,加入TGF-β1(2.5 ng/ml)时,显著抑制CD11c阳性细胞的产生,上述二类DC前体细胞的百分率分别降至(2.5±1.5)%和(5.0±3.5)%,TGF-β1最大抑制效应剂量为2.5 ng/ml。
, http://www.100md.com
培养6天后,TGF-β1可显著抑制GM-CSF+SCF+TNFα诱导的LinC-kit+HPC表达Ia和CD86抗原,Ia+CD86+细胞由TGF-β1未加入组的(7.8±1.2)%显著减少至(2.5±1.1)%。表明TGF-β1在抑制DC前体细胞产生的同时还可抑制MHC-II类抗原和协同刺激分子的表达。
2.TGF-β1抑制Lin、C-kit+、HPC的CIITA基因的转录:MHC-Ⅱ类抗原的表达受CIITA的严格控制[8]。培养6天后,GM-CSF+SCF+TNFα或GM-CSF+SCF可活化Lin、C-kit+、HPC转录高水平的CIITA mRNA,相同培养条件下加入TGF-β1后,显著抑制了HPC转录CIITA基因(图1)。
, http://www.100md.com
1.DNA marker; 2. GM-CSF;3.GM-CSF+TGF-β1;4.GM-CSF+TNFα;5.GM-CSF+TNFα+TGF-β1
图1 TGF-β1抑制Lin-c-kit+HPC转录CIITA mRNA
3.TGF-β1抑制Lin、C-kit+、HPC产生成熟DC:TGF-β1共培养时,Ia+CD86+成熟DC的产生被显著抑制。尽管GM-CSF+SCF亦可刺激Lin、C-kit+、HPC产生少量的DC,加入TGF-β1后则完全抑制了改培养条件下成熟DC的产生(图2)。TGF-β1尚可抑制GM-CSF+SCF+TNFα刺激的Lin、c-kit+、HPC的诱导Allo-MLR的能力(图3)。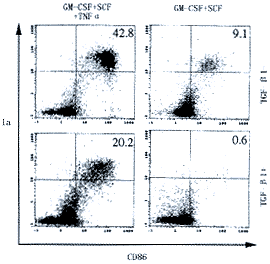
, http://www.100md.com
各组细胞因子培养12天后,用流式细胞仪测定培养中Ia+CD86+成熟细胞百分率
图2 TGF-β1抑制Lin-c-kit+HPC分化为Ia+CD86+成熟DC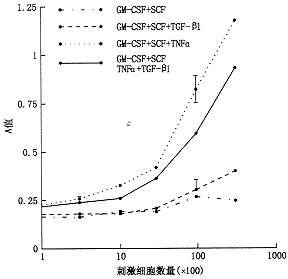
各组细胞因子培养12天时,采用MTT法测定其刺激Allo-MLR的能力
图3 TGF-β1抑制Lin-C-kit+HPC产生功能成熟的DC
讨 论
, http://www.100md.com
许多细胞因子可调控DC的分化、生长和发育。SCF+Flt3配基可刺激DC祖细胞的生长;GM-CSF和白细胞介素3(IL-3)可诱导不成熟DC前体细胞的分化与增殖;而TNFα和CD40配基则增强并诱导DC前体细胞的产生及成熟DC的分化[1,4,5]。然而,与其他骨髓来源的白细胞相比,DC是体内数量最少的一类白细胞,很明显,负性调控因子起着重要的作用。我们的研究结果显示,TGF-β1所介导的免疫抑制作用与其抑制DC前体细胞的产生及功能成熟相关。
迄今为止,TGF-β1抑制MHC-Ⅱ类抗原表达的分子机理尚不清楚。CIITA基因缺陷型小鼠体内免疫细胞表面的MHC-Ⅱ类抗原缺陷,证实CIITA是调控MHC-Ⅱ类抗原不可缺少的核蛋白转录因子[6]。本研究表明,TGF-β1可显著抑制CIITA基因的转录,并由此调控MHC-Ⅱ抗原在DC及其前体细胞表面的表达。由于DC及其表达的MHC-Ⅱ类抗原在胸腺细胞的阳性选择、阴性选择和成熟CD+4T淋巴细胞发育过程中起着重要的作用[1]。
, http://www.100md.com
近年研究显示,小鼠心脏抑制动物模型中,TGF-β1转基因小鼠体内植入的同种异基因心脏的存活期显著延长[9]。我们的研究表明,TGF-β1可完全抑制GM-CSF诱导HPC产生成熟DC及其表达的抗原递呈分子和协同刺激分子(包括CD40抗原,数据未列),这很可能是TGF-β1抑制宿主抗移植物排斥反应的机理之一。
值得注意的是,许多肿瘤细胞,如前列腺癌和直肠癌等,可产生高水平的TGF-β1[8,9]。现已发现直肠癌组织中浸润的DC表面缺乏CD86协同刺激分子,功能上处于失活状态而不能激活T淋巴细胞[8]。这与我们体外观察到TGF-β1可抑制DC分化发育与功能成熟的结果完全吻合。
参考文献
1 Banchereau J, And RM. Steinman. Dendritic cells and the control of immunity. Nature. 1998,392:245-252.
, 百拇医药
2 Geiser A G, Letterio J J, Kulkarni A B, et al. Transforming growth factor bata 1 (TGF-beta 1) controls expression of major histocompatibility gene in the postnatal mouse: aberrant histocompatibility antigen expresion in the pathogenesis of the TGF-beta 1 null mouse phenotype. Pro Natl Acad sci USA. 1993, 90:9944-9948.
3 Letterio J J, Geiser A G, Kulkarni A B, et al. Autoimmunity associated with TGF-beta 1-deficient in mice is dependent on MHC class II antigen expression. J Clin Inest, 1996, 98:2109-2119.
, 百拇医药
4 Zhang Y, Mukaida N, Wang J B, et al. Induction of dendritic cell differentiation by grnulocyte-macrophage colony-stimulating factor, stem cell factor, and tumor necrosis factor α in vitro from lineage phenotypes negtive c-kit+ murine hematopoietic progenitor. Cells. 1997, 90: 4842-4853.
5 Zhang Y, Harada A, Wang J B, et al. Bifurcated dendritic cell differentiation in vitro from murine lineage phenotype negative c-kit+ bone marrow hematopoietic progenitor. Cells. 1998, 92:118-128.
, http://www.100md.com
6 Chang, CH, Guerder S, Hong SC, et al. Mice Lacking the MHC class II transactivator (CIITA) show tissue-specific impairement of MHC class Ⅱ expression. Immunity, 1996, 4:167-178.
7 Qin L, Ding Y, Bromberg JS. Gene trasfer of transforming growth factor-beta 1 prolongs murine cardiac allograft survival by inhibiting cell-mediated immunity. Mu Gene Ther. 1997, 7:1981-1988.
8 Chaux P, Moutet M, Faivre J, et al. Inflammatory cells infiltrated human colorectal carcinomas express HLA class II but not B7-1 and B7-2 costimulatory molecules of the T-cell activation. Lab Invest. 1996, 74:975-983.
9 Park JA, Wang E, Kurt RA, et al. Expression of an antisense transforming growth factor-bata 1 transgene reduces tumorigenicity of EMT6 mammary tumor cells. Can Gene Thera. 1997,4:42-50.
(收稿:1998-07-20 修回:1998-10-12), 百拇医药
单位:215007 江苏,苏州医学院免疫学教研室(张毅、张学光、张雁云);苏州市第二人民医院(陈磐);日本东京大学医学部分子预防医学教研室(原田明久、松岛纲治)
关键词:转化生长因子β1;树突状细胞
中华医学杂志990305 【摘要】 目的 研究转化生长因子-β1(TGF-β1)对造血祖细胞(HPC)产生树突状细胞(DC)的调控作用及其分子机理。方法 分离高纯度小鼠骨髓Lin、C-kit+、HPC,经粒细胞集落刺激因子(GM-CSF)、干细胞因子(SCF)和肿瘤坏死因子(TNFα)培养,诱导产生DC。采用流式细胞仪、逆转录多聚酶链反应(RT-PCR)和同种异基因混合淋巴细胞反应(Allo-MLR),分析TGF-β1对DC产生的调节作用及其分子机理。结果 TGF-β1显著抑制DC前体细胞的产生和成熟DC的分化,同时TGF-β1抑制主组织相容性抗原(MHC-Ⅱ)类抗原活化转录因子(CIITA)基因的转录和MHC-Ⅱ类抗原与协同刺激分子CD86抗原的表达。结论 TGF-β1介导的免疫抑制作用与其抑制DC的分化及功能成熟相关。
, http://www.100md.com
Transforming growth factor-β1 inhibits the generation of dendritic cells from murine hematopoietic progenitor cells in vitro ZHANG Yi*, CHEN Pan, ZHANG Yanyun, et al. * Immunology Research Unit, Suzhou Medical College, P.R. China; No. People′s Hospital of Suzhou, P.R. China; Department of Molecular Preventive Medicine, School of Medicine, The University of Tokyo, Japan
【Abstract】 Objective To investigate the regulatory effect of transforming growth factor-β1 (TGF-β1) on the generation of dendritic cells (DCs) from hematopoietic progenitor cells (HPCs) and its cellular and molecular mechnisms.Methods Murine bone marrow derived-Lin c-kit+ HPCs were isolated by a cell sorter and cultured in the presence of granulocyte-macrophage colony-stimulating factor (GM-CSF), stem cell factor (SCF), tumor necrosis factor α(TNFα) and TGF-β1. The generation of DC precursors and mature DCs and their phenotypes were analyzed by a cell sorter, reverse transcription-polymerase chain reaction (RT-PCR), and allogenic mixed lymphocyte reaction (MLR).Results TGF-β1 could significantly inhibit the generation of DC precursors at day 6 and mature DCs at day 12 from murine Lin c-kit+ HPCs stimulated with GM-CSF + SCF + TNFα or GM-CSF + SCF. Moreover, TGF-β1 markedly suppressed the expression of antigen peresenting molecule Ia and co-stimulatory molecule CD86 on the surface of cultrued Lin c-kit+ HPCs. Examination of RT-PCR showed that TGF-β1 could also inhibit the expression of MHC class Ⅱ trans-activator (CTIIA) mRNA, which encodes a transcriptional factor to strictly control the expression of MHC class Ⅱ antigens in the cultured cells. Conclusion Our results suggest that TGF-β1 is an inhibitory cytokine for the generation of DC precursors and maturation of DC from HPCs, which may account for the cellular mechanisms of TGF-β1-mediated immuno-suppressive functions in vivo and in vitro.
, 百拇医药
【Key words】 Transforming growth factor beta Dendritic cell
(Natl Med J China, 1999,79:178-180)
树突状细胞(DC)作为专职性抗原递呈细胞,是调控免疫应答的中心环节。DC来源于骨髓造血祖细胞(HPC),其分化发育过程可分为3个不同阶段:(1)DC祖细胞;(2)不成熟DC前体细胞;(3)成熟DC。成熟DC表面表达了大量组织相容性抗原(MHC-Ⅱ)类抗原和协同刺激分子如CD40、CD80和CD86,是DC递呈抗原并激活T淋巴细胞和调控各类免疫应答的分子基础[1]。
转化生长因子(TGF-β1)由多种细胞产生的有多样性生物学功能的细胞因子[2,3]。TGF-β1基因缺陷型小鼠体内免疫细胞表面MHC-Ⅱ类抗原表达显著增强,并发生了多器官多灶性炎症反应和各类自身免疫性疾病[2]。然而,在TGF-β1和MHC-Ⅱ基因双缺陷型小鼠体内,上述多灶性炎症反应和自身免疫性疾病不再发生,提示TGF-β1可调节MHC-Ⅱ类抗原的表达,并由此介导了各种免疫抑制作用[3]。由于DC表达高水平的MHC-Ⅱ类抗原,我们推测,TGF-β1很可能参与调控DC的分化、生长和功能成熟[4]。
, http://www.100md.com
我们利用已建立的分化模式[5,6],研究了TGF-β1对HPC分化发育为成熟DC的调节作用。
材料与方法
1.细胞因子与抗体: 重组小鼠干细胞因子(SCF)、粒细胞集落刺激因子(GM-CSF)和大鼠抗小鼠c-kit单克隆抗体(mAb,ACK-2)由须田哲央博士(日本Toray公司)惠赠;小鼠肿瘤坏死因子(TNFα)为本室自制;人TGF-β1购自美国R&D公司。其他各类mAbs和标记抗体均购自美国PharMingen公司。
2.小鼠Lin、c-kit+、HPC的分离和培养:C57BL/6小鼠购自日本Clea公司。按文献[5,6]分离和培养小鼠骨髓Lin、c-kit+、HPC。
, 百拇医药
3.免疫荧光分析:按文献[6,7]进行,采用EPICS-ELITE流式细胞仪(美国Coulter公司),分析培养6天CD11b-/dull、CD11c+、CD11b+hi、CD11c+、DC前体细胞和培养12天时Ia+、CD86+、成熟DC的产生及相关表型特征。
4.逆转录-聚合酶链反应(RT-PCR):采用RNA20LTMB(美国Biotech. Lab公司)试剂盒抽取总RNA,定量后取200 ng总RNA,经RT-PCR试剂盒(日本Takara公司)逆转录合成单链cDNA,再采用CIITA cDNA特异性引物(5′-GGTACGGATGATAATGAGGT-3′)经PCR,94 ℃30秒;55 ℃1.5分钟;72 ℃1分钟,25个循环后,获PCR产物,1.5%琼脂糖电泳后,溴乙锭染色结果[7]。
, 百拇医药 5.Allo-MLR: 按文献[4,5]进行。小鼠T淋巴细胞由Balb/c小鼠脾脏分离获得。
结 果
1.TGF-β1抑制Lin、c-kit+、HPC产生CD11b-/dull、CD11c+、CD11b+hi、CD11c+、DC前体细胞:经6天培养,GM-CSF+SCF+TNFα可刺激Lin、C-kit+、HPC产生CD11b-/dull、CD11c+(10.0±3.5)%和CD11b+hi、CD11c+(26.0±5.6)%二类不同特性的DC前体细胞,与报道相符[7]。在相同培养条件下,加入TGF-β1(2.5 ng/ml)时,显著抑制CD11c阳性细胞的产生,上述二类DC前体细胞的百分率分别降至(2.5±1.5)%和(5.0±3.5)%,TGF-β1最大抑制效应剂量为2.5 ng/ml。
, http://www.100md.com
培养6天后,TGF-β1可显著抑制GM-CSF+SCF+TNFα诱导的LinC-kit+HPC表达Ia和CD86抗原,Ia+CD86+细胞由TGF-β1未加入组的(7.8±1.2)%显著减少至(2.5±1.1)%。表明TGF-β1在抑制DC前体细胞产生的同时还可抑制MHC-II类抗原和协同刺激分子的表达。
2.TGF-β1抑制Lin、C-kit+、HPC的CIITA基因的转录:MHC-Ⅱ类抗原的表达受CIITA的严格控制[8]。培养6天后,GM-CSF+SCF+TNFα或GM-CSF+SCF可活化Lin、C-kit+、HPC转录高水平的CIITA mRNA,相同培养条件下加入TGF-β1后,显著抑制了HPC转录CIITA基因(图1)。

, http://www.100md.com
1.DNA marker; 2. GM-CSF;3.GM-CSF+TGF-β1;4.GM-CSF+TNFα;5.GM-CSF+TNFα+TGF-β1
图1 TGF-β1抑制Lin-c-kit+HPC转录CIITA mRNA
3.TGF-β1抑制Lin、C-kit+、HPC产生成熟DC:TGF-β1共培养时,Ia+CD86+成熟DC的产生被显著抑制。尽管GM-CSF+SCF亦可刺激Lin、C-kit+、HPC产生少量的DC,加入TGF-β1后则完全抑制了改培养条件下成熟DC的产生(图2)。TGF-β1尚可抑制GM-CSF+SCF+TNFα刺激的Lin、c-kit+、HPC的诱导Allo-MLR的能力(图3)。

, http://www.100md.com
各组细胞因子培养12天后,用流式细胞仪测定培养中Ia+CD86+成熟细胞百分率
图2 TGF-β1抑制Lin-c-kit+HPC分化为Ia+CD86+成熟DC

各组细胞因子培养12天时,采用MTT法测定其刺激Allo-MLR的能力
图3 TGF-β1抑制Lin-C-kit+HPC产生功能成熟的DC
讨 论
, http://www.100md.com
许多细胞因子可调控DC的分化、生长和发育。SCF+Flt3配基可刺激DC祖细胞的生长;GM-CSF和白细胞介素3(IL-3)可诱导不成熟DC前体细胞的分化与增殖;而TNFα和CD40配基则增强并诱导DC前体细胞的产生及成熟DC的分化[1,4,5]。然而,与其他骨髓来源的白细胞相比,DC是体内数量最少的一类白细胞,很明显,负性调控因子起着重要的作用。我们的研究结果显示,TGF-β1所介导的免疫抑制作用与其抑制DC前体细胞的产生及功能成熟相关。
迄今为止,TGF-β1抑制MHC-Ⅱ类抗原表达的分子机理尚不清楚。CIITA基因缺陷型小鼠体内免疫细胞表面的MHC-Ⅱ类抗原缺陷,证实CIITA是调控MHC-Ⅱ类抗原不可缺少的核蛋白转录因子[6]。本研究表明,TGF-β1可显著抑制CIITA基因的转录,并由此调控MHC-Ⅱ抗原在DC及其前体细胞表面的表达。由于DC及其表达的MHC-Ⅱ类抗原在胸腺细胞的阳性选择、阴性选择和成熟CD+4T淋巴细胞发育过程中起着重要的作用[1]。
, http://www.100md.com
近年研究显示,小鼠心脏抑制动物模型中,TGF-β1转基因小鼠体内植入的同种异基因心脏的存活期显著延长[9]。我们的研究表明,TGF-β1可完全抑制GM-CSF诱导HPC产生成熟DC及其表达的抗原递呈分子和协同刺激分子(包括CD40抗原,数据未列),这很可能是TGF-β1抑制宿主抗移植物排斥反应的机理之一。
值得注意的是,许多肿瘤细胞,如前列腺癌和直肠癌等,可产生高水平的TGF-β1[8,9]。现已发现直肠癌组织中浸润的DC表面缺乏CD86协同刺激分子,功能上处于失活状态而不能激活T淋巴细胞[8]。这与我们体外观察到TGF-β1可抑制DC分化发育与功能成熟的结果完全吻合。
参考文献
1 Banchereau J, And RM. Steinman. Dendritic cells and the control of immunity. Nature. 1998,392:245-252.
, 百拇医药
2 Geiser A G, Letterio J J, Kulkarni A B, et al. Transforming growth factor bata 1 (TGF-beta 1) controls expression of major histocompatibility gene in the postnatal mouse: aberrant histocompatibility antigen expresion in the pathogenesis of the TGF-beta 1 null mouse phenotype. Pro Natl Acad sci USA. 1993, 90:9944-9948.
3 Letterio J J, Geiser A G, Kulkarni A B, et al. Autoimmunity associated with TGF-beta 1-deficient in mice is dependent on MHC class II antigen expression. J Clin Inest, 1996, 98:2109-2119.
, 百拇医药
4 Zhang Y, Mukaida N, Wang J B, et al. Induction of dendritic cell differentiation by grnulocyte-macrophage colony-stimulating factor, stem cell factor, and tumor necrosis factor α in vitro from lineage phenotypes negtive c-kit+ murine hematopoietic progenitor. Cells. 1997, 90: 4842-4853.
5 Zhang Y, Harada A, Wang J B, et al. Bifurcated dendritic cell differentiation in vitro from murine lineage phenotype negative c-kit+ bone marrow hematopoietic progenitor. Cells. 1998, 92:118-128.
, http://www.100md.com
6 Chang, CH, Guerder S, Hong SC, et al. Mice Lacking the MHC class II transactivator (CIITA) show tissue-specific impairement of MHC class Ⅱ expression. Immunity, 1996, 4:167-178.
7 Qin L, Ding Y, Bromberg JS. Gene trasfer of transforming growth factor-beta 1 prolongs murine cardiac allograft survival by inhibiting cell-mediated immunity. Mu Gene Ther. 1997, 7:1981-1988.
8 Chaux P, Moutet M, Faivre J, et al. Inflammatory cells infiltrated human colorectal carcinomas express HLA class II but not B7-1 and B7-2 costimulatory molecules of the T-cell activation. Lab Invest. 1996, 74:975-983.
9 Park JA, Wang E, Kurt RA, et al. Expression of an antisense transforming growth factor-bata 1 transgene reduces tumorigenicity of EMT6 mammary tumor cells. Can Gene Thera. 1997,4:42-50.
(收稿:1998-07-20 修回:1998-10-12), 百拇医药