树突状细胞和巨噬细胞对外源性抗原内吞路径的比较研究
作者:谢志芳 曹雪涛 章卫平 叶煦亭 于秉学 郑尊
单位:200433 上海,第二军医大学生物物理研究所(谢志芳、叶煦亭、于秉学、郑尊),免疫学教研室(曹雪涛、章卫平)
关键词:树突状细胞;巨噬细胞;组织相容性抗原
中华医学杂志990302 【摘要】 目的 观察并比较小鼠树突状细胞(DC)和巨噬细胞对外源性抗原的内吞路径的差异。方法 制备小鼠骨髓DC和腹腔巨噬细胞,然后让DC和巨噬细胞与辣根过氧化物酶(HRP)-5 nm胶体金共孵育10分钟后再培养0~120分钟,进行酸性磷酸酶细胞化学反应和组织相容性抗原(MHC)Ⅱ免疫胶体金标记,最后在电镜下观察5 nm胶体金的细胞内运行路径。结果 DC内吞HRP-5 nm胶体金10分钟后再培养30分钟,大部分5 nm胶体金进入MHCⅡ隔室(MIIC)中,只有极少数酸性磷酸酶阳性的溶酶体内含少量5 nm胶体金。而与DC显著不同的是巨噬细胞摄入的大部分5 nm胶体金进入了溶酶体,还有部分5 nm胶体金进入MIIC中。内吞后再培养60分钟,DC内仍有许多5 nm胶体金,而巨噬细胞内已很少见到5 nm胶体金。结论 同一种外源性抗原被DC和巨噬细胞内吞后,在这两类细胞中的运行路径明显不同。内吞后30分钟,巨噬细胞摄入的大部分抗原进入溶酶体,而DC则将大部分抗原送入MIIC,这可能与DC独特的抗原提呈功能有关。另外,巨噬细胞对抗原的清除能力比DC强得多。
, 百拇医药
The endocytic routes of exogenous antigen in murine dendritic cells and macrophages XIE Zhifang, CAO Xuetao, ZHANG Weiping, et al. Institute of Biophysics, Second Military Medical University, Shanghai, 200433
【Abstract】 Objective To compare the endocytic routes of exogenous antigen in murine dendritic cells (DC) and macrophages.Methods Murine bone marrow-derived DC and peritoneal macrophages were pulsed with HRP-5nm colloidal gold for 10 minutes and chased for 0~120 minutes in culture medium. Intracellular distribution of 5 nm colloidal gold was explored by means of cellular enzymatic-chemistry of acidic phosphatase and MHC Ⅱ cellular immunochemistry under electron microscope. Results After 10 minutes pulse with HRP-5 nm colloidal gold and then 30 minutes of chase, most of HRP-5 nm colloidal gold internalized by DC entered into MHC Ⅱ positive MIICs, but a little entered into acidic phosphatase-positive lysosomes. In contrast to DC, most of lysosomes of macrophages were accessed by HRP-5 nm colloidal gold, and a small portion of HRP-5 nm colloidal gold entered into MIICs. After 60 minutes of chase, 5nm colloidal gold could hardly be seen within macrophages, whereas most of 5 nm colloidal gold retained in DC. Conclusion The endocytic route of exogenous antigen in DC apparently differs from that in macrophages. Most of antigens taken by macrophages enter into lysosomes within 30 minutes. In the case of DC, most of internalized antigens enter into MIICs, which may be related to their unique antigen-presenting function . In addition, macrophages seem to have more powerful capacity of scavenging exogenous antigen than DC.
, http://www.100md.com
【Key words】 Dendritic cells Macrophage Histocompatibility antigens
(Natl Med J China, 1999, 79:166-169)
树突状细胞(dendritic cells, DC)是体内最重要的抗原提呈细胞(antigen presenting cells, APC),它的功能特征之一是能强有力地激活静息T细胞,诱导很强的初次免疫应答,而巨噬细胞及B细胞等其他APC只能激活已受抗原刺激的T细胞[1,2]。目前,对DC这种独特功能的作用机制尚不完全清楚,对于DC与巨噬细胞对同一种外源性抗原的加工处理有何差异也不十分明了。为此,我们以体外培养的小鼠骨髓DC和小鼠腹腔巨噬细胞为研究对象,采用酸性磷酸酶细胞化学和组织相容性抗原(MHC)Ⅱ免疫胶体金标记技术分别标记溶酶体和MHC Ⅱ隔室 (MHC Ⅱ-enriched compartment ,MIIC),观察并比较了这两类APC对外源性抗原的胞内运输路径的差异,以期能进一步揭示抗原的细胞内加工机制。
, http://www.100md.com
材料与方法
一、小鼠骨髓DC的体外扩增[3,4,5]
从C57BL/6小鼠(购自上海必凯动物有限公司)股骨中制备骨髓细胞,加入含大鼠抗小鼠CD4、CD8、B200/CD45R、Ia和FcR单抗(美国PharMingen公司)的混合液,4 ℃孵育45分钟。用0.8%Tris、NH4Cl低渗溶解红细胞,然后用等渗磷酸盐缓冲生理盐水(PBS)洗涤2次后加磁珠标记的羊抗大鼠IgG于10 ℃孵育15分钟。用PBS洗2次后过MiniMACS细胞分离柱(德国Militenyi Biotec GmbH公司),阴性选择得到的骨髓细胞(1×106/ml)用含10%小牛血清和3.3 ng/ml重组小鼠粒细胞巨噬细胞集落刺激因子 (美国Sigma公司)的RPMI1640培养基置37 ℃、5%CO2中培养,隔天轻轻振荡培养板后吸弃大部分培养液(以去除粒细胞),补充新鲜培养基继续培养。培养7天后收集悬浮细胞并转至另一新的培养板中,继续培养1天后收集悬浮的DC。经流式细胞仪分析,DC表达大鼠抗小鼠DC特异性抗原DEC205,细胞纯度大于88%。
, 百拇医药
二、腹腔巨噬细胞的制备
将C57BL/6小鼠断颈处死,用5 ml冰浴的含5%小牛血清的RPMI1640培养基冲洗出腹腔细胞,经37 ℃、5%CO2培养2小时后洗去悬浮细胞,贴壁细胞用大鼠抗小鼠巨噬细胞抗体F4/80经流式细胞仪分析鉴定为巨噬细胞,纯度大于95%。
三、树突状细胞和巨噬细胞内吞辣根过氧化物酶(HRP)-5 nm胶体金后酸性磷酸酶的电镜细胞化学反应
DC(1×106/ml)和HRP-5 nm胶体金(本室制备并纯化)于37 ℃共孵育10分钟,然后用4 ℃PBS洗两遍,重新加入培养基后在37 ℃含5%CO2孵育箱内分别培养0、30、60、120分钟,然后用2%戊二醛室温固定30分钟。酸性磷酸酶细胞化学反应按文献[6]进行。最后将细胞凝块,1%OsO4后固定2小时。按常规进行乙醇、丙酮梯度脱水,Epon 812浸透包埋,超薄切片后醋酸铀、硝酸铅染色,H-800电镜下观察结果。阴性对照组中,细胞内吞后孵育120分钟,孵育液内不加反应底物(3% β-甘油磷酸钠),其余步骤相同,以证明酶反应的特异性。
, 百拇医药
巨噬细胞内吞HRP-5 nm胶体金及酸性磷酸酶的细胞化学方法均与DC相同,但后续的制样采用原位包埋法,详见文献[7]。
四、树突状细胞和巨噬细胞内吞HRP-5 nm胶体金后MHC Ⅱ的15 nm胶体金免疫标记
内吞HRP-5 nm胶体金后不同时间的DC及巨噬细胞(内吞的时间及方法同上)用含2%多聚甲醛和0.25%戊二醛的固定液室温固定20分钟。然后经0.1 mol/L磷酸盐缓冲液(PB)充分漂洗后1%OsO4固定40分钟,乙醇梯度脱水后进行原位包埋(方法同上),超薄切片后镍网捞片。
将镍网上的超薄切片用1%H2O2室温下蚀刻6~8分钟,用双蒸水及0.05 mol/L Tris盐缓冲生理盐水(TBS)漂洗,1%牛血清白蛋白(BSA,含5 μg/ml人IgG)封闭15分钟,加第一抗体大鼠抗小鼠Ia单抗(1∶100稀释),置湿盒中4 ℃过夜后室温静置2小时。然后将标本用0.05 mol/L TBS及0.02 mol/L TBS充分漂洗,1%BSA封闭15分钟,加入第二抗体羊抗大鼠IgG-15 nm胶体金(1∶20稀释)室温静置2小时。用0.02 mol/L TBS、0.05 mol/L TBS及双蒸水充分漂洗。将切片用醋酸铀、硝酸铅染色后H-800电镜下观察结果。阴性对照组用相同亚型的无关抗体代替第一抗体,其余步骤相同。
, http://www.100md.com
结 果
一、树突状细胞和巨噬细胞内吞HRP-5 nm胶体金后酸性磷酸酶的电镜细胞化学反应
在电镜下酸性磷酸酶的阳性反应产物为黑色颗粒状或不定型沉淀。酶反应阴性对照组细胞内无反应沉淀物,说明酶反应的特异性很强。
1.树突状细胞:DC内吞HRP-5 nm胶体金10分钟后再培养30分钟,少部分酸性磷酸酶标记阳性的溶酶体内有5 nm胶体金,大部分胶体金则进入电子密度浅而酸性磷酸酶标记阴性的多泡体内(图1a)。内吞后再培养60分钟组,部分胶体金位于电子密度深而酸性磷酸酶反应阴性的多泡体,部分则进入有黑色沉淀的溶酶体中(图1b)。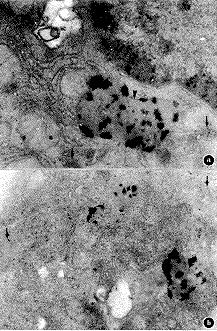
a.内吞后30分钟组;b.内吞后60分钟组;多泡体↓,溶酶体
, 百拇医药
图1 小鼠树突状细胞内吞HRP-5nm胶体金后酸性磷酸酶细胞化学反应
2.巨噬细胞:内吞后再培养30分钟组,大部分有黑色沉淀的溶酶体内含有胶体金,还有部分胶体金位于电子密度浅的多泡体中及大小不等的小泡内(图2a)。内吞后再培养60分钟组,细胞内很少见到胶体金,少数胶体金位于电子密度深的小泡内(图2b)。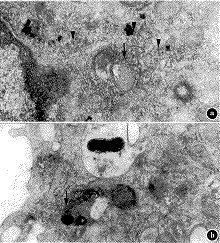
a.内吞后30分钟组;b.内吞后60分钟组;多泡体↓,溶酶体
图2 小鼠巨噬细胞内吞HRP-5 nm胶体金后酸性磷酸酶细胞化学
二、树突状细胞和巨噬细胞内吞HRP-5 nm胶体金后MHC Ⅱ的15 nm胶体金免疫标记
DC及巨噬细胞的细胞膜、某些多泡体、高尔基体及内质网均可见15 nm胶体金附着,而细胞核、溶酶体、线粒体等其他细胞器则未见到15 nm胶体金,说明在这两类细胞内MHC Ⅱ主要分布于细胞膜、MIIC、高尔基体及内质网,而细胞核、溶酶体、线粒体则不含有MHC Ⅱ分子。背景染色清洁,非特异性胶体金很少,阴性对照组细胞内无胶体金附着,表明MHC Ⅱ的免疫标记的特异性很强。
, 百拇医药
DC内吞后再培养30分钟组,大部分HRP-5 nm胶体金进入了15 nm胶体金标记阳性的多泡体内MIIC,但也有少部分含HRP-5 nm胶体金的多泡体内不被15 nm胶体金标记(图3a)。而同一实验组的巨噬细胞中,仅有少部分HRP-5 nm胶体金进入15 nm胶体金标记阳性的多泡体内MIIC,大部分含HRP-5 nm胶体金的多泡体内并无15 nm胶体金标记(图3b)。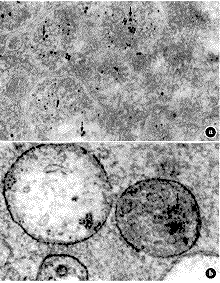
a.树突状细胞;b.巨噬细胞;15 nm胶体金↓
图3 小鼠树突状细胞和巨噬细胞内吞HRP-5nm胶体金后的MHCⅡ 15 nm胶体金免疫标记
讨 论
在免疫应答过程中,完整的外源性抗原必须首先被抗原提呈细胞摄取、加工处理后,以抗原肽-MHC Ⅱ复合物方式提呈给CD4+T细胞。已有的研究表明,在抗原提呈细胞内存在着一种特殊的富含MHC Ⅱ的多泡体或多层状膜性结构即MIIC,它可能是抗原降解加工、抗原肽与MHC II结合的潜在场所[8,9]。其特点是富含MHC Ⅱ,内含某些溶酶体酶(β-氨基乙糖苷酯酶、组织蛋白酶D),但无酸性磷酸酶及β-葡萄糖苷酯酶。而溶酶体不含MHC Ⅱ,但含有酸性磷酸酶。本实验通过酸性磷酸酶的细胞化学及MHC Ⅱ的免疫胶体金标记来区分溶酶体及MIIC,便于观察抗原的细胞内运输路径。
, 百拇医药
实验结果表明,DC和巨噬细胞内吞同一种抗原(HRP-5 nm胶体金)后,内吞抗原在这两类细胞中的运行途径明显不同。DC内吞HRP-5 nm胶体金10分钟再培养30分钟后,大部分胶体金进入MHC Ⅱ阳性的MIIC中,只有极少数酸性磷酸酶阳性的溶酶体内含少量胶体金。而巨噬细胞与DC不同的是大部分胶体金进入溶酶体,少部分胶体金进入MHC Ⅱ阳性的MIIC中。
对于上述结果我们提出两种可能的解释。一种解释是,内吞抗原被抗原提呈细胞摄取后,可能同时进入两条不同的内吞路径,一条路径是经早期内吞体进入MIIC被部分降解、加工、提呈,无法降解的产物则最后到达溶酶体;另一条路径是经早期内吞体、晚期内吞体后快速进入溶酶体进行彻底降解[10]。DC以前一条路径为主,而巨噬细胞以后一条路径为主。另一种解释是,内吞抗原被DC和巨噬细胞摄取后,都必须经早期内吞体进入MIIC最后到达溶酶体,所不同的是内吞抗原在这两类细胞中的运行速度不同。以上两种解释都需要实验的进一步证实。
, 百拇医药
根据本实验结果,我们还推测抗原提呈细胞可能并不将所有摄入细胞内的抗原都以抗原肽-MHC Ⅱ复合物的方式提呈给T细胞。在抗原提呈细胞内可能存在某些机制,将部分内吞抗原运输至MIIC使其部分降解但保留抗原肽,然后以抗原肽-MHC Ⅱ复合物方式提呈给T细胞;另一部分抗原及抗原肽则被送入溶酶体系统彻底降解,无法降解的抗原被排出胞外。与巨噬细胞相比,DC在内吞后30分钟能将大部分外源抗原送入MIIC,这可能与DC独特的抗原提呈功能有关。
实验还表明,巨噬细胞内吞抗原后孵育60分钟,细胞内已很少见到胶体金,而同一时间组的DC内仍然含有较多的胶体金。这说明巨噬细胞内吞抗原后60分钟可能已将大部分胶体金排出胞外,提示其对无法降解的抗原的清除能力很强。这可能与DC和巨噬细胞在体内的功能差异有关,DC主要执行抗原提呈功能,而巨噬细胞除执行抗原提呈功能外还具有很强的清除抗原及异物的“清道夫”功能。
本课题为国家自然科学基金资助项目(39730420)
, 百拇医药
参考文献
1 Steinman RM. The dendritic cell system and its role in immunogenicity. Annu Rev Immunol, 1991, 9: 271-296.
2 曹雪涛. 树突状细胞的基础与临床研究新进展. 中国免疫学杂志,1998,14:161-168.
3 Inaba KM, Inaba N, Romani H, et al. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor. J Exp Med, 1992, 176: 1693-1702.
, 百拇医药
4 章卫平,曹雪涛,张明徽,等. GM-CSF重组腺病毒扩增的骨髓树突状细胞体外经肿瘤抗原刺激后诱导抗肿瘤免疫应答. 中国免疫学杂志,1997,13:29.
5 曹雪涛,章卫平,马施华,等. GM-CSF基因转染增强经肿瘤抗原刺激的树突状细胞的体内抗肿作用. 中国科学(C辑),1997, 27:31.
6 小川和郎,中根一穗,主编. 钟慈声,主译. 酶组织细胞化学技术. 上海:上海医科大学出版社,1989,52-65.
7 宋雁南,朱平,吴振泽,等. 一种用反应板培养细胞原位包埋的电镜样品制备方法. 哈尔滨医科大学学报,1994,28:24.
8 Watts C. Capture and processing of exogenous antigens for presentation on MHC molecules. Annu Rev Immunol, 1997, 15: 821-850.
9 Pieters J. MHC class II restricted antigen presentation. Cur Opin Immunol. 1997, 9:89-96.
10 Mukherjee S, Ghosh, RN, Maxfield, FR. Endocytosis. Phys Rev, 1997, 77: 759-803.
(收稿:1998-07-21 修回:1998-10-12), http://www.100md.com
单位:200433 上海,第二军医大学生物物理研究所(谢志芳、叶煦亭、于秉学、郑尊),免疫学教研室(曹雪涛、章卫平)
关键词:树突状细胞;巨噬细胞;组织相容性抗原
中华医学杂志990302 【摘要】 目的 观察并比较小鼠树突状细胞(DC)和巨噬细胞对外源性抗原的内吞路径的差异。方法 制备小鼠骨髓DC和腹腔巨噬细胞,然后让DC和巨噬细胞与辣根过氧化物酶(HRP)-5 nm胶体金共孵育10分钟后再培养0~120分钟,进行酸性磷酸酶细胞化学反应和组织相容性抗原(MHC)Ⅱ免疫胶体金标记,最后在电镜下观察5 nm胶体金的细胞内运行路径。结果 DC内吞HRP-5 nm胶体金10分钟后再培养30分钟,大部分5 nm胶体金进入MHCⅡ隔室(MIIC)中,只有极少数酸性磷酸酶阳性的溶酶体内含少量5 nm胶体金。而与DC显著不同的是巨噬细胞摄入的大部分5 nm胶体金进入了溶酶体,还有部分5 nm胶体金进入MIIC中。内吞后再培养60分钟,DC内仍有许多5 nm胶体金,而巨噬细胞内已很少见到5 nm胶体金。结论 同一种外源性抗原被DC和巨噬细胞内吞后,在这两类细胞中的运行路径明显不同。内吞后30分钟,巨噬细胞摄入的大部分抗原进入溶酶体,而DC则将大部分抗原送入MIIC,这可能与DC独特的抗原提呈功能有关。另外,巨噬细胞对抗原的清除能力比DC强得多。
, 百拇医药
The endocytic routes of exogenous antigen in murine dendritic cells and macrophages XIE Zhifang, CAO Xuetao, ZHANG Weiping, et al. Institute of Biophysics, Second Military Medical University, Shanghai, 200433
【Abstract】 Objective To compare the endocytic routes of exogenous antigen in murine dendritic cells (DC) and macrophages.Methods Murine bone marrow-derived DC and peritoneal macrophages were pulsed with HRP-5nm colloidal gold for 10 minutes and chased for 0~120 minutes in culture medium. Intracellular distribution of 5 nm colloidal gold was explored by means of cellular enzymatic-chemistry of acidic phosphatase and MHC Ⅱ cellular immunochemistry under electron microscope. Results After 10 minutes pulse with HRP-5 nm colloidal gold and then 30 minutes of chase, most of HRP-5 nm colloidal gold internalized by DC entered into MHC Ⅱ positive MIICs, but a little entered into acidic phosphatase-positive lysosomes. In contrast to DC, most of lysosomes of macrophages were accessed by HRP-5 nm colloidal gold, and a small portion of HRP-5 nm colloidal gold entered into MIICs. After 60 minutes of chase, 5nm colloidal gold could hardly be seen within macrophages, whereas most of 5 nm colloidal gold retained in DC. Conclusion The endocytic route of exogenous antigen in DC apparently differs from that in macrophages. Most of antigens taken by macrophages enter into lysosomes within 30 minutes. In the case of DC, most of internalized antigens enter into MIICs, which may be related to their unique antigen-presenting function . In addition, macrophages seem to have more powerful capacity of scavenging exogenous antigen than DC.
, http://www.100md.com
【Key words】 Dendritic cells Macrophage Histocompatibility antigens
(Natl Med J China, 1999, 79:166-169)
树突状细胞(dendritic cells, DC)是体内最重要的抗原提呈细胞(antigen presenting cells, APC),它的功能特征之一是能强有力地激活静息T细胞,诱导很强的初次免疫应答,而巨噬细胞及B细胞等其他APC只能激活已受抗原刺激的T细胞[1,2]。目前,对DC这种独特功能的作用机制尚不完全清楚,对于DC与巨噬细胞对同一种外源性抗原的加工处理有何差异也不十分明了。为此,我们以体外培养的小鼠骨髓DC和小鼠腹腔巨噬细胞为研究对象,采用酸性磷酸酶细胞化学和组织相容性抗原(MHC)Ⅱ免疫胶体金标记技术分别标记溶酶体和MHC Ⅱ隔室 (MHC Ⅱ-enriched compartment ,MIIC),观察并比较了这两类APC对外源性抗原的胞内运输路径的差异,以期能进一步揭示抗原的细胞内加工机制。
, http://www.100md.com
材料与方法
一、小鼠骨髓DC的体外扩增[3,4,5]
从C57BL/6小鼠(购自上海必凯动物有限公司)股骨中制备骨髓细胞,加入含大鼠抗小鼠CD4、CD8、B200/CD45R、Ia和FcR单抗(美国PharMingen公司)的混合液,4 ℃孵育45分钟。用0.8%Tris、NH4Cl低渗溶解红细胞,然后用等渗磷酸盐缓冲生理盐水(PBS)洗涤2次后加磁珠标记的羊抗大鼠IgG于10 ℃孵育15分钟。用PBS洗2次后过MiniMACS细胞分离柱(德国Militenyi Biotec GmbH公司),阴性选择得到的骨髓细胞(1×106/ml)用含10%小牛血清和3.3 ng/ml重组小鼠粒细胞巨噬细胞集落刺激因子 (美国Sigma公司)的RPMI1640培养基置37 ℃、5%CO2中培养,隔天轻轻振荡培养板后吸弃大部分培养液(以去除粒细胞),补充新鲜培养基继续培养。培养7天后收集悬浮细胞并转至另一新的培养板中,继续培养1天后收集悬浮的DC。经流式细胞仪分析,DC表达大鼠抗小鼠DC特异性抗原DEC205,细胞纯度大于88%。
, 百拇医药
二、腹腔巨噬细胞的制备
将C57BL/6小鼠断颈处死,用5 ml冰浴的含5%小牛血清的RPMI1640培养基冲洗出腹腔细胞,经37 ℃、5%CO2培养2小时后洗去悬浮细胞,贴壁细胞用大鼠抗小鼠巨噬细胞抗体F4/80经流式细胞仪分析鉴定为巨噬细胞,纯度大于95%。
三、树突状细胞和巨噬细胞内吞辣根过氧化物酶(HRP)-5 nm胶体金后酸性磷酸酶的电镜细胞化学反应
DC(1×106/ml)和HRP-5 nm胶体金(本室制备并纯化)于37 ℃共孵育10分钟,然后用4 ℃PBS洗两遍,重新加入培养基后在37 ℃含5%CO2孵育箱内分别培养0、30、60、120分钟,然后用2%戊二醛室温固定30分钟。酸性磷酸酶细胞化学反应按文献[6]进行。最后将细胞凝块,1%OsO4后固定2小时。按常规进行乙醇、丙酮梯度脱水,Epon 812浸透包埋,超薄切片后醋酸铀、硝酸铅染色,H-800电镜下观察结果。阴性对照组中,细胞内吞后孵育120分钟,孵育液内不加反应底物(3% β-甘油磷酸钠),其余步骤相同,以证明酶反应的特异性。
, 百拇医药
巨噬细胞内吞HRP-5 nm胶体金及酸性磷酸酶的细胞化学方法均与DC相同,但后续的制样采用原位包埋法,详见文献[7]。
四、树突状细胞和巨噬细胞内吞HRP-5 nm胶体金后MHC Ⅱ的15 nm胶体金免疫标记
内吞HRP-5 nm胶体金后不同时间的DC及巨噬细胞(内吞的时间及方法同上)用含2%多聚甲醛和0.25%戊二醛的固定液室温固定20分钟。然后经0.1 mol/L磷酸盐缓冲液(PB)充分漂洗后1%OsO4固定40分钟,乙醇梯度脱水后进行原位包埋(方法同上),超薄切片后镍网捞片。
将镍网上的超薄切片用1%H2O2室温下蚀刻6~8分钟,用双蒸水及0.05 mol/L Tris盐缓冲生理盐水(TBS)漂洗,1%牛血清白蛋白(BSA,含5 μg/ml人IgG)封闭15分钟,加第一抗体大鼠抗小鼠Ia单抗(1∶100稀释),置湿盒中4 ℃过夜后室温静置2小时。然后将标本用0.05 mol/L TBS及0.02 mol/L TBS充分漂洗,1%BSA封闭15分钟,加入第二抗体羊抗大鼠IgG-15 nm胶体金(1∶20稀释)室温静置2小时。用0.02 mol/L TBS、0.05 mol/L TBS及双蒸水充分漂洗。将切片用醋酸铀、硝酸铅染色后H-800电镜下观察结果。阴性对照组用相同亚型的无关抗体代替第一抗体,其余步骤相同。
, http://www.100md.com
结 果
一、树突状细胞和巨噬细胞内吞HRP-5 nm胶体金后酸性磷酸酶的电镜细胞化学反应
在电镜下酸性磷酸酶的阳性反应产物为黑色颗粒状或不定型沉淀。酶反应阴性对照组细胞内无反应沉淀物,说明酶反应的特异性很强。
1.树突状细胞:DC内吞HRP-5 nm胶体金10分钟后再培养30分钟,少部分酸性磷酸酶标记阳性的溶酶体内有5 nm胶体金,大部分胶体金则进入电子密度浅而酸性磷酸酶标记阴性的多泡体内(图1a)。内吞后再培养60分钟组,部分胶体金位于电子密度深而酸性磷酸酶反应阴性的多泡体,部分则进入有黑色沉淀的溶酶体中(图1b)。

a.内吞后30分钟组;b.内吞后60分钟组;多泡体↓,溶酶体
, 百拇医药
图1 小鼠树突状细胞内吞HRP-5nm胶体金后酸性磷酸酶细胞化学反应
2.巨噬细胞:内吞后再培养30分钟组,大部分有黑色沉淀的溶酶体内含有胶体金,还有部分胶体金位于电子密度浅的多泡体中及大小不等的小泡内(图2a)。内吞后再培养60分钟组,细胞内很少见到胶体金,少数胶体金位于电子密度深的小泡内(图2b)。

a.内吞后30分钟组;b.内吞后60分钟组;多泡体↓,溶酶体
图2 小鼠巨噬细胞内吞HRP-5 nm胶体金后酸性磷酸酶细胞化学
二、树突状细胞和巨噬细胞内吞HRP-5 nm胶体金后MHC Ⅱ的15 nm胶体金免疫标记
DC及巨噬细胞的细胞膜、某些多泡体、高尔基体及内质网均可见15 nm胶体金附着,而细胞核、溶酶体、线粒体等其他细胞器则未见到15 nm胶体金,说明在这两类细胞内MHC Ⅱ主要分布于细胞膜、MIIC、高尔基体及内质网,而细胞核、溶酶体、线粒体则不含有MHC Ⅱ分子。背景染色清洁,非特异性胶体金很少,阴性对照组细胞内无胶体金附着,表明MHC Ⅱ的免疫标记的特异性很强。
, 百拇医药
DC内吞后再培养30分钟组,大部分HRP-5 nm胶体金进入了15 nm胶体金标记阳性的多泡体内MIIC,但也有少部分含HRP-5 nm胶体金的多泡体内不被15 nm胶体金标记(图3a)。而同一实验组的巨噬细胞中,仅有少部分HRP-5 nm胶体金进入15 nm胶体金标记阳性的多泡体内MIIC,大部分含HRP-5 nm胶体金的多泡体内并无15 nm胶体金标记(图3b)。

a.树突状细胞;b.巨噬细胞;15 nm胶体金↓
图3 小鼠树突状细胞和巨噬细胞内吞HRP-5nm胶体金后的MHCⅡ 15 nm胶体金免疫标记
讨 论
在免疫应答过程中,完整的外源性抗原必须首先被抗原提呈细胞摄取、加工处理后,以抗原肽-MHC Ⅱ复合物方式提呈给CD4+T细胞。已有的研究表明,在抗原提呈细胞内存在着一种特殊的富含MHC Ⅱ的多泡体或多层状膜性结构即MIIC,它可能是抗原降解加工、抗原肽与MHC II结合的潜在场所[8,9]。其特点是富含MHC Ⅱ,内含某些溶酶体酶(β-氨基乙糖苷酯酶、组织蛋白酶D),但无酸性磷酸酶及β-葡萄糖苷酯酶。而溶酶体不含MHC Ⅱ,但含有酸性磷酸酶。本实验通过酸性磷酸酶的细胞化学及MHC Ⅱ的免疫胶体金标记来区分溶酶体及MIIC,便于观察抗原的细胞内运输路径。
, 百拇医药
实验结果表明,DC和巨噬细胞内吞同一种抗原(HRP-5 nm胶体金)后,内吞抗原在这两类细胞中的运行途径明显不同。DC内吞HRP-5 nm胶体金10分钟再培养30分钟后,大部分胶体金进入MHC Ⅱ阳性的MIIC中,只有极少数酸性磷酸酶阳性的溶酶体内含少量胶体金。而巨噬细胞与DC不同的是大部分胶体金进入溶酶体,少部分胶体金进入MHC Ⅱ阳性的MIIC中。
对于上述结果我们提出两种可能的解释。一种解释是,内吞抗原被抗原提呈细胞摄取后,可能同时进入两条不同的内吞路径,一条路径是经早期内吞体进入MIIC被部分降解、加工、提呈,无法降解的产物则最后到达溶酶体;另一条路径是经早期内吞体、晚期内吞体后快速进入溶酶体进行彻底降解[10]。DC以前一条路径为主,而巨噬细胞以后一条路径为主。另一种解释是,内吞抗原被DC和巨噬细胞摄取后,都必须经早期内吞体进入MIIC最后到达溶酶体,所不同的是内吞抗原在这两类细胞中的运行速度不同。以上两种解释都需要实验的进一步证实。
, 百拇医药
根据本实验结果,我们还推测抗原提呈细胞可能并不将所有摄入细胞内的抗原都以抗原肽-MHC Ⅱ复合物的方式提呈给T细胞。在抗原提呈细胞内可能存在某些机制,将部分内吞抗原运输至MIIC使其部分降解但保留抗原肽,然后以抗原肽-MHC Ⅱ复合物方式提呈给T细胞;另一部分抗原及抗原肽则被送入溶酶体系统彻底降解,无法降解的抗原被排出胞外。与巨噬细胞相比,DC在内吞后30分钟能将大部分外源抗原送入MIIC,这可能与DC独特的抗原提呈功能有关。
实验还表明,巨噬细胞内吞抗原后孵育60分钟,细胞内已很少见到胶体金,而同一时间组的DC内仍然含有较多的胶体金。这说明巨噬细胞内吞抗原后60分钟可能已将大部分胶体金排出胞外,提示其对无法降解的抗原的清除能力很强。这可能与DC和巨噬细胞在体内的功能差异有关,DC主要执行抗原提呈功能,而巨噬细胞除执行抗原提呈功能外还具有很强的清除抗原及异物的“清道夫”功能。
本课题为国家自然科学基金资助项目(39730420)
, 百拇医药
参考文献
1 Steinman RM. The dendritic cell system and its role in immunogenicity. Annu Rev Immunol, 1991, 9: 271-296.
2 曹雪涛. 树突状细胞的基础与临床研究新进展. 中国免疫学杂志,1998,14:161-168.
3 Inaba KM, Inaba N, Romani H, et al. Generation of large numbers of dendritic cells from mouse bone marrow cultures supplemented with granulocyte/macrophage colony-stimulating factor. J Exp Med, 1992, 176: 1693-1702.
, 百拇医药
4 章卫平,曹雪涛,张明徽,等. GM-CSF重组腺病毒扩增的骨髓树突状细胞体外经肿瘤抗原刺激后诱导抗肿瘤免疫应答. 中国免疫学杂志,1997,13:29.
5 曹雪涛,章卫平,马施华,等. GM-CSF基因转染增强经肿瘤抗原刺激的树突状细胞的体内抗肿作用. 中国科学(C辑),1997, 27:31.
6 小川和郎,中根一穗,主编. 钟慈声,主译. 酶组织细胞化学技术. 上海:上海医科大学出版社,1989,52-65.
7 宋雁南,朱平,吴振泽,等. 一种用反应板培养细胞原位包埋的电镜样品制备方法. 哈尔滨医科大学学报,1994,28:24.
8 Watts C. Capture and processing of exogenous antigens for presentation on MHC molecules. Annu Rev Immunol, 1997, 15: 821-850.
9 Pieters J. MHC class II restricted antigen presentation. Cur Opin Immunol. 1997, 9:89-96.
10 Mukherjee S, Ghosh, RN, Maxfield, FR. Endocytosis. Phys Rev, 1997, 77: 759-803.
(收稿:1998-07-21 修回:1998-10-12), http://www.100md.com