细胞因子对树突状细胞抗肝癌作用的影响*
作者:陈海滨 张锦 黄子亮 孙劲旅 周燕琼
单位:汕头大学医学院组织学与胚胎学教研室 广东省汕头市 515031
关键词:肝肿瘤;细胞因子;树突细胞;细胞株
世界化人消化杂志990303
中国图书资料分类号 R735.7
摘 要
目的 研究人血树突状细胞(DC)和细胞因子TNF,GM-CSF或IFN-γ联合DC对淋巴因子和PHA激活的杀伤细胞(LPAK细胞)体外杀伤人肝癌细胞株BEL-7402的影响.
方法 实验分为L组(LPAK),D组(LPAK+DC),T1组(LPAK+DC+TNF 5000kU/L),T2组(LPAK+DC+TNF 500kU/L),G1组(LPAK+DC+GM-CSF 500kU/L),G2组(LPAK+DC+GM-CSF 100kU/L),I1组(LPAK+DC+IFN-γ 500kU/L)和I2组(LPAK+DC+IFN-γ 100kU/L). 每组效靶细胞比分别采用5∶1和10∶1两种. 培养48h后用中性红比色法检测细胞毒活性.
, http://www.100md.com
结果 L,D,T2和T1组的细胞毒活性依次增强,各组间差异有显著性(P<0.01). G1和G2组均高于D组(P<0.01),但G1,G2组间差异无显著性. I1,I2组与D组相比,也无显著性差异. 随效靶比增加,各组细胞毒活性均相应增强.
结论 DC能增强LPAK细胞对肝癌细胞BEL-7402的细胞毒活性;TNF或GM-CSF与DC联用,两者有协同作用;但与IFN-γ联用,则无进一步增强作用.
Effects of cytokines on dendritic
cells against human hepatoma cell
line*
CHEN Hai-Bin, ZHANG Jin-Kun, HUANG Zi-Liang, SUN Jin-Lu and ZHOU Yan-Qiong
, 百拇医药
Department of Histology and Embryology, Shantou University Medical College, Shantou 515031, Guangdong Province, China
Subject headings liver neoplasms; cytokines; dendritic cells; cell line
bstract
AIM To study the effects of human peripheral blood dendritic cells (DC) with or without TNF, GM-CSF or IFN-γ on lymphokine and PHA activated killer (LPAK) cells activity on human hepatoma cell line BEL-7402 in vitro.
, http://www.100md.com
METHODS The experiments were divided into eight groups: L group (LPAK), D group (LPAK+DC), T1 group (LPAK+DC+TNF 5000kU/L), T2 group (LPAK+DC+TNF 5000kU/L), G1 group (LPAK+DC+GM-CSF 500kU/L), G2 group (LPAK+DC+GM-CSF 100kU/L), I1 group (LPAK+DC+IFN-γ 500kU/L), I2 group (LPAK+DC+IFN-γ 100kU/L), with two ratios of effect and target (5∶1 and 10∶1) cells in each group. After culture for 48 hours, the cytotoxicity was measured with neutral red assay.
RESULTS The cytotoxic activity was sequentially enhanced from L, D, T2 to T1 group, the differences between groups were statistically significant (P<0.01). The cytotoxic activity in both group G1 and G2 was significantly higher than that in group D (P<0.01), but it had no difference between group G2 and G1 (P>0.05). There was no significant difference in cytotoxic activity among group I1,I2 and D (P>0.05). The cytotoxic activity was increased with the increase of the ratio of effect and target cells in all groups.
, 百拇医药
CONCLUSION DC can enhance cytotoxic activity of LPAK cells on BEL-7402; TNF or GM-CSF and DC synergistically enhance LPAK cell activity but no significant increase of LPAK cell activity with IFN-γ and DC cooperation.
0 引言
树突状细胞(dendritic cell, DC)是一种高效的抗原呈递细胞,在机体免疫应答中起着关键的调控作用. 由于DC有可能成为抗肿瘤免疫治疗的新手段,有关其与抗肿瘤免疫反应中的关系日益受到重视,其抗肿瘤效应受多种细胞因子的调节[1]. 我们曾报道人血DC联合LAK细胞的体外抗肿瘤作用. 现进一步观察DC和DC联合细胞因子TNF,GM-CSF或IFN-γ对LPAK细胞体外杀伤人肝癌细胞株BEL-7402的影响,以阐明DC与肿瘤免疫治疗的关系及其可能机制.
, http://www.100md.com
1 材料和方法
1.1 材料 TNF由第二军医大学神经生物学教研室提供,rhGM-CSF和IFN-γ购自军事医学科学院基础所. 人肝癌细胞株BEL-7402引自中山医科大学实验动物中心,用含100mL/L新生牛血清的RPMI 1640培养液在37℃,50mL/L CO2,饱湿条件下传代培养,细胞贴壁生长. 人外周血DC的分离:将健康人外周血单个核细胞悬液采用不连续Percoll密度梯度离心分离,收集35%~50%界面层细胞,再反复Panning数次,经36h培养后,收集高度富集的人血树突状细胞组分. LPAK细胞的诱导:分离人血单个核细胞,调整细胞浓度为2×106/mL,置含100mL/L新生牛血清的RPMI 1640培养液内,加入IL-2 1000kU/L和PHA 20mg/L,37℃,50mL/L CO2,饱湿条件下孵育7d,其间半保留换液扩增1次.
1.2 方法 抗肿瘤实验分为以下8组,L组在50μL LPAK细胞培养上清中加入BEL-7402和LPAK(浓度为4×108/L);D组为L组+DC(浓度为8×106/L);T1组为D组+TNF(5000kU/L);T2组为D组+TNF (500kU/L);G1组为D组+GM-CSF(500kU/L);G2组为D组+GM-CSF(100kU/L);I1组为D组+IFN-γ(500kU/L);I2组为D组+IFN-γ(100kU/L);各组中LPAK与BEL-7402的效靶比均采用5∶1和10∶1两种. 另设未经任何处理的BEL-7402对照组和培养液空白对照组. 每组均设3个复孔,于96孔平底培养板中37℃,50mL/L CO2,饱湿条件下培养48h后进行效应细胞的细胞毒活性检测. 实验重复4次. 中性红摄入比色法检测细胞毒活性,于每个培养孔中加入0.3g/L中性红溶液0.1mL,孵育1h,PBS洗涤3次,加入盐酸-乙醇溶液0.1mL,在Biorad 3550-UV型全自动酶联检测仪上以570nm波长测各孔吸光度(A). 细胞毒活性计算公式为:
, 百拇医药
用GB-STAT统计软件对实验数据进行方差分析.
2 结果
2.1 DC对效应细胞细胞毒活性的影响 D组对靶细胞的杀伤活性均明显高于相对应的L组(P<0.01,图1).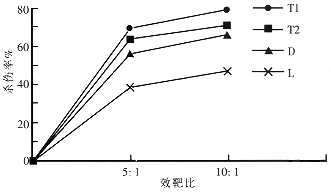
图1 TNF和DC对LPAK细胞杀伤作用的影响.
2.2 TNF联合DC对效应细胞杀伤靶细胞的影响 T1和T2组的杀伤活性均明显高于D组(P<0.01),T1与T2组间比较差异也有显著性(P<0.01).
2.3 GM-CSF联合DC对效应细胞杀伤靶细胞的影响 G1和G2组的杀伤活性均明显高于D组(P<0.01,图2),但G1与G2组间比较差异无显著性(P>0.05).
, 百拇医药
图2 GM-CSF和DC对LPAK细胞杀伤作用的影响.
2.4 IFN-γ联合DC对效应细胞杀伤靶细胞的影响 I1和I2组分别与D组相比,差异无显著性(P>0.05),I1与I2组间比较差异也无显著性(P>0.05). 不同效靶比对效应细胞杀伤靶细胞的影响,在各实验组中,效应细胞对靶细胞的杀伤活性随效靶比的增加而增强(P<0.01).
3 讨论
DC在诱发免疫反应中起关键作用. DC表面持续表达的MHC-Ⅱ类分子和B7分子能有效地与肿瘤抗原结合并呈递肿瘤抗原,DC还可作为肿瘤免疫反应的启动因素,在肿瘤免疫的产生和调节中发挥关键作用[1]. 动物实验中,DC能诱导动物对实验诱发性肿瘤的免疫反应,导致肿瘤消退或生长延缓. 临床上,肿瘤部位DC的数量与肿瘤淋巴结转移及临床预后密切相关. 我们在体外实验中,已发现人血DC能与LAK细胞形成细胞簇,从而提供了一个稳定的微环境,促进了LAK细胞的增殖活化,并有利于LAK细胞识别肿瘤细胞膜上的抗原共同决定簇. 我们也发现DC有增强LAK细胞体外抗人鼻咽癌细胞的作用. 本实验中D组和L组相比,差异有高度显著性,表明人血DC也能明显增强LPAK对人肝癌细胞的杀伤活性.
, 百拇医药
DC的辅助功能还与某些细胞因子的参与有关. 细胞因子控制DC的发育和成熟,如TNF和GM-CSF联合可以使人骨髓或新生儿脐带血中的CD34+前体细胞发育成DC,进一步的研究证实,在此过程中必须有TNF作为第一信号,上调DC前体细胞的GM-CSF受体的水平,这种上调作用不仅存在于DC发育的早期,而且在DC的整个发育过程中均保持在高水平,进而增强DC的活力和抗肿瘤功能[2]. TNF还增强DC的抗原呈递能力[3]. 因而我们认为,本实验显示的TNF和DC联用能明显提高LPAK细胞的抗肿瘤效应,除了TNF能直接杀伤或抑制肝癌细胞,增强LAK活性,介导LAK细胞的杀伤作用外,还与TNF和LPAK细胞诱生体系中的GM-CSF共同作用,促进了新鲜分离的DC中部分未成熟的前体细胞成熟的功能,从而增强了LPAK细胞的杀伤活性. TNF的这种作用随着剂量的增加而增强.
GM-CSF可影响上皮性肿瘤组织内DC的分布、成熟和功能,并可能决定了DC是诱导抗肿瘤免疫还是诱导免疫耐受[4]. GM-CSF又能促进体外DC的增殖和分化,促进未成熟的DC(包括MHC-Ⅱ类分子阴性的外周血前体细胞)发育成熟,转为具有免疫刺激力的成熟DC[5,6]. Schwarz et al[2]进一步证实,GM-CSF的重要意义不仅在于启动DC的发育、促进DC的成熟,还控制着DC的活力和抗肿瘤免疫功能. 由于GM-CSF不能直接调节LAK细胞的活性,而人外周血新鲜分离的DC中又存在部分未成熟的前体细胞[7]. 故本实验显示的GM-CSF能明显提高LAK细胞的抗肿瘤效应,主要是因为GM-CSF促进血中DC前体细胞的成熟和功能,进而增强了LAK杀伤肝癌细胞的活性. 实验中GM-CSF浓度在100kU/L时已达到最大效应,提高浓度并无意义,这对进一步的病理和临床研究有参考价值.
, 百拇医药
IFN-γ对DC的作用主要是增加DC表面MHC和共刺激/粘附分子的表达,从而增强DC将肿瘤抗原呈递给T细胞的能力[8]和使DC的NOS基因活化,产生NO,抑制肿瘤细胞的核糖核酸还原酶和线粒体氧化作用,增强其抗肿瘤活性[9]. IFN-γ对LAK细胞诱导分化的早期起重要促进作用,还能显著增强LAK活性,参与LAK细胞的杀伤机制. 但我们的实验结果表明,在加入DC后,再给予IFN-γ不能进一步增强LPAK的活性. 这可能是由于LPAK细胞培养上清中存在着由IL-2介导产生的少量IFN-γ, 加入的DC又能进一步介导IFN-γ的生成[10],使内源性IFN-γ的含量升高并达到最大效应,以致继续加入外源性IFN-γ时,不论剂量大小,都不再增强LPAK细胞的杀伤活性.
作者简介:
陈海滨,男,1963-10-29生,安徽省霍山县人,汉族. 1985年皖南医学院医学系本科毕业,1991年南京铁道医学院硕士,副教授,主要从事免疫细胞及其抗肿瘤研究,发表论文18篇.
, 百拇医药
*广东省高校自然科学重点资助项目,No.19952901
通讯作者 陈海滨,515031,汕头大学医学院组织学与胚胎学教研室,广东省汕头市新陵路3号.
*Supported by Natural Science Foundation of the Administration of Higher Education of Guangdong Province, No.19952901.
Correspondence to:Dr. CHEN Hai-Bin, Department of Histology and Embryology, Shantou University Medical College, 3 Xinling Road, Shantou 515031, Guangdong Province, China
, 百拇医药
Tel. +86.754.8551151 Ext. 2087, Fax. +86.754.8557562
4 参考文献
[1] Grabbe S, Beissert S, Schwarz T, Granstein RD. Dendritic cells as initiators of tumor immune responses: a possible strategy for tumor immunotherapy Immunol Today, 1995;16:117-121
[2] Santiago-Schwarz F, Divaris N, Kay C, Carsons SE. Mechanisms of tumor necrosis factor-granulocyte-macrophage colony-stimulating factor-Induced dendritic cell development. Blood, 1993;82:3019-3028
, 百拇医药
[3] 严俊,许化溪,邵启祥,潘志超,付翠梅,刘恭植. 树突状细胞抗原提呈活化T细胞的机制研究. 免疫学杂志,1995;11:210
[4] 李存玺,高进. 树突状细胞研究进展与肿瘤免疫. 中国肿瘤生物治疗杂志,1995;2:365-366
[5] Scheicher C, Mehlig M, Zecher R, Seiler F, Hintz-Obertreis P, Reske K. Recombinant GM-CSF induces in vitro differentiation of dendritic cells from mouse bone marrow. Adv Exp Med Biol, 1993;329:269-273
[6] Stingl G, Bergstresser RP. Dendritic cells: a major story unfolds. Immunol Today, 1995;16:330-333
, 百拇医药
[7] Austyn JM. New insights into the mobilization and phagocytic activity of dendritic cells. J Exp Med, 1996;183:1287-1292
[8] Lutz MB, Assmann CU, Girolomoni G, Ricciardi-Castagnoli P. Different cytokines regulate antigen uptake and presentation of a precuror dendritic cell line. Eur J Immunol, 1996;26:586-594
[9] Becker Y. Success and failure of dendritic cell (DC) anticancer activity may be modulated by nitric oxide synthetase (NOS) gene expression: a hypothesis. In Vivo 1993;7:285-288
[10] Heufler C, Koch F, Stanzl U, Topar G, Wysocka M, Trinchieri G. Interleukin-12 is produced by dendritic cells and mediates T helper 1 development as well as interferon-γ prodution by T helper 1 cells. Eur J Immunol, 1996;26:659-668
收稿日期 1998-08-21, http://www.100md.com
单位:汕头大学医学院组织学与胚胎学教研室 广东省汕头市 515031
关键词:肝肿瘤;细胞因子;树突细胞;细胞株
世界化人消化杂志990303
中国图书资料分类号 R735.7
摘 要
目的 研究人血树突状细胞(DC)和细胞因子TNF,GM-CSF或IFN-γ联合DC对淋巴因子和PHA激活的杀伤细胞(LPAK细胞)体外杀伤人肝癌细胞株BEL-7402的影响.
方法 实验分为L组(LPAK),D组(LPAK+DC),T1组(LPAK+DC+TNF 5000kU/L),T2组(LPAK+DC+TNF 500kU/L),G1组(LPAK+DC+GM-CSF 500kU/L),G2组(LPAK+DC+GM-CSF 100kU/L),I1组(LPAK+DC+IFN-γ 500kU/L)和I2组(LPAK+DC+IFN-γ 100kU/L). 每组效靶细胞比分别采用5∶1和10∶1两种. 培养48h后用中性红比色法检测细胞毒活性.
, http://www.100md.com
结果 L,D,T2和T1组的细胞毒活性依次增强,各组间差异有显著性(P<0.01). G1和G2组均高于D组(P<0.01),但G1,G2组间差异无显著性. I1,I2组与D组相比,也无显著性差异. 随效靶比增加,各组细胞毒活性均相应增强.
结论 DC能增强LPAK细胞对肝癌细胞BEL-7402的细胞毒活性;TNF或GM-CSF与DC联用,两者有协同作用;但与IFN-γ联用,则无进一步增强作用.
Effects of cytokines on dendritic
cells against human hepatoma cell
line*
CHEN Hai-Bin, ZHANG Jin-Kun, HUANG Zi-Liang, SUN Jin-Lu and ZHOU Yan-Qiong
, 百拇医药
Department of Histology and Embryology, Shantou University Medical College, Shantou 515031, Guangdong Province, China
Subject headings liver neoplasms; cytokines; dendritic cells; cell line
bstract
AIM To study the effects of human peripheral blood dendritic cells (DC) with or without TNF, GM-CSF or IFN-γ on lymphokine and PHA activated killer (LPAK) cells activity on human hepatoma cell line BEL-7402 in vitro.
, http://www.100md.com
METHODS The experiments were divided into eight groups: L group (LPAK), D group (LPAK+DC), T1 group (LPAK+DC+TNF 5000kU/L), T2 group (LPAK+DC+TNF 5000kU/L), G1 group (LPAK+DC+GM-CSF 500kU/L), G2 group (LPAK+DC+GM-CSF 100kU/L), I1 group (LPAK+DC+IFN-γ 500kU/L), I2 group (LPAK+DC+IFN-γ 100kU/L), with two ratios of effect and target (5∶1 and 10∶1) cells in each group. After culture for 48 hours, the cytotoxicity was measured with neutral red assay.
RESULTS The cytotoxic activity was sequentially enhanced from L, D, T2 to T1 group, the differences between groups were statistically significant (P<0.01). The cytotoxic activity in both group G1 and G2 was significantly higher than that in group D (P<0.01), but it had no difference between group G2 and G1 (P>0.05). There was no significant difference in cytotoxic activity among group I1,I2 and D (P>0.05). The cytotoxic activity was increased with the increase of the ratio of effect and target cells in all groups.
, 百拇医药
CONCLUSION DC can enhance cytotoxic activity of LPAK cells on BEL-7402; TNF or GM-CSF and DC synergistically enhance LPAK cell activity but no significant increase of LPAK cell activity with IFN-γ and DC cooperation.
0 引言
树突状细胞(dendritic cell, DC)是一种高效的抗原呈递细胞,在机体免疫应答中起着关键的调控作用. 由于DC有可能成为抗肿瘤免疫治疗的新手段,有关其与抗肿瘤免疫反应中的关系日益受到重视,其抗肿瘤效应受多种细胞因子的调节[1]. 我们曾报道人血DC联合LAK细胞的体外抗肿瘤作用. 现进一步观察DC和DC联合细胞因子TNF,GM-CSF或IFN-γ对LPAK细胞体外杀伤人肝癌细胞株BEL-7402的影响,以阐明DC与肿瘤免疫治疗的关系及其可能机制.
, http://www.100md.com
1 材料和方法
1.1 材料 TNF由第二军医大学神经生物学教研室提供,rhGM-CSF和IFN-γ购自军事医学科学院基础所. 人肝癌细胞株BEL-7402引自中山医科大学实验动物中心,用含100mL/L新生牛血清的RPMI 1640培养液在37℃,50mL/L CO2,饱湿条件下传代培养,细胞贴壁生长. 人外周血DC的分离:将健康人外周血单个核细胞悬液采用不连续Percoll密度梯度离心分离,收集35%~50%界面层细胞,再反复Panning数次,经36h培养后,收集高度富集的人血树突状细胞组分. LPAK细胞的诱导:分离人血单个核细胞,调整细胞浓度为2×106/mL,置含100mL/L新生牛血清的RPMI 1640培养液内,加入IL-2 1000kU/L和PHA 20mg/L,37℃,50mL/L CO2,饱湿条件下孵育7d,其间半保留换液扩增1次.
1.2 方法 抗肿瘤实验分为以下8组,L组在50μL LPAK细胞培养上清中加入BEL-7402和LPAK(浓度为4×108/L);D组为L组+DC(浓度为8×106/L);T1组为D组+TNF(5000kU/L);T2组为D组+TNF (500kU/L);G1组为D组+GM-CSF(500kU/L);G2组为D组+GM-CSF(100kU/L);I1组为D组+IFN-γ(500kU/L);I2组为D组+IFN-γ(100kU/L);各组中LPAK与BEL-7402的效靶比均采用5∶1和10∶1两种. 另设未经任何处理的BEL-7402对照组和培养液空白对照组. 每组均设3个复孔,于96孔平底培养板中37℃,50mL/L CO2,饱湿条件下培养48h后进行效应细胞的细胞毒活性检测. 实验重复4次. 中性红摄入比色法检测细胞毒活性,于每个培养孔中加入0.3g/L中性红溶液0.1mL,孵育1h,PBS洗涤3次,加入盐酸-乙醇溶液0.1mL,在Biorad 3550-UV型全自动酶联检测仪上以570nm波长测各孔吸光度(A). 细胞毒活性计算公式为:

, 百拇医药
用GB-STAT统计软件对实验数据进行方差分析.
2 结果
2.1 DC对效应细胞细胞毒活性的影响 D组对靶细胞的杀伤活性均明显高于相对应的L组(P<0.01,图1).

图1 TNF和DC对LPAK细胞杀伤作用的影响.
2.2 TNF联合DC对效应细胞杀伤靶细胞的影响 T1和T2组的杀伤活性均明显高于D组(P<0.01),T1与T2组间比较差异也有显著性(P<0.01).
2.3 GM-CSF联合DC对效应细胞杀伤靶细胞的影响 G1和G2组的杀伤活性均明显高于D组(P<0.01,图2),但G1与G2组间比较差异无显著性(P>0.05).

, 百拇医药
图2 GM-CSF和DC对LPAK细胞杀伤作用的影响.
2.4 IFN-γ联合DC对效应细胞杀伤靶细胞的影响 I1和I2组分别与D组相比,差异无显著性(P>0.05),I1与I2组间比较差异也无显著性(P>0.05). 不同效靶比对效应细胞杀伤靶细胞的影响,在各实验组中,效应细胞对靶细胞的杀伤活性随效靶比的增加而增强(P<0.01).
3 讨论
DC在诱发免疫反应中起关键作用. DC表面持续表达的MHC-Ⅱ类分子和B7分子能有效地与肿瘤抗原结合并呈递肿瘤抗原,DC还可作为肿瘤免疫反应的启动因素,在肿瘤免疫的产生和调节中发挥关键作用[1]. 动物实验中,DC能诱导动物对实验诱发性肿瘤的免疫反应,导致肿瘤消退或生长延缓. 临床上,肿瘤部位DC的数量与肿瘤淋巴结转移及临床预后密切相关. 我们在体外实验中,已发现人血DC能与LAK细胞形成细胞簇,从而提供了一个稳定的微环境,促进了LAK细胞的增殖活化,并有利于LAK细胞识别肿瘤细胞膜上的抗原共同决定簇. 我们也发现DC有增强LAK细胞体外抗人鼻咽癌细胞的作用. 本实验中D组和L组相比,差异有高度显著性,表明人血DC也能明显增强LPAK对人肝癌细胞的杀伤活性.
, 百拇医药
DC的辅助功能还与某些细胞因子的参与有关. 细胞因子控制DC的发育和成熟,如TNF和GM-CSF联合可以使人骨髓或新生儿脐带血中的CD34+前体细胞发育成DC,进一步的研究证实,在此过程中必须有TNF作为第一信号,上调DC前体细胞的GM-CSF受体的水平,这种上调作用不仅存在于DC发育的早期,而且在DC的整个发育过程中均保持在高水平,进而增强DC的活力和抗肿瘤功能[2]. TNF还增强DC的抗原呈递能力[3]. 因而我们认为,本实验显示的TNF和DC联用能明显提高LPAK细胞的抗肿瘤效应,除了TNF能直接杀伤或抑制肝癌细胞,增强LAK活性,介导LAK细胞的杀伤作用外,还与TNF和LPAK细胞诱生体系中的GM-CSF共同作用,促进了新鲜分离的DC中部分未成熟的前体细胞成熟的功能,从而增强了LPAK细胞的杀伤活性. TNF的这种作用随着剂量的增加而增强.
GM-CSF可影响上皮性肿瘤组织内DC的分布、成熟和功能,并可能决定了DC是诱导抗肿瘤免疫还是诱导免疫耐受[4]. GM-CSF又能促进体外DC的增殖和分化,促进未成熟的DC(包括MHC-Ⅱ类分子阴性的外周血前体细胞)发育成熟,转为具有免疫刺激力的成熟DC[5,6]. Schwarz et al[2]进一步证实,GM-CSF的重要意义不仅在于启动DC的发育、促进DC的成熟,还控制着DC的活力和抗肿瘤免疫功能. 由于GM-CSF不能直接调节LAK细胞的活性,而人外周血新鲜分离的DC中又存在部分未成熟的前体细胞[7]. 故本实验显示的GM-CSF能明显提高LAK细胞的抗肿瘤效应,主要是因为GM-CSF促进血中DC前体细胞的成熟和功能,进而增强了LAK杀伤肝癌细胞的活性. 实验中GM-CSF浓度在100kU/L时已达到最大效应,提高浓度并无意义,这对进一步的病理和临床研究有参考价值.
, 百拇医药
IFN-γ对DC的作用主要是增加DC表面MHC和共刺激/粘附分子的表达,从而增强DC将肿瘤抗原呈递给T细胞的能力[8]和使DC的NOS基因活化,产生NO,抑制肿瘤细胞的核糖核酸还原酶和线粒体氧化作用,增强其抗肿瘤活性[9]. IFN-γ对LAK细胞诱导分化的早期起重要促进作用,还能显著增强LAK活性,参与LAK细胞的杀伤机制. 但我们的实验结果表明,在加入DC后,再给予IFN-γ不能进一步增强LPAK的活性. 这可能是由于LPAK细胞培养上清中存在着由IL-2介导产生的少量IFN-γ, 加入的DC又能进一步介导IFN-γ的生成[10],使内源性IFN-γ的含量升高并达到最大效应,以致继续加入外源性IFN-γ时,不论剂量大小,都不再增强LPAK细胞的杀伤活性.
作者简介:
陈海滨,男,1963-10-29生,安徽省霍山县人,汉族. 1985年皖南医学院医学系本科毕业,1991年南京铁道医学院硕士,副教授,主要从事免疫细胞及其抗肿瘤研究,发表论文18篇.
, 百拇医药
*广东省高校自然科学重点资助项目,No.19952901
通讯作者 陈海滨,515031,汕头大学医学院组织学与胚胎学教研室,广东省汕头市新陵路3号.
*Supported by Natural Science Foundation of the Administration of Higher Education of Guangdong Province, No.19952901.
Correspondence to:Dr. CHEN Hai-Bin, Department of Histology and Embryology, Shantou University Medical College, 3 Xinling Road, Shantou 515031, Guangdong Province, China
, 百拇医药
Tel. +86.754.8551151 Ext. 2087, Fax. +86.754.8557562
4 参考文献
[1] Grabbe S, Beissert S, Schwarz T, Granstein RD. Dendritic cells as initiators of tumor immune responses: a possible strategy for tumor immunotherapy Immunol Today, 1995;16:117-121
[2] Santiago-Schwarz F, Divaris N, Kay C, Carsons SE. Mechanisms of tumor necrosis factor-granulocyte-macrophage colony-stimulating factor-Induced dendritic cell development. Blood, 1993;82:3019-3028
, 百拇医药
[3] 严俊,许化溪,邵启祥,潘志超,付翠梅,刘恭植. 树突状细胞抗原提呈活化T细胞的机制研究. 免疫学杂志,1995;11:210
[4] 李存玺,高进. 树突状细胞研究进展与肿瘤免疫. 中国肿瘤生物治疗杂志,1995;2:365-366
[5] Scheicher C, Mehlig M, Zecher R, Seiler F, Hintz-Obertreis P, Reske K. Recombinant GM-CSF induces in vitro differentiation of dendritic cells from mouse bone marrow. Adv Exp Med Biol, 1993;329:269-273
[6] Stingl G, Bergstresser RP. Dendritic cells: a major story unfolds. Immunol Today, 1995;16:330-333
, 百拇医药
[7] Austyn JM. New insights into the mobilization and phagocytic activity of dendritic cells. J Exp Med, 1996;183:1287-1292
[8] Lutz MB, Assmann CU, Girolomoni G, Ricciardi-Castagnoli P. Different cytokines regulate antigen uptake and presentation of a precuror dendritic cell line. Eur J Immunol, 1996;26:586-594
[9] Becker Y. Success and failure of dendritic cell (DC) anticancer activity may be modulated by nitric oxide synthetase (NOS) gene expression: a hypothesis. In Vivo 1993;7:285-288
[10] Heufler C, Koch F, Stanzl U, Topar G, Wysocka M, Trinchieri G. Interleukin-12 is produced by dendritic cells and mediates T helper 1 development as well as interferon-γ prodution by T helper 1 cells. Eur J Immunol, 1996;26:659-668
收稿日期 1998-08-21, http://www.100md.com